RASSF10基因在贲门腺癌组织中的甲基化状态及表达
河北医科大学第四医院河北省肿瘤研究所病理研究室,河北 石家庄 050011
RASSF10基因在贲门腺癌组织中的甲基化状态及表达
崔建利 郭炜 郭艳丽 沈素朋 董稚明
河北医科大学第四医院河北省肿瘤研究所病理研究室,河北 石家庄 050011
背景与目的:Ras相关域家族10基因(Ras-association domain family 10,RASSF10)在多种肿瘤组织中具有肿瘤抑制功能,然而在贲门腺癌组织中的研究尚未见报道。检测贲门腺癌(gastric cardia adenocarcinoma,GCA)组织中RASSF10基因的甲基化状态及表达情况,进一步探讨RASSF10基因在GCA发生、发展中的作用。方法:分别应用甲基化特异性聚合酶链式反应(methylation specific polymerase chain reaction,MSP)、逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)及免疫组织化学方法检测81例GCA患者癌组织及癌旁正常组织中RASSF10基因的甲基化状态及mRNA和蛋白表达情况。结果:RASSF10基因在GCA组织中的启动子区甲基化率(64.2%,52/81)显著高于癌旁正常组织(21.0%,17/81,P<0.05),并与肿瘤组织的TNM分期、分化程度及淋巴结转移相关(P均<0.05)。RASSF10基因在GCA组织中的mRNA表达量(0.57±0.05)显著低于癌旁正常组织(0.78±0.02,P<0.05),并与肿瘤组织的TNM分期及淋巴结转移相关(P均<0.05)。RASSF10蛋白在GCA组织中的阳性表达率(31.1%,26/81)明显低于癌旁正常组织(71.6%,58/81,P<0.05),并与肿瘤组织的TNM分期、分化程度及淋巴结转移相关(P均<0.05)。RASSF10基因在GCA组织中的甲基化率与其蛋白表达呈明显的负相关。结论:RASSF10基因启动子区的异常高甲基化导致的基因沉默可能是GCA发生的机制之一。
贲门腺癌;甲基化;RASSF10基因
贲门癌是发生于贲门黏膜上皮及腺体的癌,主要指原发于或占据于胃食管交接处以下2 cm内的肿瘤,主要组织学类型是腺癌[1]。以往贲门癌常被列入食管癌或胃癌,近年随着病理诊断技术及内镜筛查方法的不断改进而将其独立出来,其发病部位与Barrett食管接近,其形态学、病因、治疗和预防均不同于胃远端腺癌,临床症状隐匿,绝大多数患者确诊时已属中晚期,其发病率呈逐年上升趋势。由于其部位的特殊性,及表型、生长方式、组织学、细胞分化等方面具有多样性的特征,近年来受到越来越多研究者的关注[2]。然而其发病机制尚未完全明确,因此,明确其发生、发展的分子机制对于早期检测及治疗显得尤为重要。Ras相关域家族(Ras-association domain family,RASSFs)共包含10个成员,RASSF1-RASSF10、RASSF1-6为经典家族成员,RASSF7-10为N-端家族成员[3]。RASSF10基因属于N-端家族成员之一,编码N-端RA相关域,缺乏经典家族成员特有的Sav-Ras-Hippo(SARAH)作用域。该基因为单一外显子基因,编码507个氨基酸,定位于染色体11p15.2,位置上靠近RRAS2基因[4]。研究表明RASSFs成员在多种实体肿瘤组织中发生表观遗传失活。目前,有关RASSF10基因在(gastric cardia adenocarcinoma,GCA)组织中的研究还尚未报道。本研究检测了组织中RASSF10基因的甲基化状态及表达情况,旨在探讨其在GCA发生、发展中的作用,以便探究GCA发生的表观遗传学机制。
1 材料和方法
1.1 材料
1.1.1 主要试剂
蛋白酶K、甲基化酶SssⅠ购自Merck公司,DNA纯化试剂盒、蓝色体系、购自Promega公司。TRIzol购自Invitrogen公司,逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒购自Fomentas公司,绿色体系购自Promega公司。所有引物均由北京赛百盛基因技术有限公司合成。RASSF10兔抗人多克隆抗体、免疫组织化学SP试剂盒、DAB显色剂购自河北博海生物工程开发有限公司。
1.1.2 标本
收集河北医科大学第四医院2011年9月—2012年9月间的GCA手术患者,共81例,其中男性50例,女性31例,年龄37~75岁,中位年龄58岁,所有患者术前均未给予任何放疗与化疗,标本及其资料的收集均经患者本人签署知情同意书,且该研究经当地伦理委员会批准。标本取自贲门腺癌原发灶及相应癌旁正常组织(距离原发灶边缘2 cm以上)。手术切除所采集的标本,一部分用4%中性甲醛溶液固定,用于常规石蜡包埋,行免疫组织化学染色。另一部分用液氮保存,用于DNA和RNA提取,行甲基化特异性聚合酶链式反应(methylation specific polymerase chain reaction,MSP)和RTPCR检测。所有标本均经3位资深病理医师通过HE染色确诊。按肿瘤病理学分级,高分化25例(30.9%),中分化10例(12.3%),低分化46例(56.8%)。按国际抗癌联盟(UICC)标准进行TNM分期:Ⅰ期10例(12.4%),Ⅱ期56例(69.0%),Ⅲ期10例(12.4%),Ⅳ期5例(6.2%)。有淋巴结转移者38例,无淋巴结转移者43例。
1.2 方法
1.2.1 MSP方法检测RASSF10基因CpG岛的甲基化状态
每个标本均取10 μm石蜡切片约15片,经蛋白酶K消化后,运用酚/氯仿抽提法提取GCA组织及相应癌旁正常组织中的DNA,取2 μg DNA标本进行亚硫酸氢盐转换,依照DNA纯化试剂盒步骤进行纯化。通过亚硫酸氢盐处理后,单链DNA中未甲基化的胞嘧啶(C)可脱去氨基转为尿嘧啶(U),而甲基化的胞嘧啶在甲基的保护作用下不能转为尿嘧啶。运用MethPrimer对RASSF10基因CpG岛的分布情况进行在线预测并结合亚硫酸氢盐转换的原理分别设计相应引物(图1),以检测RASSF10基因的甲基化状态,引物、退火温度见表1。反应条件为: 95 ℃预变性10 min;95 ℃变性45 s,退火45 s,72 ℃延伸50 s,35个循环后,72 ℃终延伸7 min。将扩增产物用2%琼脂糖凝胶进行电泳,用UV凝胶电泳成像仪进行图像分析。阳性对照为甲基化酶SssⅠ处理基因组DNA进行PCR,阴性对照为灭菌双蒸水替代DNA模板进行PCR。随机选择10%标本进行重复以保证MSP的可靠性。
1.2.2 RT-PCR的方法检测RASSF10 mRNA的表达
取冻存组织每例大约100 mg剪碎研磨,按TRIzol试剂说明提取RNA,并测定浓度及纯度。严格按照逆转录试剂盒步骤将RNA反转录为cDNA。以GAPDH作为内参照,引物、退火温度见表1。反应条件为:95 ℃预变性10 min;95 ℃变性45 s,退火45 s,72 ℃延伸50 s,35个循环后,72 ℃终延伸7 min。将扩增产物用2%琼脂糖凝胶进行电泳。利用Gel work-2ID软件,对电泳图像中RASSF10基因mRNA表达水平进行半定量研究。以RASSF10基因条带的吸光度值和GAPDH条带的吸光度值的比值表示RASSF10基因mRNA的相对表达水平。实验重复3次,取平均值。
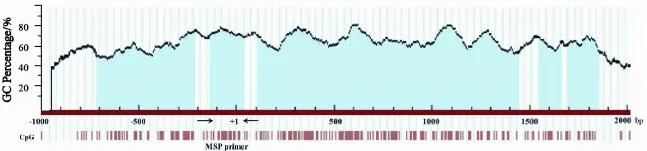
图1 RASSF10基因CpG岛分布及MSP引物位置Fig. 1 CpG islands of RASSF10 gene and the location of primer for MSP
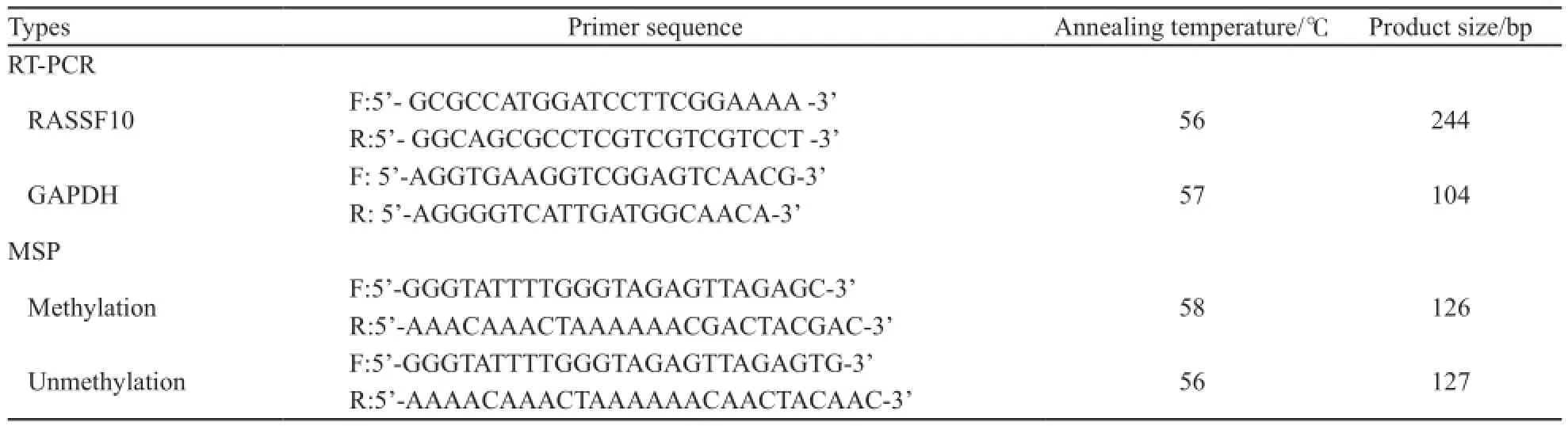
表1 RASSF10基因RT-PCR、MSP引物及反应条件Tab. 1 Primer sequences and reaction conditions of RT-PCR and MSP for RASSF10 gene
1.2.3 免疫组织化学方法检测RASSF10蛋白表达
组织经脱水、包埋后每例常规3 μm连续切片,平贴于防脱载玻片上,置60 ℃烤箱中2 h备用。采用SP法,切片常规脱蜡,过氧化氢/甲醇溶液滴加于组织,室温避光修复20 min以封闭内源性过氧化物酶,EDTA缓冲液高压锅抗原热修复4 min。滴加一抗(稀释比例为1∶100),在4 ℃冰箱中过夜。次日依次滴加二抗和三抗试剂,显微镜下DAB显色,蒸馏水终止显色。苏木素细胞核复染,逐级脱水,透明,中性树胶封片。PBS代替一抗作为空白对照,余步骤同上。正常胃黏膜组织为阳性对照。RASSF10蛋白以细胞核中出现棕褐/棕黄色颗粒为阳性表达,判定标准[5]:按照多数阳性细胞的染色强度列为4个等级:无显色0分;淡黄色1分;棕黄色2分;棕褐色3分。镜下阳性细胞数所占比例≤25%为0分;26%~50%为1分;51%~75%为2分;>75%为3分。将以上两项得分相加:0分记为“-”,1~2分记为“+”,3~4分记为“++”,5~6分记为“+++”。其中“++”、“+++”为阳性表达,“-”、“+”为阴性表达。
1.3 统计学处理
采用SPSS 13.0统计软件进行数据分析。MSP及免疫组化实验结果与临床病理资料间的关系采用χ2和校正χ2检验的统计方法,RT-PCR与临床病理资料及MSP间的关系采用t检验和近似t检验,MSP与免疫组化间的关系采用χ2检验及Spearman相关性分析的统计方法。以上均为双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 RASSF10基因在GCA中的甲基化状态
全部81例GCA组织及癌旁正常组织均成功进行了MSP检测(图2)。结果显示,RASSF10基因启动子区在GCA组织和癌旁正常组织中的甲基化率分别为64.2%(52/81)和21.0%(17/81),GCA组织中RASSF10基因启动子区甲基化率显著高于癌旁正常组织(P=0.010)。分组分析发现,有淋巴结转移组的甲基化发生率(76.3%,29/38)显著高于无淋巴结转移组(53.5%,23/43,χ2=4.574,P=0.032);Ⅲ、Ⅳ期组甲基化发生率(86.7%,13/15)明显高于Ⅰ、Ⅱ期组(59.1%,39/66,χ2=4.044,P=0.044);低分化组甲基化发生率(87.0%,40/46)明显高于高、中分化组(34.3%,12/35,χ2=23.991,P=0.000);年龄<60岁组的甲基化发生率为65.3%(32/49),≥60岁组的甲基化发生率为62.5%(20/32),两者差异无统计学意义(χ2=0.066,P=0.797);男性组的甲基化发生率为64.0%(32/50),女性组的甲基化发生率为64.5%(20/31),两者差异无统计学意义(χ2=0.002,P=0.962,表2)。

图2 GCA中RASSF10基因的甲基化状态Fig. 2 Methylation analysis of RASSF10 gene in GCA tissues
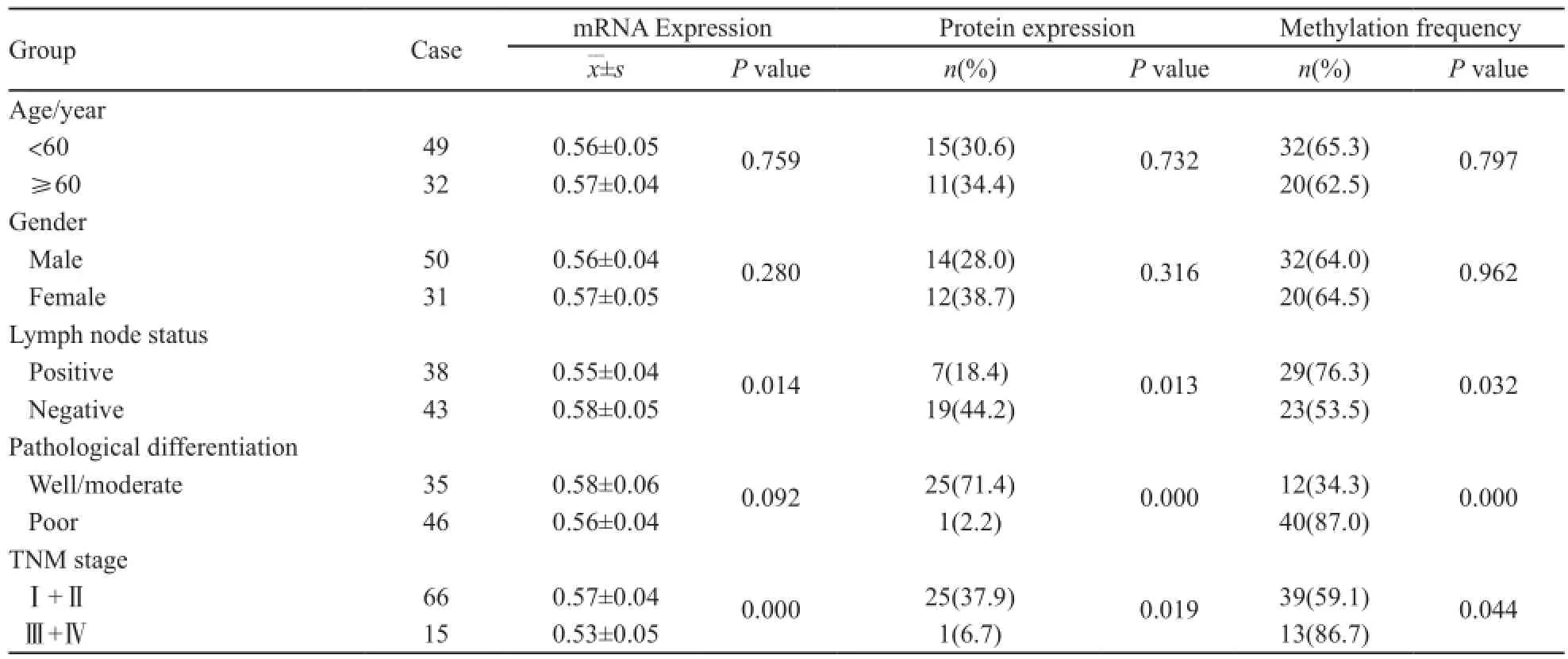
表2 GCA组织中RASSF10基因的mRNA和蛋白表达、甲基化状态及其与临床病理资料之间的关系Tab. 2 The relationship between mRNA, protein expression, methylation status of RASSF10 gene and GCA clinical pathological data
2.2 RASSF10基因mRNA在GCA组织中的表达
在81例GCA组织及相应癌旁正常组织中检测了RASSF10基因mRNA的表达(图3)。GCA组织中RASSF10基因mRNA的相对表达量(0.57±0.05)显著低于癌旁正常组织(0.78±0.02),差异有统计学意义(t=-36.940,P=0.000)。分组分析发现,有淋巴结转移组的RASSF10基因mRNA相对表达量(0.55±0.04)显著低于无淋巴结转移组(0.58±0.05,t=-2.512,P=0.014);Ⅰ、Ⅱ期RASSF10 mRNA相对表达量(0.57±0.04)显著高于Ⅲ、Ⅳ期RASSF10 mRNA相对表达量(0.53±0.05,t=4.086,P=0.000);高、中分化组RASSF10 mRNA的相对表达量为0.58±0.06,低分化组RASSF10 mRNA相对表达量为0.56±0.04,差异无统计学意义(t=1.711,P=0.092);年龄<60岁组的相对表达量为0.56±0.05,年龄≥60岁组的相对表达量为0.57±0.04,差异无统计学意义(t=-0.308,P=0.759);男性组的相对表达量为0.56±0.04,女性组的相对表达量为0.57±0.05,差异无统计学意义(t=-1.087,P =0.280,表2)。
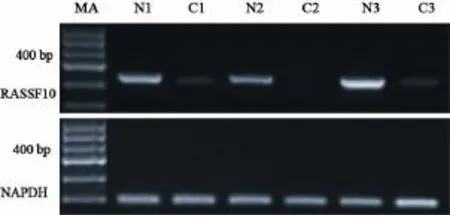
图3 GCA及癌旁正常组织中RASSF10基因的mRNA表达Fig. 3 mRNA expression of RASSF10 gene in GCA and corresponding normal tissues
2.3 RASSF10在GCA组织中的蛋白表达
81例GCA组织中有26例RASSF10蛋白表达呈阳性,其阳性率为32.1%;相应癌旁正常贲门组织中58例RASSF10蛋白表达呈阳性,阳性率为71.6%,GCA组织RASSF10蛋白阳性率显著低于癌旁正常组织(χ2=0.167,P=0.048,图4)。RASSF10蛋白在无淋巴结转移组的阳性率(44.2%,19/43)显著高于有淋巴结转移组的阳性率(18.4%,7/38,χ2=6.144,P=0.013);Ⅰ、Ⅱ期RASSF10蛋白阳性率为37.9%(25/66),显著高于Ⅲ、Ⅳ期的6.7%(1/15,χ2=5.463,P=0.019);高、中分化组RASSF10蛋白阳性率(71.4%,25/35)显著高于低分化组(2.2%,1/46,χ2=43.739,P=0.000);年龄<60岁组的RASSF10的蛋白阳性率为30.6%(15/49),≥60岁组的蛋白阳性率为34.4%(11/32),差异无统计学意义(χ2=0.126,P=0.723);男性组的RASSF10蛋白阳性率为28.0%(14/50),女性组蛋白阳性率为38.7%(12/31),差异无统计学意义(χ2=1.007,P=0.316,表2)。
2.4 RASSF10基因甲基化与表达之间的相关性
在RASSF10蛋白表达阳性的GCA组织中,其mRNA相对表达量为0.59±0.04,而在RASSF10蛋白表达阴性的GCA组织中,其mRNA相对表达量为0.55±0.04,差异有统计学意义(t=4.266,P=0.000)。在RASSF10基因启动子区甲基化阳性的GCA组织中,其mRNA相对表达量为0.56±0.04,甲基化阴性的GCA组织中mRNA相对表达量为0.58±0.05,差异有统计学意义(t=-2.507,P=0.014)。发生RASSF10基因启动子区高甲基化的GCA组织中RASSF10蛋白阳性表达率为9.6%(5/52),RASSF10基因启动子区甲基化阴性组的RASSF10蛋白表达阳性率为72.4%(21/29),差异有统计学意义(χ2=33.686,P=0.000,表3)。RASSF10基因启动子区甲基化与其蛋白表达之间呈负相关(P=0.000)。
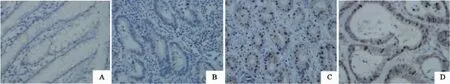
图4 贲门组织中RASSF10蛋白的表达Fig. 4 Protein expression of RASSF10 in gastric cardia tissue

表3 GCA组织中RASSF10基因甲基化与mRNA和蛋白表达之间的关系Tab. 3 The relationship between methylation status and mRNA, protein expression of RASSF10 in GCA tissues
3 讨 论
除多基因改变以外,表观遗传机制,尤其是DNA甲基化,与肿瘤的发生、发展密切相关,启动子区CpG岛的甲基化可改变癌症相关基因的表达水平,从而调节参与癌细胞增殖、凋亡和转移的信号通路[6]。近年来研究发现Ras蛋白可以通过与RASSF家族效应因子相互作用来调节多条信号通路影响细胞活动。据报道某些RASSFs成员(RASSF1A、RASSF2、RASSF4和RASSF5A)在多种类型的实体肿瘤中由于其启动子区CpG岛甲基化而发生表观遗传学失活[3,7]。
作为表观遗传学重要作用机制的DNA甲基化是恶性肿瘤发病的基本事件之一。肿瘤抑癌基因启动子区高甲基化引起的表达缺失,可导致其失去对肿瘤细胞生长的负性调控作用[8]。有研究报道RASSF10基因在白血病[9]、甲状腺癌[10]、胶质母细胞瘤[11]、皮肤黑色素瘤[12]、前列腺癌[13]、胃癌[14]和食管鳞癌[15]中发生高度甲基化。然而,RASSF10基因在GCA中的甲基化状态及表达尚未见报道。目前检测DNA甲基化常见的方法主要有酶切法、直接测序法、MSP等,MSP与其他方法相比避免了使用限制性内切酶,敏感性高,简便易行,适用于大样本检测,但存在一定假阳性结果,适当提高退火温度可降低假阳性率,从而提高其特异度,为检测DNA甲基化较为可信的方法。本研究通过MSP的方法发现RASSF10在贲门腺癌组织中的启动子区甲基化率显著高于癌旁正常组织,且淋巴结转移组高于无淋巴结转移组,这与文献报道的RASSF10基因甲基化程度与转移相关[10,12,15]这一结论相一致。本研究结果还显示低分化组RASSF10基因甲基化率高于高、中分化组,Ⅲ、Ⅳ期高于Ⅰ、Ⅱ期,这提示GCA的分化程度及分期可能同样与RASSF10基因的甲基化相关。研究随后分别应用RT-PCR及免疫组化的方法对RASSF10基因的mRNA及蛋白水平进行检测,结果显示GCA组织中该基因的转录及翻译水平均显著低于相应癌旁正常组织,这与Schagdarsurengin等[10]报道RASSF10基因在乳腺组织以外的几乎所有正常组织中高表达相一致。且经统计分析发现,RASSF10基因启动子区发生高甲基化的GCA组织其mRNA及蛋白表达水平显著低于未发生甲基化组,提示RASSF10基因启动子区的甲基化可能是导致该基因在GCA中失活的机制之一。此外Schagdarsurengin等[10]用去甲基化药物5-aza-dC处理RASSF10基因表达缺失或降低的甲状腺癌细胞系后,该基因的表达得以恢复或提高。Lu等[15]在多株食管癌细胞系中检测到RASSF10基因mRNA表达水平的缺失或降低,并伴随启动子甲基化的发生,用去甲基化药物5-aza-dC处理后,其表达得以恢复或提高。进一步证明了RASSF10基因CpG岛的甲基化可导致该基因在肿瘤中的沉默。Wei等[16]也通过去甲基化药物5-aza-dC处理RASSF10基因mRNA的表达缺失的胃癌细胞系使得该基因的表达得以恢复。同样提示启动子甲基化可能是导致RASSF10失活的主要机制。此外Wei等[16]还证明RASSF10过表达可显著抑制胃癌细胞的生长和集落形成,并在裸鼠体内抑制肿瘤的形成,siRNA介导的RASSF10缺失可显著促进正常胃上皮细胞的生长,表明RASSF10具有肿瘤抑制功能。Hill等[11]在细胞培养实验中发现过表达的RASSF10可导致神经胶质瘤细胞系克隆形成力下降,同样表明RASSF10具有肿瘤抑制功能。
Knudson的二次打击学说指出表观遗传沉默和杂合性缺失是导致RASSF10双等位基因失活的两个相关机制[17]。有研究报道,RASSF10过表达可降低β-连环蛋白的核积累,增加TCF/ LEF转录活性[16]。并通过检测β-连环蛋白下游基因(c-Myc、cyclinD1、cyclinE1)和过氧化物酶体增殖物激活受体(CF-1、TCF-4、CD44)的表达水平以探究RASSF10诱导生长抑制的分子机制,发现这些分子的蛋白水平均显著降低[18-21]。因此除DNA甲基化外,Wnt/β-连环蛋白信号传导途径的抑制可能也是RASSF10诱导细胞生长抑制、促进凋亡、降低细胞增殖的机制之一。
本研究证实GCA组织中RASSF10基因的甲基化率显著高于癌旁正常组织,并伴随转录及翻译水平的降低,且与肿瘤组织的分期、分化程度及淋巴结转移密切相关。因此RASSF10有可能作为检测GCA发生、发展及恶性程度的一个新的分子靶标,以期其在临床治疗过程中发挥一定指导作用,然而其具体分子生物学机制有待深入研究。
[1] 董稚明, 郭炜, 何明, 等. 贲门腺癌中RASSFIA基因的甲基化状态及表达[J].肿瘤防治研究, 2009, 36 (7): 566-570.
[2] HUANG Q, ZHANG L H. The histopathologic spectrum of carcinomas involving the gastroesophageal junction in the Chinese [J]. Int J Surg Pathol, 2007, 15(1): 38-52.
[3] VAN DER WEYDEN L, ADAMS D J. The Ras-association domain family (RASSF) members and their role in human tumourigenesis [J]. Biochem Biophys Acta, 2007, 1776(1): 58-85.
[4] SHERWOOD V, MANBODH R, SHEPPARD C, et al. RASSF7 is a member of a new family of RAS association domain-containing proteins and is required for completing mitosis [J]. Mol Biol Cell, 2008, 19(4): 1772-1782.
[5] YOKOYAMA Y, SAKAMOTO T, SATO S, et al. Evaluation of cytoreductive surgery with pelvic and paraaortic lymphadenectomy and intermittent cisplatin-based combination chemotherapy for improvement of long-term survival in ovarian cancer [J]. Eur J Gynaecol Oncol, 1999, 20(5-6): 361-366
[6] JONES P A, BAYLIN S B. The fundamental role of epigenetic events in cancer [J]. Nat Rev Genet, 2002, 3(6): 415-428.
[7] HESSON L B, COOPER W N, LATIF F. The role of RASSF1A methylation in cancer [J]. Dis Markers, 2007, 23(1-2): 73-87.
[8] 汪姗姗, 王宁, 于啸, 等. 宫颈癌细胞系RASSFIA基因启动子及第1外显子区甲基化状态的研究 [J]. 中国癌症杂志, 2013, 23 (10): 777-783.
[9] HESSON L B, DUNWELL T L, COOPER W N, et al. The novel RASSF6 and RASSF10 candidate tumour suppressor genes are frequently epigenetically inactivated in childhood leukaemias [J]. Mol Cancer, 2009, 8: 42. doi: 10.1186/1476-4598-8-42.
[10] SCHAGDARSURENGIN U, RICHTER A M, WOHLER C, et al. Frequent epigenetic inactivation of RASSF10 in thyroid cancer [J]. Epigenetics, 2009, 4(8): 571-576.
[11] HILL V K, UNDERHILL-DAY N, KREX D, et al. Epigenetic inactivation of the RASSF10 candidate tumor suppressor gene is a frequent and an early event in gliomagenesis [J]. Oncogene, 2011, 30(8): 978-989.
[12] HELMBOLD P, RICHTER A M, WALESCH S, et al. RASSF10 promoter hypermethylation is frequent in malignant melanoma of the skin but uncommon in nevus cell nevi [J]. J Invest Dermatol, 2012, 132(3 Pt 1): 687-694.
[13] D A N S R A N J A V I N T, W A G E N L E H N E R F, GATTENLOEHNER S, et al. Epigenetic down regulation of RASSF10 and its possible clinical implication in prostate carcinoma [J]. Prostate, 2012, 72(14): 1550-1558.
[14] LI Z, CHANG X, DAI D, et al. RASSF10 is an epigenetically silenced tumor suppressor in gastric cancer [J]. Oncol Rep, 2014, 31(4): 1661-1668.
[15] LU D, MA J, ZHAN Q, et al. Epigenetic silencing of RASSF10 promotes tumor growth in esophageal squamous cell carcinoma[J]. Discov Med, 2014, 17(94): 169-178.
[16] WEI Z, CHEN X, CHEN J, et al. RASSF10 is epigenetically silenced and functions as a tumor suppressor in gastric cancer[J]. Biochem Biophys Res Commun, 2013, 432(4): 632-637.
[17] JONES P A, LAIRD P W. Cancer epigenetics comes of age[J]. Nat Genet, 1999, 21(2): 163-167.
[18] SANSOM O J, MENIEL V S, MUNCAN V, et al. Myc deletion rescues Apc deficiency in the small intestine [J]. Nature, 2007, 446(7136): 676-679.
[19] HE T C, CHAN T A, VOGELSTEIN B, et al. PPARdelta is an APC-regulated target of nonsteroidal anti-inflammatory drugs[J]. Cell, 1999, 99(3): 335-345.
[20] KANWAR S S, YU Y, NAUTIYAL J, et al. The Wnt/ beta-catenin pathway regulates growth and maintenance of colonospheres [J]. Mol Cancer, 2010, 9: 212. doi: 10.1186/1476-4598-9-212.
[21] HE T C, SPARKS A B, RAGO C, et al. Identification of c-MYC as a target of the APC pathway [J]. Science, 1998, 281(5382): 1509-1512.
Methylation status and expression of RASSF10 gene in gastric cardia adenocarcinoma
CUI Jianli, GUO Wei, GUO Yan-li, SHEN Su-peng, DONG Zhi-ming
(Cancer Institute, Fourth Hospital of Hebei Medical University, Shijiazhuang Hebei 050011, China)
DONG Zhi-ming E-mail: dongzhiming2000@aliyun.com
Background and purpose: RASSF10 acts as a kind of tumor suppressor in various tumor tissues, but researches in cardiac adenocarcinoma has not been reported. This study aimed to detect the methylation status and expression of Ras-association domain family 10 (RASSF10) in gastric cardia adenocarcinoma (GCA), and explore its role in occurrence and development of GCA. Methods: Methylation speci fic polymerase chain reaction (MSP), reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry method were respectively used to detect methylation status, mRNA expression and protein expression of RASSF10 in 81 GCA tissues and corresponding normal tissues.Results: The promoter methylation frequency of RASSF10 in GCA tissues (64.20%, 52/81) was signi ficantly higher than that in corresponding normal tissues (20.99%, 17/81, P<0.05), and was closely correlated with TNM stages, differential degree and lymph node metastasis (P<0.05). RASSF10 mRNA expression in GCA tissues (0.57±0.05) was significantly lower than that in corresponding normal tissues (0.78±0.02, P<0.05), and was closely correlated with TNM stages and lymph node metastasis (P<0.05). Protein expression of RASSF10 in GCA tissues (31.10%, 26/81) was signi ficantly lower than that in corresponding normal tissues (71.60%, 58/81, P<0.05), and was closely correlated with TNM stages, differential degree and lymph node metastasis (P<0.05). The promoter methylation frequency of RASSF10 in GCA tissues was inversely related to its protein expression.Conclusion: Inactivation of RASSF10 caused by aberrantmethylation in the promoter region may be closely correlated with the GCA tumorgenesis.
Gastric cardia adenocarcinoma; Methylation; RASSF10 gene
10.3969/j.issn.1007-3969.2014.08.002
R734.2
A
1007-3639(2014)08-0568-07
2014-05-27
2014-07-11)
国家自然科学基金(No:81101854);河北省医学研究重大专项基金(No:冀财预复[2012]2056号)。
董稚明 E-mail:dongzhiming2000@aliyun.com

