共刺激分子B7-H3对食管癌细胞Eca-109生物学特性的影响
河北医科大学第四医院科研中心,河北 石家庄 050011
共刺激分子B7-H3对食管癌细胞Eca-109生物学特性的影响
曹娜娜 王玲 单保恩
河北医科大学第四医院科研中心,河北 石家庄 050011
背景与目的:食管肿瘤严重威胁着人类健康,认识食管癌的发生、发展机制和寻找治疗方法已经成为遏制肿瘤的研究热点。近年来,作为B7免疫球蛋白超家族的新成员,共刺激分子B7-H3在多种肿瘤中异常高表达,被认为可能是一种新的肿瘤标志物和潜在的治疗靶点。本研究旨在检测食管癌细胞株TE-1、TE-13、Eca-109细胞中B7-H3的表达,并通过靶向干扰B7-H3基因表达来研究B7-H3对食管癌细胞增殖、侵袭等生物学行为的影响。方法:运用逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)方法检测B7-H3分子在食管癌细胞TE-1、TE-13、Eca-109中的表达。通过LipofectamineTM2000体外转染B7-H3 siRNA、control siRNA至食管癌Eca-109细胞,采用RT-PCR和蛋白质印迹法(Western blot)检测Eca-109细胞中B7-H3 mRNA和蛋白的表达。采用MTT实验、细胞划痕实验、Transwell侵袭小室实验检测B7-H3 siRNA对Eca-109细胞增殖能力、平面迁移能力及体外侵袭能力的影响。结果:共刺激分子B7-H3在食管癌细胞TE-1(0.382±0.008)、TE-13(0.399±0.008)、Eca-109(0.428±0.012)中的表达差异无统计学意义(P>0.05)。转染B7-H3 siRNA后Eca-109细胞B7-H3 mRNA和蛋白表达水平显著低于未转染组(0.128 5±0.000 2 vs 0.540 3±0.001 3,0.421 4±0.004 8 vs 0.492 1±0.014 8,P均<0.05)以及空载体转染组(0. 128 5±0.000 2 vs 0.532 4±0.000 7,0.421 4±0.004 8 vs 0.500 6±0.012 9,P均<0.05)。与对照组细胞相比,转染B7-H3 siRNA后Eca-109细胞的平面迁移能力和侵袭力明显下降(P<0.05),然而其增殖能力差异无统计学意义(P>0.05)。结论:食管癌细胞TE-1、TE-13、Eca-109均组成性表达B7-H3分子。沉默B7-H3基因表达能明显抑制Eca-109细胞的体外迁移、侵袭能力,提示B7-H3基因可能参与调节食管癌的侵袭转移能力,为免疫治疗提供潜在的治疗靶点。
共刺激分子;B7-H3;食管癌;Eca-109
食管癌是我国最为高发的恶性肿瘤之一,每年平均约有20万人死于食管癌[1]。尽管近年来食管癌在诊断、治疗等方面取得了巨大成就,但食管癌的预后仍然难尽人意。因此,了解食管癌发生、发展的分子机制对疾病的治疗非常重要。
协同刺激分子B7-H3是新近发现的B7家族重要成员[2],其在树突状细胞以及肝、肺、前列腺和相似肿瘤细胞系中均有表达[3-6]。然而,B7-H3的病理生理学作用机制尚未明确。有研究证明,B7-H3在大多情况下发挥抑制T细胞活性作用[7]。Chen等[8]发现B7-H3可能是一种肿瘤相关抗原,不仅可以调节重要细胞免疫应答,还可以参与调节细胞生长、凋亡、黏附及转移等生物学特性[9-10],提示其在肿瘤进展中发挥重要作用[11]。本研究旨在检测协同刺激分子B7-H3在食管癌细胞中的表达并探讨其对食管癌细胞生物学特性的影响。
1 材料和方法
1.1 主要试剂
TRIzol、B7-H3引物、GAPDH引物、LipofectamineTM2000购自美国Invitrogen公司,逆转录试剂盒Go Taq®GreenMaster Mix购自Thermo公司,兔抗人B7-H3单克隆抗体和兔抗人GAPDH单克隆抗体购自Epitomics公司,荧光标记的羊抗兔的二抗购自Rockland公司,MTT购自北京索莱宝科技有限公司,B7-H3 shRNA、control shRNA购自德国QIAGENE公司。Matrigel胶购自美国BD Bioscience公司。Transwell侵袭小室购自美国Costar公司。
1.2 细胞培养与基因转染
TE-1、TE-13细胞由河北医科大学第四医院科研中心提供,Eca-109细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。在含10%胎牛血清、青霉素(100 U/mL)、链霉素(100 μg/mL)的RPMI-1640培养基中,于37 ℃、CO2体积分数为5%的饱和湿度条件下培养,细胞生长呈70%~80%融合状态时,以0.25%胰蛋白酶消化传代,隔日换液,每3~4 d传代1次,收集对数生长期细胞进行实验。利用LipofectamineTM2000转染试剂,按照试剂盒所提供的说明将B7-H3 siRNA、control siRNA基因转染Eca-109细胞,实验设未转染组、空载体转染组(2.5 μg)、单独转染B7-H3 siRNA组(2.5 μg)。
1.3 逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)检测食管癌细胞中B7-H3 mRNA的表达
收集TE-1、TE-13、Eca-109细胞以及转染48 h后的Eca-109细胞。按照TRIzol试剂说明书逐步加入氯仿、异丙醇、乙醇等提取总RNA,并测定RNA浓度、纯度和完整性。取5 g总RNA按Revert Aid First Strand cDNA Synthesis Kit逆转录试剂盒(Fermantas公司)说明书合成cDNA,用Go Taq® Green Master Mix进行PCR扩增。引物及反应条件见表1。PCR产物经1.5%琼脂糖凝胶电泳分离后,紫外透射反射仪下观察结果,并在凝胶成像仪上照相,扫描所得灰度值进行统计学分析。
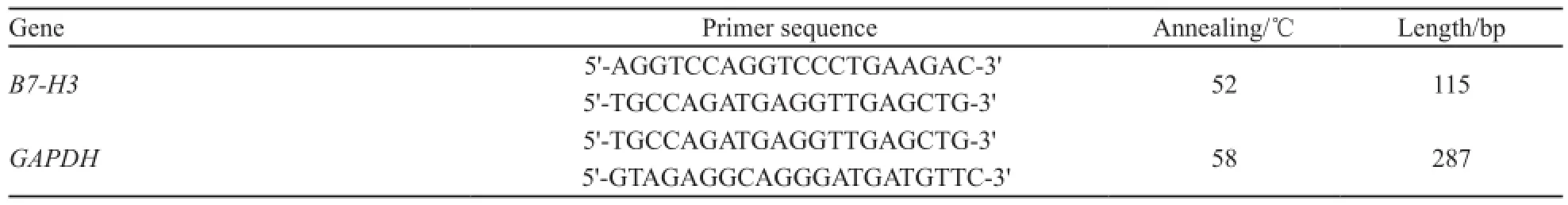
表1 RT-PCR的引物序列Tab. 1 Primer sequences for RT-PCR
1.4 蛋白质印迹法(Western blot)检测Eca-109细胞中B7-H3蛋白的表达
转染48 h后,收集细胞,按RAPI∶PMSF=100∶1加入裂解混合液,冰上静置20 min,在10 000×g条件下离心10 min,收集上清液并通过10%和15% SDS-PAGE定量蛋白,分离、转膜、室温封闭,兔抗人GAPDH单抗(1∶1 000)和兔抗人B7-H3单抗(1∶1 000) 4 ℃温育过夜,TBST液洗膜3次,加入1∶10 000 TBST液稀释的荧光素标记抗兔二抗,37 ℃温育1 h,TBST液洗膜3次,用双色红外荧光扫描系统成像并分析。
1.5 MTT检测
Eca-109细胞转染24 h后,将细胞以1.0×104个/孔接种在96孔板中,每组6个复孔培养过夜,细胞贴壁后0、24、48及72 h,每孔加入MTT溶液(5 mg/mL)20 μL继续培养4 h,终止培养,小心吸弃孔内培养上清液,每空加入150 μL二甲基亚砜(DMSO),振荡15 min,使结晶充分溶解,在酶联免疫检测仪上(490 nm)测定各孔光密度(A值)。取相同生长天数及转染相同质粒A值的均值作为该组细胞某天的A值。
1.6 细胞划痕实验
收集对数生长期的Eca-109细胞,以2×105个/mL接种于24孔培养板中。待细胞长至80%融合时,更换无血清的RPMI-1640,培养细胞24 h,用来饥饿细胞。待细胞长到完全融合时,用10 μL加样枪头在每孔单层细胞上划痕,造成培养细胞划痕模型。划痕后用PBS冲洗2次。沿划痕边缘等距离间隔做上标记,以便检测。实验分组同前,继续培养24 h,定时用倒置显微镜观察划痕愈合程度并拍照。计算划痕中间的距离,并与0 h的划痕距离相比计算划痕间距缩小的百分率,以此反映细胞的平面迁移能力。以上实验至少重复3次。
1.7 Transwell侵袭小室实验
实验采用带有8 μm微孔聚碳酸酯膜的Transwell小室,将Matrigel (50 mg/L)胶和无血清RPMI-1640培养基以1∶3比例进行稀释。在小室上室铺25 μL稀释好的Matrigel胶,37 ℃无菌保持过夜,确保Matrigel胶充分聚合。收集对数生长期的Eca-109细胞,用RPMI-1640培养基调整细胞浓度为2×105个/mL,每孔加入200 μL细胞悬液于上室,用RPMI-1640培养基补充至1 mL。下室加入预先培养Eca-109细胞24 h后的上清液,每孔加600 μL。实验分组同前。温育约24 h后,取出上室。用棉签头擦掉Matrige胶及胶上细胞,PBS液洗3次。将小室置于4%多聚甲醛中固定15 min,风干,然后用Gimesa染液染15~20 min,风干。将聚碳酸酯膜用小剪刀剪下,放在载玻片上用树胶封片,在显微镜下观察结果,计数高倍镜下至少5个视野内的细胞数,取其平均值作为该组穿过Matrigel基质的细胞数。
1.8 统计学处理
用SPSS 13.0统计学软件对所有数据进行统计学处理,实验结果用表示,多组间均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 TE-1、TE-13和Eca-109细胞中B7-H3 mRNA的表达情况
RT-PCR检测结果显示,食管癌细胞TE-1(0.382±0.008)、TE-13(0.399±0.008)、Eca-109(0.428±0.012)均组成性表达B7-H3 mRNA (图1)。B7-H3 mRNA在食管癌细胞Eca-109中的表达水平略高于其在TE-1、TE-13细胞中的表达,但差异无统计学意义(P>0.05)。
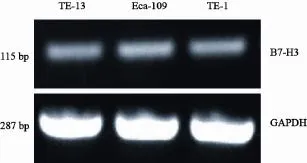
图1 TE-13、TE-1和Eca-109细胞中B7-H3的表达Fig. 1 B7-H3 expression in TE-13, TE-1 and Eca-109 cell lines
2.2 B7-H3 siRNA转染Eca-109细胞后B7-H3 mRNA的表达情况
RT-PCR检测结果显示,B7-H3 mRNA在B7-H3 siRNA转染组、空转染组和未转染组中的阳性表达灰度值分别为0.128 5±0.000 2、 0.532 4±0.000 7和0.540 3±0.001 3。
统计分析结果发现,转染B7-H3 siRNA后,B7-H3 mRNA表达水平明显低于空转染及未转染组(P<0.01),说明在转录水平上,B7-H3 siRNA转染能下调B7-H3的转录活性(图2、表2)。
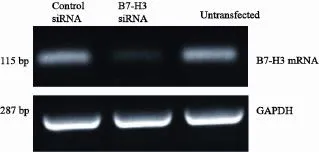
图2 B7-H3 siRNA转染Eca-109细胞后B7-H3 mRNA的表达情况Fig. 2 B7-H3 mRNA expression in Eca-109 cells after B7-H3 siRNA transfection
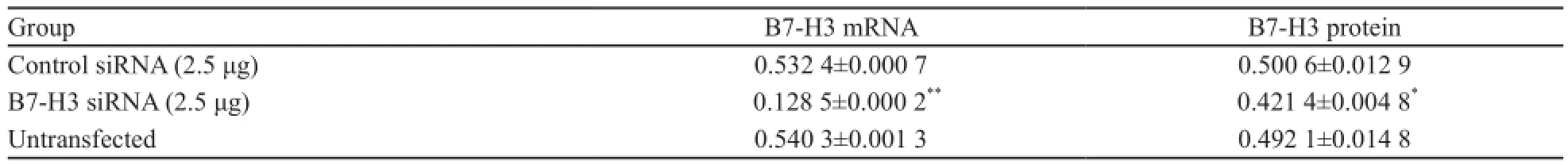
表2 Eca-109细胞转染后B7-H3 mRNA和蛋白表达水平Tab. 2 Expressions of B7-H3 mRNA and protein in Eca-109 cells with different transfection plasmids
2.3 B7-H3 siRNA转染Eca-109细胞后B7-H3蛋白的表达情况
Western blot检测结果显示,B7-H3 siRNA转染Eca-109细胞后,B7-H3蛋白的表达水平明显低于空转染组(0.421 4±0.004 8 vs 0.500 6± 0.012 9,P<0.05)及未转染组(0.421 4±0.004 8 vs 0.492 1±0.014 8,P<0.05),说明在蛋白表达水平上,B7-H3 siRNA转染下调了B7-H3的转录活性(图3,表2)。
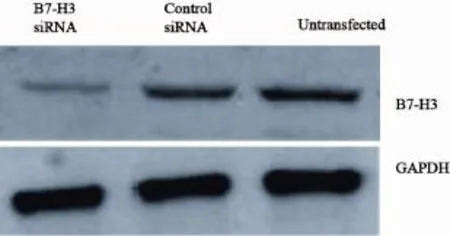
图3 B7-H3 siRNA转染Eca-109细胞后B7-H3蛋白的表达情况Fig. 3 B7-H3 protein expression in Eca-109 cells after B7-H3 siRNA transfection
2.4 B7-H3 siRNA转染对Eca-109细胞增殖的影响
MTT分析结果显示,转染B7-H3 siRNA组、空载体组及未转染细胞接种于96孔板24、48和72 h后,转染B7-H3 siRNA的Eca-109细胞与空转染及未转染细胞相比,增殖率差异无统计学意义(P>0.05),说明B7-H3 siRNA转染不能抑制Eca-109细胞增殖(图4)。
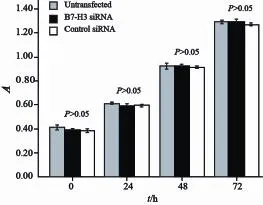
图4 B7-H3 siRNA转染对Eca-109细胞增殖的影响Fig. 4 The effect of B7-H3 siRNA interference on Eca-109 cell proliferation
2.5 B7-H3 siRNA转染对Eca-109细胞迁移能力的影响
划痕实验结果显示,未转染组及空转染组Eca-109细胞24 h后向划痕边缘爬行的速度快,划痕的宽度明显变窄,而转染B7-H3 siRNA后Eca-109细胞向划痕边缘爬行的速度明显减慢,划痕缺损处修复缓慢,划痕间距明显缩短,差异有统计学意义(P<0.05,图5)。提示转染B7-H3 siRNA后,Eca-109细胞的平面运动能力明显下降。
2.6 B7-H3 siRNA转染对Eca-109细胞侵袭能力的影响
Transwell侵袭小室实验结果显示,转染B7-H3 siRNA后,通过人工基底膜的Eca-109细胞数明显降低。与未转染及空转染组相比,差异有统计学意义(P<0.05,图6)。可见转染B7-H3 siRNA后,Eca-109细胞的体外侵袭能力明显减弱。
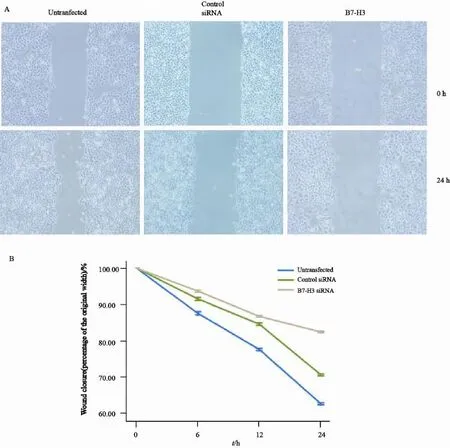
图5 B7-H3 siRNA转染对Eca-109细胞迁移能力的影响Fig. 5 The effect of B7-H3 siRNA interference on Eca-109 cell migration detected by wound scrape assay
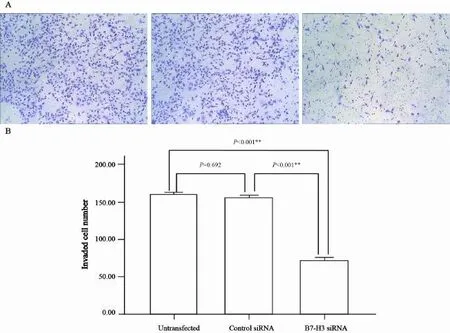
图6 B7-H3 siRNA转染对Eca-109细胞体外侵袭能力的影响Fig. 6 The effect of B7-H3 siRNA interference on Eca-109 cell invasion ability detected by transwell invasion assay.
3 讨 论
有研究证明B7-H3在肿瘤进展和转移中发挥重要作用。Wu等[12]在胃癌研究中证实,B7-H3表达与肿瘤浸润深度及生存时间相关。Sun等[13]发现,B7-H3在小细胞肺癌中高表达与淋巴结转移风险的增加明显相关。据报道,B7-H3过表达与肿瘤侵袭性和临床预后有关,提示B7-H3在肿瘤进展中发挥重要作用。
肿瘤发生是一个多步骤的过程,在这个过程中癌细胞增殖失控,从一个局限的初级的肿瘤团块扩散侵袭附属器官,再到远处器官转移。肿瘤的侵袭和转移主要包括细胞与基底膜的黏附、细胞外基质的降解和细胞的迁移[14-15]。细胞无限制的生长是癌细胞表型的一项重要改变[16]。本实验中,我们发现食管癌细胞TE-1、TE-13及Eca-109均组成性表达B7-H3蛋白。因此,我们通过干扰B7-H3基因的表达来研究其对食管癌细胞生长特性的影响。转染B7-H3 siRNA后Eca-109细胞的增殖能力与空转染、未转染细胞相比,有所下降,但差异无统计学意义(P>0.05)。说明B7-H3对食管癌细胞的增殖能力并无明显影响。因此,我们用细胞的迁移、侵袭实验来验证基因敲除B7-H3是否够能够影响肿瘤细胞的散播转移能力。
肿瘤细胞与原发部位分离,侵袭附属器官及周边组织时,需要一定的运动能力。细胞划痕实验结果显示,转染B7-H3 siRNA后,Eca-109细胞的平面爬行能力减弱,划痕愈合变慢,提示转染B7-H3 siRNA对细胞迁移能力有明显抑制作用(P<0.05)。肿瘤细胞受趋化因素趋化并穿过基底膜的能力是侵袭和转移的关键因素之一。本研究采用正常培养食管癌细胞24 h的培养上清液作为趋化因素、Matrigel作为人工基底膜,通过Transwell侵袭小室观察肿瘤细胞侵袭人工基底膜情况。结果表明,与空转染、未转染组相比,转染B7-H3 siRNA组穿过基底膜的细胞数值显著减少,提示B7-H3 siRNA转染抑制B7-H3基因表达后,Eca-109细胞分解Matrigel胶的能力减弱,细胞穿过Transwell小室下表面的数目减少,Eca-109细胞的体外侵袭能力显著降低。Tekle等[17]和Zhao等[18]也曾报道,干扰B7-H3基因能降低黑色素瘤、肾透明细胞癌等多种肿瘤细胞的迁移和侵袭能力。在Tekle等[17]的小鼠黑色素瘤模型中,沉默MDAMB-435细胞中B7-H3基因的表达能降低肿瘤转移能力,显著延长小鼠的中位生存期。此外,在B7-H3基因沉默的小鼠体内,基质金属蛋白酶2(matrix metalloproteinase,MMP-2)及IL-8的水平是降低的,而金属蛋白酶抑制剂1(tissue inhibitor of metalloproteinase,TIMP-1)和2的水平是增加的。MMP-2与肿瘤的浸润及转移密切相关,B7-H3可能通过抑制TIMP-1和TIMP-2的产生上调MMP-2的水平,促进肿瘤侵袭与转移的发生,提示B7-H3在调节肿瘤转移过程中发挥重要作用,可能是抗转移治疗的潜在治疗靶点。
综上所述,靶向干扰B7-H3基因的表达能明显抑制Eca-109细胞的迁移、侵袭能力,这提示B7-H3在肿瘤转移中有重要作用,预示着高度侵袭能力和临床不良预后。然而,B7-H3在体内外发挥作用的分子机制仍需要进一步研究。
[1] 赫捷, 邵康. 中国食管癌流行病学现状、诊疗现状及未来对策[J]. 中国癌症杂志, 2011, 7: 501-504.
[2] CHAPOVAL A I, NI J, LAU J S, et al. B7-H3: a costimulatory molecule for T cell activation and IFN-gamma production[J]. Nat Immunol, 2001, 2(3): 269-274.
[3] SUH W K, WANG S X, JHEON A H, et al. The immune regulatory protein B7-H3 promotes osteoblast differentiation and bone mineralization[J]. Proc Natl Acad Sci U S A, 2004, 101(35): 12969-12973.
[4] STEINBERGER P, MAJDIC O, DERDAK S V, et al. Molecular characterization of human 4Ig-B7-H3, a member of the B7 family with four Ig-like domains[J]. J Immunol, 2004, 172(4): 2352-2359.
[5] ZHANG G B, ZHOU H, CHEN Y J, et al. Characterization and application of two novel monoclonal antibodies against 2IgB7-H3: expression analysis of 2IgB7-H3 on dendritic cells and tumor cells [J]. Tissue Antigens, 2005, 66(2): 83-92.
[6] YAMATO I, SHO M, NOMI T, et al. Clinical importance of B7-H3 expression in human pancreatic cancer[J]. Br J Cancer, 2009, 101(10): 1709-1716.
[7] CASTRICONI R, DONDERO A, AUGUGLIARO R, et al. Identification of 4Ig-B7-H3 as a neuroblastoma-associated molecule that exerts a protective role from an NK cellmediated lysis [J]. Proc Natl Acad Sci U S A, 2004, 101(34): 12640-12645.
[8] CHEN Y W, TEKLE C, FODSTAD O. The immunoregulatory protein human B7-H3 is a tumor-associated antigen that regulates tumor cell migration and invasion [J]. Curr Cancer Drug Targets, 2008, 8(5): 404-413.
[9] STREIT M, DETMAR M. Angiogenesis, lymph angiogenesis, and melanoma metastasis[J]. Oncogene, 2003, 22(20): 3172-3179.
[10] MILLER A J, MIHM MC J R. Melanoma[J]. N Engl J Med, 2006, 355(1): 51-65.
[11] ZHANG G, HOU J, SHI J, et al. Soluble CD276 (B7-H3) is released from monocytes, dendritic cells and activated T cells and is detectable in normal human serum [J]. Immunology, 2008, 123(4): 538-546.
[12] WU C P, JIANG J T, TAN M, et al. Relationship between costimulatory molecule B7-H3 expression and gastric carcinoma histology and prognosis[J]. World J Gastroenterol, 2006, 12(3): 457-459.
[13] SUN Y, WANG Y, ZHAO J, et al. B7-H3 and B7-H4 expression in non-small-cell lung cancer[J]. Lung Cancer, 2006, 53(2): 143-151.
[14] MAKRILIA N, KOLLIAS A, MANOLOPOULOS L, et al. Cell adhesion molecules: role and clinical significance in cancer[J]. Cancer Invest, 2009, 27(10): 1023-1037.
[15] CONDEELIS J, POLLARD J W. Macrophages: obligate partners for tumor cell migration, invasion, and metastasis[J]. Cell, 2006, 124(2): 263-266.
[16] YANG Q S, GU J L, DU L Q, et al. ShRNA-mediated Ku80 gene silencing inhibits cell proliferation and sensitizes to gamma-radiation and mitomycin C induced apoptosis in esophageal squamous cell carcinoma lines[J]. J Radiat Res, 2008, 49(4): 399-407.
[17] TEKLE C, NYGREN M K, CHEN Y W, et al. B7-H3 contributes to the metastatic capacity of melanoma cells by modulation of known metastasis-associated genes[J]. Int J Cancer, 2012, 130(10): 2282-2290.
[18] ZHAO J, LEI T, XU C, et al. MicroRNA-187, down-regulated in clear cell renal cell carcinoma and associated with lower survival, inhibits cell growth and migration though targeting B7-H3[J]. Biochem Biophys Res Commun, 2013, 438(2): 439-444.
Effect of costimulatory molecule B7-H3 on the biological characteristics of esophageal cancer Eca-109 cell line
CAO Na-na, WANG Ling, SHAN Bao-en (Research Center, Fourth Hospital of Hebei Medical
University, Shijiazhuang Hebei 050011, China)
SHAN Bao-en E-mail: shanbaoen_1962@163.com
Background and purpose: Esophageal cancer is a serious disease threatening human health, and it is very difficult to understand the development mechanism and find the therapeutic methods for esophageal cancer. In recent years, B7-H3, as a new member of B7 immunoregulatory superfamily, overexpressed in multiple tumor types, is considered to be a new tumor marker and potential therapeutic target. This study aimed to detect the expression of B7-H3 in esophageal cancer cell lines TE-1, TE-13, Eca-109 and exploring the effect of B7-H3 siRNA on cell proliferation, migration and invasion in vitro in human esophageal cancer Eca-109 cell line. Methods: The expression of B7-H3 in esophageal cancer cell lines TE-1, TE-13 and Eca-109 were detected by reverse transcription polymerase chain reaction (RT-PCR). B7-H3 siRNA and control siRNA were transfected in vitro into human esophageal cancer Eca-109 cells using LipofectamineTM2000. The expressions of B7-H3 mRNA and protein in Eca-109 cells were analyzed by RT-PCR and Western blot. The proliferation, migration and invasion abilities of Eca-109 cells were measured by MTT assay, wound scrape assay and transwell invasion assay in vitro,respectively. Results: All tested cultured esophageal cancer cell lines constitutively expressed B7-H3 mRNA under normal conditions (TE-1 0.382±0.008, TE-13 0.399±0.008, Eca-109 0.428±0.012). After transfection, the expression of B7-H3 mRNA levels decreased in B7-H3 siRNA transfected group, compared with control siRNA transfected group (0.128 5±0.000 2 vs 0.532 4±0.000 7, P<0.01) and untransfected group (0.128 5±0.000 2 vs 0.540 3±0.001 3, P<0.01), while its protein expression levels were also signi ficantly lower than the control transfection group (0.421 4±0.004 8 vs 0.500 6±0.012 9, P<0.05) and untransfected group (0.421 4±0.004 8 vs 0.492 1±0.014 8, P<0.05). Compared with control transfected and untransfected cells, Eca-109 cell migration and invasion abilities decreased significantly (P<0.05) by siRNA interference, but no significant difference was observed between their proliferative capacity (P>0.05). Conclusion: All tested esophageal cancer cell lines constitutively express B7-H3 mRNA. B7-H3 siRNA interference inhibits Eca-109 cell migration and invasion abilities. B7-H3 may have a critical role in regulating Eca-109 cell progression.
Costimulatory molecule; B7-H3; Esophageal cancer; Eca-109
10.3969/j.issn.1007-3969.2014.08.001
R735.1
A
1007-3639(2014)08-0561-07
2014-04-24
2014-07-15)
国家自然资金面上项目(No:81173611);河北省重大医学科研课题(No:zd2013045)。
单保恩 E-mail:shanbaoen_1962@163.com

