枸杞多糖通过抑制H2O2诱导的INS-1细胞凋亡促进胰岛素分泌❋
张学军,尹长江△,杨坤宝, 张海峰,史华宁
(1.承德医学院,河北 承德 067000;2.承德医学院附属医院,河北 承德 067000)
本研究拟从体外建立糖尿病细胞模型,研究枸杞多糖对H2O2诱导的β细胞凋亡的影响,旨在为枸杞多糖应用于糖尿病的防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 枸杞多糖 由本实验室从枸杞子中提取、分离、纯化而得。枸杞子由宁夏鑫颢博达科技发展有限公司提供。提取纯化流程为枸杞子粉碎→石油醚丙酮回流脱脂→水提多糖→乙醇沉淀→真空干燥→粗多糖→Sevag法脱蛋白→乙醇沉淀→真空干燥→总多糖。总多糖经纤维素DEAE-52和葡聚糖Sephadex G100柱洗脱后冷冻真空干燥后即得纯品。经苯酚-硫酸法检测,其多糖纯度>90。
1.1.2 细胞株及培养 INS-1细胞购自中国协和医科大学细胞中心。培养基为含10%胎牛血清及青霉素(100 U/L)、链霉素 (100 mg/L) 的5.5 mmol/L葡萄糖DMEM培养基,于37℃、5% CO2培养箱培养。
1.1.3 试剂与仪器 NAC(SIGAMA, USA),DMEM高糖培养基(GIBCO, USA),MTT检测试剂盒(南京建成科技有限公司),Annexin V-PI凋亡双染试剂盒(碧云天生物技术公司),RNA提取试剂盒、逆转录试剂盒、荧光定量PCR试剂盒(北京全式金生物科技有限公司),胰岛素放射免疫分析试剂盒(中国原子能科学研究院),二氧化碳培养箱(FORMA,USA),5084R型高速冷冻离心机(EPPENDORF, Germany), 放射免疫计数仪(中佳合肥科技有限公司),FACS Aria流式细胞仪(BD, USA),Mx3000P荧光定量PCR仪(AGILENT, USA),MK3酶标仪(THERMO LABSYSTEMS, USA)。
1.2 方法
1.2.1 分组与加药处理 INS-1 细胞分为正常对照组、H2O2对照组、阳性药物对照组(N-乙酰半胱氨酸,NAC)、枸杞多糖治疗组(LBP)4组,每组6 孔。细胞处于对数生长期时,除正常对照组外,均给予终浓度为 100 μmol/l H2O2,阳性对照组同时给予NAC,终浓度为10 nmol/l,受试药组同时给予枸杞多糖,终浓度为100 mg/l。
1.2.2 MTT法检测细胞活力 INS-1 细胞以每孔106个/ml的密度接种于96孔板中,24 h后加药处理,继续培养 24 h,然后加入5 g/L 的 MTT 10 μL,孵育4 h 后加入DMSO 150 μL,使沉淀溶解,用酶联免疫检测仪于 570 nm 波长处测定其吸光度。
1.2.3 葡萄糖刺激胰岛素分泌试验(GSIS) INS-1细胞以每孔5×105个/ml的密度接种于6孔板中,培养24 h细胞贴壁后换液并加入各组所需药物。培养24 h后PBS冲洗细胞,加入无糖KRBB缓冲液孵育30 min。然后再用含葡萄糖3和 30 mmol/l的 KRBB 缓冲液各孵育细胞1 h,分别收集上清液。采用放射免疫法检测每组上清中胰岛素含量。首先在100 μL待测样品中加入100 μL抗血清(二抗)和100 μL分析试剂,混匀37℃孵育2 h后,加入100 μL125I-胰岛素 37℃孵育1 h。然后加入第二抗体100 μL 37℃孵育30 min。反应完毕后,室温 3000 r/min离心30 min,用γ计数仪测定沉淀物放射性强度,根据标准曲线计算样品胰岛素含量,同时采用BCA法测定每组蛋白总量。取不同浓度蛋白标准品绘制蛋白含量标准曲线,然后测量各待测样品吸光度,计算蛋白含量。单位质量胰岛素浓度=每孔胰岛素含量/相应的细胞蛋白含量。
1.2.4 细胞凋亡检测 INS-1细胞以每瓶105个/ml密度接种于25 cm2细胞瓶中,培养24 h细胞贴壁后换液并加入各组所需药物。培养24 h后,胰酶消化制备单细胞悬液,调整密度为5×105~1×106个/ml。取1ml细胞用预冷的PBS离心清洗后,重悬于200 μL Binding Buffer。然后加入 10 μL Annexin V-FITC 和 10 μL PI轻轻混匀,避光室温反应 15 min 后加入 300 μL Binding Buffer上机检测。
1.2.5 细胞凋亡相关基因表达变化检测 INS-1细胞按照1.2.3 所述接种加药。培养24 h后提取细胞总mRNA,逆转录后 采用荧光定量试剂盒结合荧光定量PCR仪,以β-actin为比较检测mRNA 表达变化。所需引物由上海生工生物工程有限公司设计合成。引物序列为:Bcl-2: 5’-TGCACCTGACGCCCTTCAC, 3’-ACAGCCAGGAGAAATCAAA, 292bp;Bax: 5’- CCAAGAAGCTGAGCGAGTGT, 3’-CAAAGATGGTCACGGTCTGC, 370bp;Caspase-3: 5’- TTTTTCAGAGGGGATCGTTG, 3’- AATTCTGTTGCCACCTTTCG, 315bp。Real-time RT-PCR扩增体系 (50 μl):SYBRGreen Mix 31.5 μl,上游引物 1 μl,下游引物1 μl,cDNA模板2 μL,ddH2O 14.5 μl。Real-time RT-PCR反应条件:95℃预变性10 min;95℃变性15 s,55±5℃ (Bcl-2: 54℃;Bax: 55℃;Caspase-3: 54℃) 退火30 s,72℃延伸30 s,扩增40个循环,每个循环后自动读取荧光信号;温度从65℃~95℃,每升高0.5℃读取1次数据并做溶解曲线。各样本设2个复管,实验重复3次。按照2-ΔΔCt方法计算各组相对表达量,其中ΔCT=CT(目的基因)-CT(内参基因)(β-actin),ΔΔCT=ΔCT(处理)-ΔCT(对照)。
1.3 统计学方法
采用SPASS 13.0统计软件进行统计分析,计量数据以均数±标准差(±s)表示,多组间比较采用方差分析,各组与对照组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 枸杞多糖对H2O2处理INS-1细胞活力和GSIS的影响
表1 枸杞多糖对INS-1细胞活力和GSIS的影响(±s)
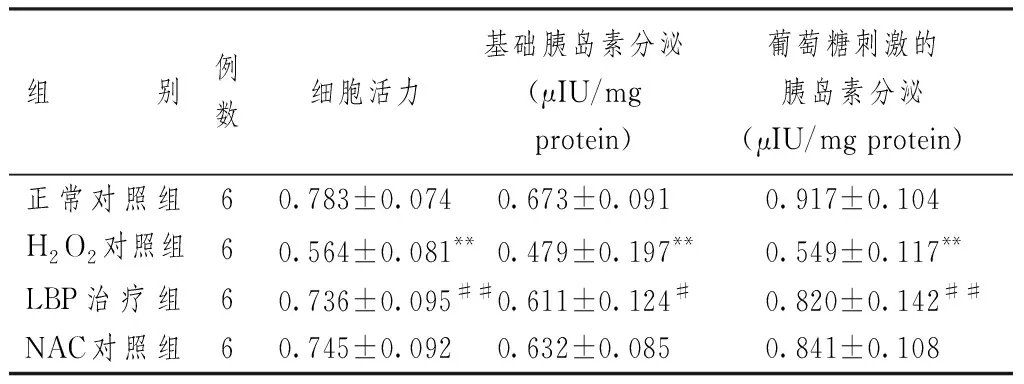
表1 枸杞多糖对INS-1细胞活力和GSIS的影响(±s)
组别例数细胞活力基础胰岛素分泌(μIU/mg protein)葡萄糖刺激的胰岛素分泌(μIU/mg protein)正常对照组60.783±0.0740.673±0.0910.917±0.104H2O2对照组60.564±0.081**0.479±0.197**0.549±0.117**LBP治疗组60.736±0.095##0.611±0.124#0.820±0.142##NAC对照组60.745±0.0920.632±0.0850.841±0.108
注:与正常对照组比较:**P<0.01; 与H2O2对照组比较:#P<0.05,##P<0.01
表1显示,100 μmol/l H2O2处理INS-1细胞24 h后,与正常对照组比较,H2O2对照组细胞活力明显降低,基础胰岛素分泌和葡萄糖刺激的胰岛素分泌都明显减少,差异有统计学意义(P<0.01);而LBP治疗组与H2O2对照组比较,细胞活力比明显增高(P<0.01),基础胰岛素分泌和葡萄糖刺激的胰岛素分泌明显增多,且葡萄糖刺激的胰岛素分泌比基础胰岛素分泌增加更为明显(P<0.01vsP<0.05),与NAC对照组比较差异无统计学意义。
2.2 枸杞多糖对H2O2处理INS-1细胞凋亡率及凋亡相关基因mRNA表达的影响
图1、表2显示,H2O2处理可引起INS-1细胞凋亡,其细胞凋亡率明显高于正常对照组(P<0.01);与H2O2对照组比较,LBP处理明显减少INS-1细胞的凋亡(P<0.01)。
表2显示,与正常对照组比较,H2O2对照组Bcl-2的表达水平明显降低(P<0.01),Bax和Caspase-3的表达水平明显升高(P<0.01,P<0.01)。在LBP治疗组中,Bcl-2的表达水平比H2O2对照组明显升高(P<0.01),Bax和Caspase-3的表达水平比H2O2对照组明显降低(P<0.01,P<0.01)。此外,LBP治疗组与NAC对照组比较差异无统计学意义。
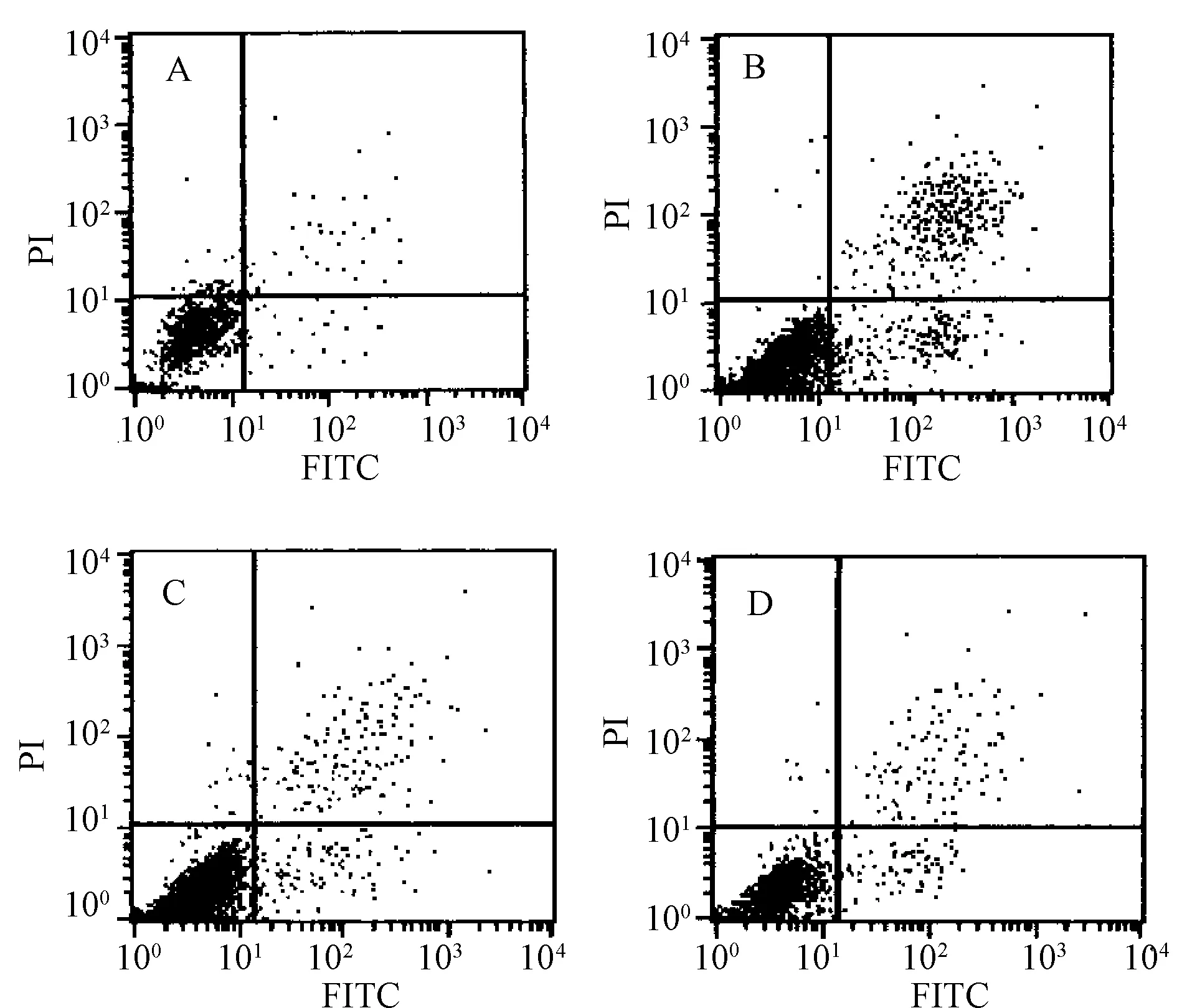
图1 INS-1细胞凋亡变化A. 正常对照组;B. H2O2对照组;C. 枸杞多糖治疗组;D. NAC对照组
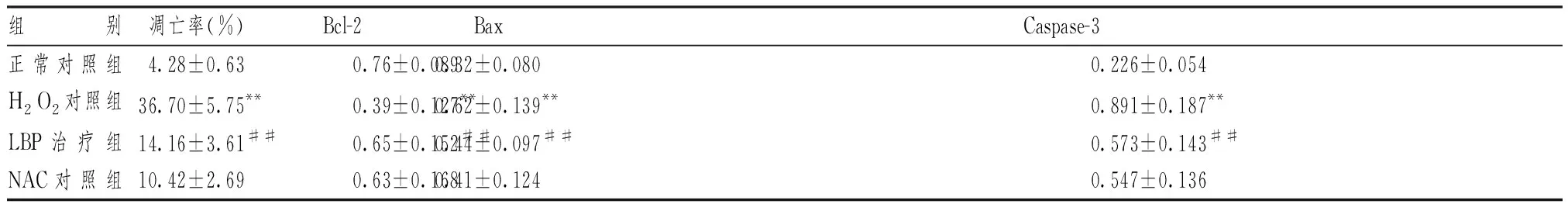
表2 枸杞多糖对H2O2处理INS-1细胞凋亡率及凋亡相关基因mRNA表达的影响
注:与正常对照组比较:**P<0.01; 与H2O2对照组比较:##P<0.01
3 讨论
凋亡是胰岛β细胞减少的主要原因[1],由此导致的胰岛素分泌减少是糖尿病发生发展的重要因素,因此研究胰岛β细胞的凋亡及其机制对糖尿病的防治具有重要意义。
INS-1是大鼠胰岛素瘤细胞系,具有胰岛素分泌功能,广泛应用于体外胰岛β细胞的相关研究中。本研究采用常用的H2O2凋亡模型,结果显示INS-1细胞活力和胰岛素分泌能力均明显降低,细胞凋亡也明显增多,由此说明INS-1细胞凋亡模型造模成功。
消渴病主要涉及肺、脾、肾、肝四脏,以脾肾为本,即以气阴为本。气阴两虚是消渴病最重要的病机。凋亡是在多种生理和病理条件下,细胞自主发生的一个程序性死亡过程。在细胞凋亡发生前期或早期,细胞内与凋亡相关的许多基因表达水平会发生变化,控制着细胞完成凋亡。Bcl-2和Bax是细胞内凋亡发生的2个关键调节因子,其中Bcl-2为抑凋亡因子,Bax为促凋亡因子,两者表达水平的相对比值是判断细胞凋亡或存活的重要指标。Caspase-3是位于Bcl-2与Bax下游的凋亡执行者,直接导致细胞凋亡。在本研究中,H2O2处理的INS-1细胞中Bcl-2 mRNA的表达明显降低, Bax 和Caspase-3 mRNA的表达明显升高,而LBP治疗组中Bcl-2的 mRNA表达明显升高,Bax 和Caspase-3 的mRNA表达明显降低。表明LBP可通过促进Bcl-2的表达,同时抑制Bax 和Caspase-3的表达,降低H2O2诱导的INS-1凋亡。汪朝阳等[2]研究发现,枸杞多糖能显著减少H2O2诱导氧化应激对大鼠晶状体上皮细胞的损伤,减少细胞凋亡。INS-1细胞H2O2凋亡模型的建立也是以H2O2诱导氧化应激从而引发INS-1细胞凋亡为基础,而LBP能显著减少INS-1细胞凋亡,其可能与减少细胞氧化应激损伤有关。刘磊等[3]研究发现,枸杞多糖能够促进胰岛β细胞的密度,改善胰岛细胞形态。本研究发现,LBP能显著保护H2O2刺激下INS-1细胞的活力,减少细胞凋亡,从一定程度上增加了INS-1细胞密度。
此外,我们还研究了LBP对体外INS-1 细胞胰岛素分泌功能的影响,结果发现,LBP对H2O2处理INS-1细胞的基础胰岛素分泌和葡萄糖刺激的胰岛素分泌都有明显的改善作用,尤以葡萄糖刺激的胰岛素分泌改善最为明显。蔡慧珍等[4]研究发现,枸杞多糖对小鼠胰岛β-TC6细胞的胰岛素分泌有促进作用,Zou等[5]报道枸杞多糖能刺激糖尿病小鼠胰岛素的分泌,Huang等[6]研究发现枸杞多糖及其复方能使链脲佐菌素诱导的糖尿病大鼠空腹胰岛素及β细胞功能指数升高。本研究结果与此也基本相同。
综上所述,枸杞多糖可能通过促进Bcl-2的表达,同时抑制Bax 和Caspase-3的表达,以降低H2O2诱导的INS-1凋亡,促进INS-1细胞胰岛素分泌。
参考文献:
[1] Biren BA, Harmon BV, Cameron DP, et al. 1Beta-cell apoptosis is responsible for the development of IDDM in the multiple low-dose streptozotocin model[J]. J Pathol, 1996, 178(2): 176-1811.
[2] 汪朝阳, 黄秀榕, 祁明信, 等. 枸杞多糖对氧化损伤大鼠晶状体上皮细胞凋亡的调控[J]. 眼视光学杂志, 2003, 5(2): 69-71.
[3] 刘磊,李青旺,赵蕊, 等.枸杞多糖对糖尿病小鼠胰岛细胞形态与功能的影响[J].黑龙江畜牧兽医,2008(3): 93-94.
[4] 蔡慧珍, 刘康福, 孙桂菊. 枸杞多糖对β-TC6细胞胰岛素分泌及相关基因的影响[J]. 江苏医药, 2013, 39(4): 391-393.
[5] Zou S, Zhang X, Yao W, et al. Structure characterization and hypoglycemic activity of a polysaccharide isolated from the fruit ofLyciumbarbarumL[J]. Carbohydrate Polymers, 2010, 80(4): 1161-1167.
[6] Huang C, Chen QL, Sun JT, Yang WB, Ma LJ, Wan XD. Protective effect of lycium barbarum polysaccharide and its compound recipe on pancreatic islet function in rats with streptozotocin-induced diabetes mellitus[J]. Chinese Journal of Clinical Rehabilitation, 2006, 10(23): 173-175.

