植物FKBP基因家族的结构及生物学功能
于彦丽, 李艳娇, 庞凯元, 张发军, 孙琦, 李文才, 孟昭东
山东省农业科学院玉米研究所, 小麦玉米国家工程实验室, 济南 250100
植物FKBP基因家族的结构及生物学功能
于彦丽, 李艳娇, 庞凯元, 张发军, 孙琦, 李文才, 孟昭东
山东省农业科学院玉米研究所, 小麦玉米国家工程实验室, 济南 250100
FK506结合蛋白(FK506 binding protein, FKBP)是一种在生物体中广泛存在、进化上高度保守的组成型蛋白质。除了作为免疫抑制剂FK506受体以外, FKBP还具有肽脯氨酰顺反异构酶(PPIase)的活性。FKBP在植物中是个大家族, 可作为分子伴侣与一些蛋白相互作用从而调控不同的生化过程。研究表明, 该家族基因在植物的响应胁迫和不同生长发育过程中都扮演着重要角色。最近许多新的FKBP互作蛋白的发现和鉴定表明, FKBP在调控基因表达和光合适应性方面具有广泛的生物学功能。文章对植物FKBP家族的结构特点、分类以及最新的功能研究进展进行了详细的综述。
FKBP; 结构特点; 生物学功能; 亲免素
亲免素(Immunophilin)是近年来发现的可与免疫抑制剂环孢霉素A(Cyclosporine-A, CsA)、FK506及雷帕霉素结合的一类细胞受体蛋白, 广泛地存在于生物体内, 且含量丰富[1]。根据结合的免疫抑制剂不同, 亲免素家族分为两类:与环孢素 A结合的蛋白称为亲环素(Cyclophilin, CyP); 另一类可与FK506和雷帕霉素特异结合, 称为FKBP[2,3]。自20世纪80年代初期发现亲免素以来, 人们已经成功分离纯化出多种 FKBP, 并且发现其与免疫抑制剂之间的相互作用, 预示着亲免素在器官移植领域有着巨大的潜力。免疫抑制剂已经被广泛地应用于自身免疫疾病和器官移植等多个方面, 亲免素可以与免疫抑制剂结合形成亲免素-免疫抑制剂复合物(FKBP-FK506, CyP-CsA), 在一定程度上可有效缓解机体内的排异反应[4]。另外, FKBP与正常的神经系统生化活动具有十分密切的联系, 可作为特异性小分子配体, 在治疗神经退行性疾病和促进神经再生等方面有着潜在的研究价值和临床应用价值[5]。在免疫细胞中, 亲免素-免疫抑制剂复合物可与钙调磷酸酶(Calcineurin, CaN)相互作用, 从而阻遏免疫相关基因表达过程中的磷酸化信号途径, 产生免疫抑制作用; FKBP-雷帕霉素复合体在细胞内的靶蛋白不是 CaN, 而是雷帕霉素靶体 TOP(Target of rapamycin), 通过与之结合为三元复合体, 抑制细胞周期的正常进行, 因此发挥免疫抑制的作用[6]。亲免素的一个主要特征是具有肽脯氨酰顺反异构酶(Peptidyl-prolyl cis-trans isomerase, PPIase)活性, 即催化多肽或蛋白质底物中脯氨酸残基N端肽键的构象由顺式转为反式[7~9]。肽链末端肽键的顺式反式异构体之间的自由转换对于新生蛋白和生物大分子来说, 是其正确折叠和正确自我组装所必需的[7~9]。除了具有PPIase酶活性, FKBPs还充当着分子伴侣的角色, 提供蛋白质之间相互作用的结合位点[10]。
自1989年首次发现FKBP[7,8]以来, 关于该基因家族的研究大部分集中在酵母和哺乳动物中, 而在高等植物中的研究相对较少。FKBP基因家族在拟南芥(Arabidopsis thaliana)[11]、水稻(Oryza sative L.)[12]和玉米(Zea mays L.)[13]中分别有23、29和24个成员。对植物FKBP基因家族研究显示, FKBP参与细胞信号转导、蛋白定位、蛋白折叠和转运等过程, 对植物的生长发育具有一定的调节作用, 并且可以调控激素信号的转导, 在植物抗逆生理中起重要作用[14~16]。本文针对植物 FKBP家族, 对其结构、进化与分类以及各种生物学功能等方面的研究进行了综述, 以期为科研工作者对其基因新功能的挖掘以及基因功能的应用奠定基础。
1 植物FKBP的结构域组成
1.1 FK506结合域
FKBP蛋白家族的每个成员都至少含有一个FK506结合域(FKBd), 该结构域既是FK506和雷帕霉素的结合位点, 也是 PPIase催化作用的活性位点。FKBd大约含有110个保守的氨基酸序列, 且三级结构高度保守[17~19]。FKBd由6条反向平行的β链构成的β折叠、一段短的α螺旋以及30s、40s、50s、80s四段柔性连接环区(根据其在FKBP序列上的位置来命名)组成(图 1)。β折叠可形成一个正对α螺旋的凹面, 核心蛋白形成疏水腔可结合脯氨酸, 疏水侧链伸向该疏水腔[20~22]。尽管FKBd在结构上严格保守, 还是有相当一部分的 FKBP表现出低或无PPIase活性(表1), 说明该结构域可能有其他的功能。
1.2 多结构域FKBP

图1 FKBd结构模型H. sapiens FKBP12的三级结构
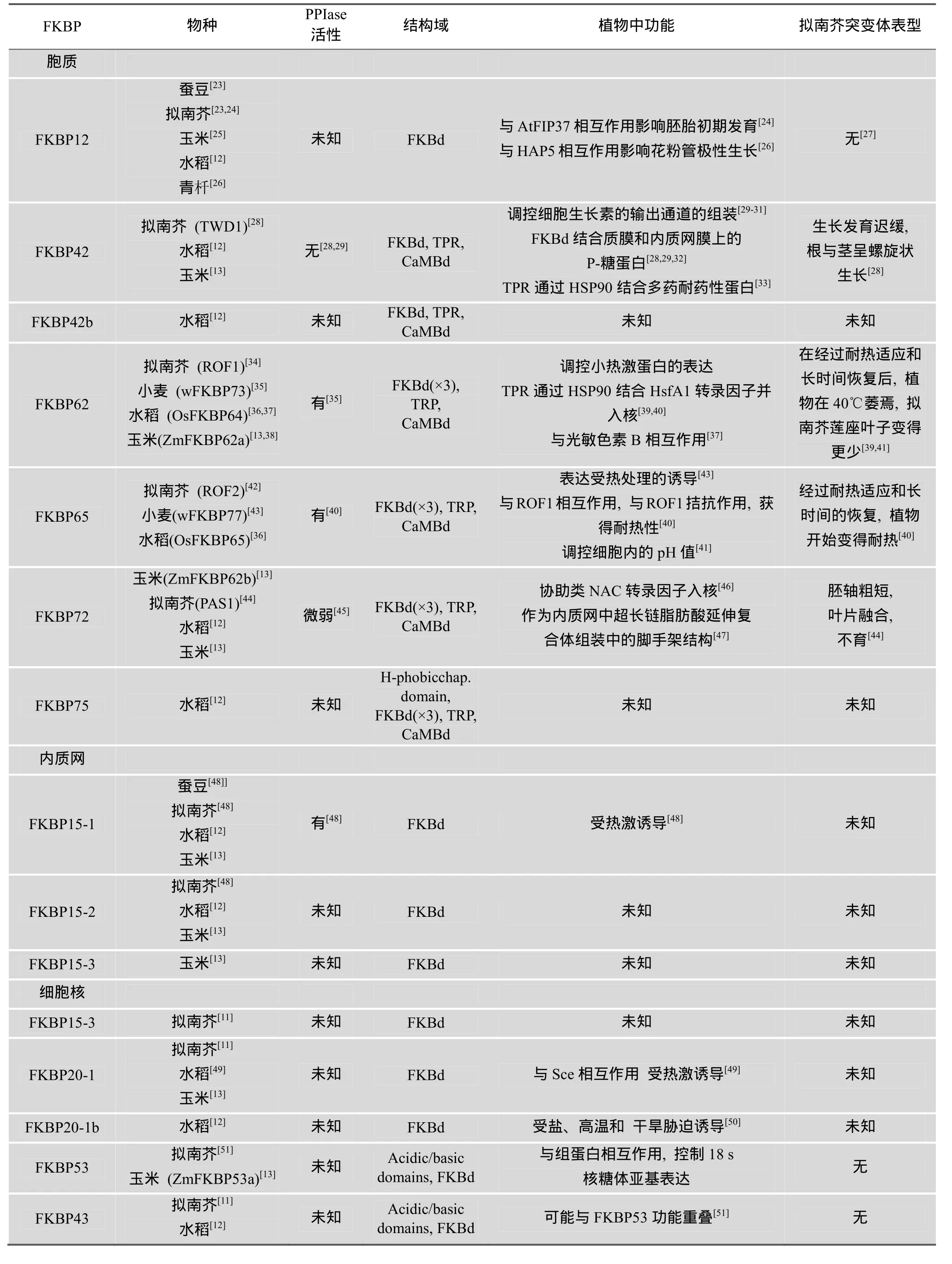
表1 植物中FKBP家族已知成员

(续表1)
植物FKBP家族成员的大小变化范围非常广泛,如拟南芥AtFKBP12是只有一个FKBd组成的单结构域(Single-domain, SD)的FKBP, 其分子量只有12 kDa,而小麦 wFKBP77是具有多个结构域(Multidomain, MD)的FKBP, 其分子量为77 kDa[43]。植物及其他物种中的大分子量的 FKBP除了含有基本的结构域FKBd外, 还含有其他结构域:TPR(Tetratricopeptide repeat, 三十四肽重复序列)形成反向平行的α螺旋结构域, 可与热激蛋白 HSP90结合[42]; CaMBds (Calmodulin-binding domains, 钙调素结合结构域)通常位于植物大分子量 FKBP的 C端并且能够与CaM(Calmodulin, 钙调素)结合[28,38](图 2)。尽管植物FKBP在钙离子信号途径中的作用目前还不清楚,但是哺乳动物 FKBP38的 TPR区可以和热激蛋白HSP90结合, 末端FKBd与靶蛋白结合, C端CaMBd可以受到Ca离子信号调控, 从而激活其PPIase和分子伴侣的活性[58], 这预示着多结构域的植物 FKBP可能也具有类似的钙调控机制。总之, 对于多结构域 FKBP来说, 其复杂的结构也将赋予其更加复杂和重要的功能。

图2 FKBP结构示意图AtFKBP12代表单结构域 FKBP, wFKBP77代表多结构域 FKBP。蓝色方框代表 FKBd(FK506结合域), 红色方框代表TPR(tetratricopeptide repeat, 三十四肽重复序列), 黄色方框代表 CaMBds(钙调素结合结构域), 棕色方框代表细胞核定位信号(nuclear localization signals), 数字表示氨基酸位置。
2 植物FKBPs的生物学功能
2.1 FKBP家族成员的抗逆功能
拟南芥 AtFKBP62和 AtFKBP65通常被称作ROF1和ROF2, 是多结构域的FKBP, 它们之间的同源性达到 85%, 二者是通过基因复制产生, 互为旁系同源物。Breiman等[39,40]研究发现ROF1和ROF2通过调控高温胁迫修复相关的小热激蛋白(sHSPs)的表达来响应高温胁迫, 但是二者在拟南芥长期遭受高温时的发育过程中却具有相反的作用。ROF1通过其TPR与HSP90结合, HSP90又与热激转录因子HsfA2结合, ROF1-HSP90-HsfA2复合体转运到细胞核内诱导sHSPs和ROF2的表达[39]。ROF2通过与 ROF1的 FKBd结合, 破坏核内 ROF1-HSP90-HsfA2复合物, 因而可以负调控 sHSP的表达[40]。rof1基因敲除后, 植物热激再恢复2~3 d后几乎完全丧失抵抗高温的能力, HsfA2基因敲除后表型与rof1相似, 但是rof2突变体和ROF1超表达植株与野生型对照相比, 获得了更强的持续耐热的能力[39,40]。ROF2最近被证实通过控制K+内流来调控细胞内pH值和细胞膜的极性, rof1/rof2双突变体比rof1或rof2任一单突变体对于酸抑制都更加敏感, 说明 ROF1和ROF2功能协同[41]。
在小麦[35,43]、水稻[36]和玉米[13]中都存在 ROF1/ ROF2的同源蛋白, 它们的结构及表达模式都与拟南芥同源基因相似, 说明在高等植物中, 这对旁系同源FKBP在获得性耐热机制中的拮抗作用也是保守的。哺乳动物中FKBP52/FKBP51是ROF1/ROF2的同源蛋白, 它们通过TPR与HSP90结合, 进而结合到糖皮质激素或其他一些类固醇受体上响应胁迫[59]。同ROF1和ROF2一样, FKBP52和FKBP51在胁迫响应中的作用也相反。FKBP52协助与之结合的糖皮质激素进入细胞核, 促进包括 FKBP51在内的胁迫响应基因的表达, FKBP51抑制糖皮质激素的转运[50,60]。类似于ROF1/ROF2的旁系同源物在胁迫响应过程中存在微调机制, 由此推测其他 FKBP旁系同源物可能也存在相似的调控方式。
水稻OsFKBP20-1a和OsFKBP20-1b具有85%的同源性, 尽管组织表达模式不同, 但是都受高温和干旱诱导。Ahn等[61]报道, OsFKBP20-1a在所有植物组织中都有高丰度表达, 在高温和干旱胁迫下表达量迅速上升, 然而OsFKBP20-1b只在胁迫处理24 h后表达量才开始升高。二者都定位于细胞核中, 而OsFKBP20-1b 同时还存在 于细胞质中[61]。OsFKBP20-1a与SUMO结合酶(Sce)结合, Sce又可通过小类泛素修饰蛋白(Small ubiquitin-like modifier, SUMO)与其他靶蛋白结合, 从而参与高温胁迫响应[49], 但是目前还未发现与OsFKBP20-1a互作的蛋白。拟南芥中参与胁迫响应的同源复制FKBP是定位于内质网上的AtFKBP15-1和AtFKBP15-2, 二者同源性达到 70%且都受高温诱导, 但具体功能目前还不清楚[11,48]。我们在玉米中也发现了旁系同源的FKBP, ZmFKBP15-3明显受高温诱导, 而 ZmFKBP15-1和ZmFKBP15-2在高温条件下表达量与正常水平一致[13]。
2.2 FKBP家族成员在植物生长发育过程中的作用
由于拟南芥atfkbp42突变体发育迟缓而且根茎呈螺旋生长, 因此 AtFKBP42也被称作 TWD1(TWISTED DWARF1), 这种表型是由于TWD1与胞内生长素外流相关蛋白 ABC(ATP-binding cassette)的结合影响了生长素运输而导致[29,33]。进一步研究表明, TWD1通过其单一的FKBd结合到ABCB1(P-糖蛋白PGP1)和ABCB19(P-糖蛋白PGP19)的C端,调控质膜上生长素转运系统的形成[29,30,33,62,63]。目前已从质膜和液泡膜上分离得到 TWD1[28], 该蛋白是通过其C端的膜锚定肽结合到膜上[31,64]。近来有研究表明TWD1位于内质网的胞质面, 并在该位置行使ABCB分子伴侣的功能从而进入分泌途径[32], 目前这一结论还存有争议。ABC家族成员ABCC1和ABCC2也称为多药耐药蛋白 MRP1和 MRP2[33,65],可以参与液泡内砷、镉、汞的转运, ABCC1和ABCC2中恰好具有可与 TWD1 的 TPR结合的 CaMBd[66],但是TPR-CaMBd结合并不受体内Ca2+和CaM的影响[33], 并且其对于钙信号转导是否具有调控作用,仍有待于进一步验证。TWD1的TPR结构域也可以和HSP90结合[28], 但是该结构域的作用仍不明确。TWD1的C端具有一个CaMBd, 该结构域对TWD1与膜转运蛋白ABCC1和ABCC2的结合没有任何影响, 其具体功能仍然未知。
超长链脂肪酸(Very long chain fatty acids, VLCFAs)是许多脂类的重要组成成分, 如膜上的磷脂和鞘脂, 它们是细胞正常分裂和分化所必需的。FKBP72由于参与VLCFAs的合成, 因而在植物发育中起重要作用[67]。FKBP72功能被破坏后使VLCFAs合成中断, 进而导致细胞分裂发生紊乱[47], 产生拟南芥 atfkbp72突变体表型“PASTICCINO”[24,44]。AtFKBP72(PAS1)可以和参与VLCFAs合成的酶结合,如脱水酶(PAS2)、碳酸酶(PAS3)和还原酶(CER10, ECR)等, 因此被称为内质网上组装VLCFAs延伸复合体的脚手架[47,68,69]。PAS1也可以作为分子伴侣协助FAN(FKBP-associated NAC)转录因子转运到细胞核中, 调控细胞的增殖[46]。PAN1均是通过其C端的CaMBd与VLCFA延伸复合体或FAN进行结合[45],预示这种结合可能受到CaM的调控。与TWD1类似, PAS1的 C端紧邻 CaMBd处有一个膜定位信号肽,使得 PAS1一直被定位在质膜上, 因而在细胞分裂过程中, 不能进入细胞核来调控细胞分化[46]。直到与CaM或FAN结合后, PAS1接受细胞分化的信号,才能够从质膜上分离, 由其 N端的核定位信号引导复合体进入到细胞核中[12]。
FKBP12是植物中最小的FKBP, 定位于细胞质中[13,16]。拟南芥AtFKBP12可与AtFIP37结合, At-FIP37是DNA结合蛋白, 参与mRNA剪接、细胞周期调控和胚胎发育[24,27]。在青杄中, PwFKBP12可与HAP类转录因子的亚基HAP5结合, 调控花粉管极性生长[26]。这些都说明植物FKBP12可以调控DNA结合蛋白的核运输。
2.3 叶绿体FKBP在植物光合反应系统中的调控作用
2.3.1 调控光合膜的组装
蛋白质组学分析表明在拟南芥中有相当多的FKBP与类囊体有关[70,71]。通过对高等植物 FKBP基因信号肽进行分析, 预测有30%~50%的FKBP定位于类囊体[11~13]。拟南芥类囊体PPIase活性检测表明, 在类囊体中仅有FKBP13和亲环素CYP20-2具有PPIase活性[55,72], 然而二者在叶绿体中功能冗余,所以亲免素的PPIase活性在叶绿体中是否具有重要作用存在争议[73]。近期一些研究表明, 位于叶绿体腔内的多数FKBP的主要功能是调控光合膜的组装。PSⅡ(光系统Ⅱ)对植物生长至关重要, 拟南芥FKBP20-2功能缺失后, 导致 PSⅡ的蛋白超级复合物含量下降, 而未组装的PSⅡ的单体和二聚体含量上升, 说明AtFKBP20-2 对PSⅡ的稳定性和PSⅡ的组装具有一定的影响[57]。Gollan等[54]通过酵母双杂交实验证明小麦TaFKBP16-1与PSⅠ(光系统Ⅰ)的亚基PsaL之间存在相互作用, 说明TaFKBP16-1参与 PSⅠ的形成, 而 TaFKBP16-3被证实可与 Thf1 (Thylakoid formation-1)和 APO2(Accumulation of PSI-2)结合, 后两者均参与光合膜形成。此外, 该课题组还发现 TaFKBP13可与光合电子传递的主要载体 Cyt b6f (类囊体细胞色素 b6f复合体)的亚基Rieske铁硫蛋白结合。Gupta等[53]早期通过酵母双杂交实验发现Rieske蛋白与AtFKBP13的信号肽特异结合, 并推测AtFKBP13是Rieske蛋白组装的调控因子。但是在atfkbp13功能缺失突变体中, Rieske蛋白并没有积累[73], 而且Rieske与类囊体腔内成熟的 TaFKBP13互作, 并不与其叶绿体中的前体形式结合[54], 因此 FKBP13-Rieske相互作用的意义仍有待进一步验证。
2.3.2 调控光合作用过程中的电子流动
最近研究发现 AtFKBP16-2位于类囊体蛋白NDH(NADPH脱氢酶复合体)中, 并且在NDH的组装及 NDH-PSⅠ超级蛋白复合体的形成等方面具有重要作用[75]。植物FKBP13和FKBP16-2是旁系同源蛋白, 它们都在相同的位置具有半胱氨酸对[11,12], AtFKBP13的半胱氨酸对经过氧化可形成二硫键,从而使活性位点更加稳定并可结合靶蛋白[56,75], 因此有可能 FKBP13结合靶蛋白的活性, 是由类囊体内的氧化还原信号所调控。由此类推, FKBP16-2也具有结合靶蛋白的活性且受类囊体内氧化还原信号所调控。作为环式电子传递的载体, NDH和Cyt b6f的组装及活性都是经由这些FKBP与氧化还原作用联系起来[74,76,77]。C4植物的光合效率明显高于 C3植物归功于它的维管束鞘细胞, C4植物维管束鞘细胞中FKBP13和FKBP16-2含量显著高于叶肉细胞[78],也间接说明FKBP在光合电子传递过程中发挥一定的作用。
3 植物FKBP调控基因的表达
FKBP除了可以参与调控植物生长发育和胁迫响应外, 最近有报道证明拟南芥 FKBP53参与调控核糖体基因的表达[51]。AtFKBP53是定位于细胞核中的多结构域 FKBP, 通过其 N端的酸性氨基酸结构域与核小体中的组蛋白 H3结合, 从而在染色质水平上抑制核糖体RNA基因(18S rDNA)的表达, 这表明AtFKBP53参与核小体组装及基因的转录调控。在AtFKBP53的旁系同源蛋白 AtFKBP43的N端同样存在酸性氨基酸结构域, 说明二者可能具有相同功能, 即功能冗余, 所以拟南芥突变体 atfkbp43和atfkbp53均没有明显表型[51]。
4 植物FKBP家族的进化
植物在进化过程中普遍存在基因复制现象, 所谓基因复制是指基因通过不等交换、逆转录转座或全基因组重复等途径产生一个与原基因相似的基因或碱基序列[79]。植物FKBP家族中有部分成员通过基因复制产生旁系同源物, 如拟南芥中AtFKBP15-1与AtFKBP15-2、AtFKBP62与AtFKBP65互为旁系同源物[11]。大多数高等植物FKBP没有旁系同源物,如TWD1、PAS1和FKBP12, 它们通常都具有PPIase活性且在植物发育过程中担任重要角色。与通过基因复制产生的FKBP相比, 它们与非植物FKBP间具有更远的进化关系。说明该类FKBP具有较快的进化速率, 促使其典型的FKBd出现变异, 因而作为分子伴侣可以和更多的蛋白结合。另一方面, 在某些植物中, 有近一半数量的 FKBP是基因复制的产物, 互为旁系同源物的 FKBP可以结合相同的靶蛋白。当经过一系列进化, 它们的FKBd的loop区产生变异, 各自又可以结合不同的底物。Riggs等[80]报道, 哺乳动物FKBP51原本抑制激素受体的转运,仅仅使其 80s loop上的一个氨基酸发生突变, 它就能像其旁系同源物FKBP52一样促进激素受体的转运。在很多旁系同源物中存在这种功能相反的现象,如之前所述的ROF1和ROF2, 为植物响应胁迫提供了微调机制, 也预示其他类似旁系同源物如FKBP15-1和 FKBP15-2、FKBP43和 FKBP53及FKBP13和FKBP16-2间具有类似功能。
高等植物FKBP多基因家族的进化是通过外显子跳跃和基因复制[12,18,81], 最初的 FKBP通过其疏水腔的脯氨酸基序与靶蛋白结合, 随着复制基因关键位点突变的产生, FKBP的靶蛋白逐渐出现多样性。进化的另一个结果就是在多结构域FKBP中, 如TWD1、ROF1/ROF2, 除了FKBd外还出现了TPR、CaMBds以及膜定位信号等结构域, 使得这些FKBP可与特定靶蛋白、其他蛋白复合体、转运蛋白及膜结合, 从而行使更多的功能。FKBP被称为调控某些蛋白活性的分子开关, 一种可能是因为其具有的PPIase活性可以调控脯氨酸的构象[82], 另一种可能是 FKBP可以结合到特定的脯氨酸基序上, 从而调控靶蛋白和其他蛋白或酶间的结合。这种假设在哺乳动物和酵母 FKBP12上得到了验证, 二者分别与脯氨酸类似物FK506和雷帕霉素结合后, 抑制CaN激酶活性和 TOR磷酸酶活性[6]。Geisler等[30]发现TWD1可与PINOID激酶结合, 从而调控ABCB1生长素转运蛋白的磷酸化, 另外哺乳动物 FKBP52促进 AKT激酶和 PHLLP磷酸激酶的结合[83], 说明FKBP可参与调控靶蛋白的磷酸化。但是目前还没有证据表明FKBd或单结构域FKBP结合靶蛋白后可直接与激酶或磷酸酶结合。
5 结 语
植物FKBP在信号转导、胁迫响应、光合作用以及基因转录等方面都具有重要作用。然而, 部分FKBP对植物的生理生化过程具有重要功能而其他却功能冗余, 其 PPIase活性具有什么功能目前也未知, 因此植物FKBP的保守结构域FKBd的主要功能还不能确定。植物FKBP通过其FKBd结构域与特有的分子伴侣蛋白结合, 这些蛋白的多样性和复杂性说明, FKBd通过进化发生了变异从而可与不同蛋白结合。最近几年, 在植物 FKBP基因克隆与功能分析方面取得了一定进展, 但是植物 FKBP与其底物相互作用的机制, 还有待深入研究。为了更加清楚的了解该基因家族的全部特征, 需要通过基因工程, 获得所有基因的转基因株系, 进而系统研究该家族中各成员的功能。同时, 也可以通过获得各个基因的突变体来研究基因的功能。相信随着分子生物学技术的迅猛发展, 可以为将来植物 FKBP基因功能的深入研究提供一个有力的技术平台。
[1] 张石革. 免疫抑制剂的进展与临床应用评价. 中国医院用药评价与分析, 2008, 8(11): 803–808.
[2] Schreiber SL. Chemistry and biology of the immunophilins and their immunosuppressive ligands. Science, 1991, 251(4991): 283–287.
[3] Fruman DA, Burakoff SJ, Bierer BE. Immunophilins in protein folding and immunosuppression. FASEB J, 1994, 8(6): 391–400.
[4] Baumann G. Molecular mechanism of immunosuppressive agents. Transplant Proc, 1992, 24(4 Suppl 2): 4–7.
[5] Gold BG, Storm-Dickerson T, Austin DR. The immunosuppressant FK506 increases functional recovery and nerve regeneration following peripheral nerve injury. Restor Neurol Neurosci, 1994, 6(4): 287–296.
[6] Sigal NH, Dumont FJ. Cyclosporin A, FK-506, and rapamycin: pharmacologic probes of lymphocyte signal transduction. Annu Rev Immunol, 1992, 10: 519–560.
[7] Harding MW, Galat A, Uehling DE, Schreiber SL. A receptor for the immunosuppressant FK506 is a cis-trans peptidyl-prolyl isomerase. Nature, 1989, 341(6244): 758–760.
[8] Siekierka JJ, Staruch MJ, Hung SH, Sigal NH. FK-506, a potent novel immunosuppressive agent, binds to a cytosolic protein which is distinct from the cyclosporin A-binding protein, cyclophilin. J Immunol, 1989, 143(5): 1580–1583.
[9] Fischer G, Bang H, Mech C. Determination of enzymatic catalysis for the cis-trans-isomerization of peptide binding in proline-containing peptides. Biomed Biochim Acta, 1984, 43(10): 1101–1111.
[10] Van Duyne GD, Standaert RF, Karplus PA, Schreiber SL, Clardy J. Atomic structure of FKBP-FK506, an immunophilin-immunosuppressant complex. Science, 1991, 252(5007): 839–842.
[11] He ZY, Li LG, Luan S. Immunophilins and parvulins. Superfamily of peptidyl prolyl isomerases in Arabidopsis. Plant Physiol, 2004, 134(4): 1248–1267.
[12] Gollan PJ, Bhave M. Genome-wide analysis of genes encoding FK506-binding proteins in rice. Plant Mol Biol 2010, 72(1–2): 1–16.
[13] Yu YL, Zhang H, Li WC, Zhang FJ, Mu CH, Wang LM, Meng ZD. Genome-wide analysis and environmental response profiling of the FK506-binding protein gene family in maize (Zea mays L.). Gene, 2012, 498(2): 212–222.
[14] Breiman A, Fawcett TW, Ghirardi ML, Mattoo AK. Plant organelles contain distinct peptidylprolyl cis, transisomerases. J Biol Chem, 1992, 267(30): 21293–21296.
[15] Breiman A, Camus I. The involvement of mammalian and plant FK506-binding proteins (FKBPs) in development. Transgenic Res, 2002, 11(4): 321–335.
[16] Geisler M, Bailly A. Tete-a-tete: the function of FKBPs in plant development. Trends Plant Sci, 2007, 12(10): 465–473.
[17] Van Duyne GD, Standaert RF, Karplus PA, Schreiber SL, Clardy J. Atomic structures of the human immunophilin FKBP-12 complexes with FK506 and rapamycin. J Mol Biol, 1993, 229(1): 105–124.
[18] Patterson CE, Gao JM, Rooney AP, Davis EC. Genomic organization of mouse and human 65 kDa FK506-binding protein genes and evolution of the FKBP multigene family. Genomics, 2002, 79(6): 881–889.
[19] Somarelli JA, Lee SY, Skolnick J, Herrera RJ. Structure-based classification of 45 FK506-binding proteins. Proteins, 2008, 72(1): 197–208.
[20] Fanghänel J, Fischer G. Insights into the catalytic mechanism of peptidyl prolyl cis/trans isomerases. Front Biosci, 2004, 9: 3453–3478.
[21] Gollan PJ, Bhave M, Aro EM. The FKBP families of higher plants: Exploring the structures and functions of protein interaction specialists. FEBS Lett, 2012, 586(20): 3539–3547.
[22] Szep S, Park S, Boder ET, Van Duyne GD, Saven JG. Structural coupling between FKBP12 and buried water. Proteins, 2009, 74(3): 603–611.
[23] Xu Q, Liang SP, Kudla J, Luan S. Molecular characterization of a plant FKBP12 that does not mediate action ofFK506 and rapamycin. Plant J, 1998, 15(4): 511–519.
[24] Faure JD, Gingerich D, Howell SH. An Arabidopsis immunophilin, AtFKBP12, binds to AtFIP37 (FKBP interacting protein) in an interaction that is disrupted by FK506. Plant J, 1998, 15(6): 783–789.
[25] Agredano-Moreno LT, Reyes de la Cruz H, Martinez-Castilla LP, Sánchez de Jimenez E. Distinctive expression and functional regulation of the maize (Zea mays L.) TOR kinase ortholog. Mol Biosyst, 2007, 3(11): 794–802.
[26] Yu YL, Li YZ, Huang GX, Meng ZD, Zhang D, Wei J, Yan K, Zheng CH, Zhang LY. PwHAP5, a CCAAT-binding transcription factor, interacts with PwFKBP12 and plays a role in pollen tube growth orientation in Picea wilsonii. J Exp Bot, 2011, 62(14): 4805–4817.
[27] Vespa L, Vachon G, Berger F, Perazza D, Faure JD, Herzog M. The immunophilin-interacting protein AtFIP37 from Arabidopsis is essential for plant development and is involved in trichome endoreduplication. Plant Physiol, 2004, 134(4): 1283–1292.
[28] Kamphausen T, Fanghänel J, Neumann D, Schulz B, Rahfeld JU. Characterization of Arabidopsis thaliana AtFKBP42 that is membrane-bound and interacts with Hsp90. Plant J, 2002, 32(3): 263–276.
[29] Geisler M, Kolukisaoglu HÜ, Bouchard R, Billion K, Berger J, Saal B, Frangne N, Koncz-Kalman Z, Koncz C, Dudler R, Blakeslee JJ, Murphy AS, Martinoia E, Schulz B. TWISTED DWARF1, a unique plasma membraneanchored immunophilin-like protein, interacts with Arabidopsis multidrug resistance-like transporters AtPGP1 and AtPGP19. Mol Biol Cell, 2003, 14(10): 4238–4249.
[30] Henrichs S, Wang BJ, Fukao Y, Zhu JS, Charrier L, Bailly A, Oehring SC, Linnert M, Weiwad M, Endler A, Nanni P, Pollmann S, Mancuso S, Schulz A, Geisler M. Regulation of ABCB1/PGP1-catalysed auxin transport by linker phosphorylation. EMBO J, 2012, 31(13): 2965–2980.
[31] Titapiwatanakun B, Blakeslee JJ, Bandyopadhyay A, Yang HB, Mravec J, Sauer M, Cheng Y, Adamec J, Nagashima A, Geisler M, Sakai T, Friml J, Peer WA, Murphy AS. ABCB19/PGP19 stabilises PIN1 in membrane microdomains in Arabidopsis. Plant J, 2009, 57(1): 27–44.
[32] Wu GS, Otegui MS, Spalding EP. The ER-localized TWD1 immunophilin is necessary for localization of multidrug resistance-like proteins required for polar auxin transport in Arabidopsis roots. Plant Cell, 2010, 22(10): 3295–3304.
[33] Geisler M, Girin M, Brandt S, Vincenzetti V, Plaza S, Paris N, Kobae Y, Maeshima M, Billion K, Kolukisaoglu UH, Schulz B, Martinoia E. Arabidopsis immunophilin-like TWD1 functionally interacts with vacuolar ABC transporters. Mol Biol Cell, 2004, 15(7): 3393–3405.
[34] Vucich VA, Gasser CS. Novel structure of a high molecular weight FK506 binding protein from Arabidopsis thaliana. Mol Gen Genet, 1996, 252(5): 510–517.
[35] Blecher O, Erel N, Callebaut I, Aviezer K, Breiman A. A novel plant peptidyl-prolyl-cis-trans-isomerase (PPIase): cDNA cloning, structural analysis, enzymatic activity and expression. Plant Mol Biol, 1996, 32(3): 493–504.
[36] Magiri EN, Farchi-Pisanty O, Avni A, Breiman A. The expression of the large rice FK506 binding proteins (FKBPs) demonstrate tissue specificity and heat stress responsiveness. Plant Sci, 2006, 170(4): 695–704.
[37] Gu SH, Zhang F, Wu NH. OsFKBP1 interacts with phytochrome B in rice. Prog Nat Sci, 2009, 19(11): 1523–1528.
[38] Hueros G, Rahfeld J, Salamini F, Thompson R. A maize FK506-sensitive immunophilin, mzFKBP-66, is a peptidylproline cis-trans-isomerase that interacts with calmodulin and a 36-kDa cytoplasmic protein. Planta, 1998, 205(1): 121–131.
[39] Meiri D, Breiman A. Arabidopsis ROF1 (FKBP62) modulates thermotolerance by interacting with HSP90.1 and affecting the accumulation of HsfA2-regulated sHSPs. Plant J, 2009, 59(3): 387–399.
[40] Meiri D, Tazat K, Cohen-Peer R, Farchi-Pisanty O, Aviezer-Hagai K, Avni A, Breiman A. Involvement of Arabidopsis ROF2 (FKBP65) in thermotolerance. Plant Mol Biol, 2010, 72(1–2): 191–203.
[41] Bissoli G, Ninoles R, Fresquet S, Palombieri S, Bueso E, Rubio L, Garcia-Sanchez MJ, Fernandez JA, Mulet JM, Serrano R. Peptidyl-prolyl cis-trans isomerase ROF2 modulates intracellular pH homeostasis in Arabidopsis. Plant J, 2012, 70(4): 704–716.
[42] Aviezer-Hagai K, Skovorodnikova J, Galigniana M, Farchi-Pisanty O, Maayan E, Bocovza S, Efrat Y, von Koskull-Doring P, Ohad N, Breiman A. Arabidopsis immunophilins ROF1 (AtFKBP62) and ROF2 (AtFKBP65) exhibit tissue specificity, are heat-stress induced, and bind HSP90. Plant Mol Biol, 2007, 63(2): 237–255.
[43] Kurek I, Aviezer K, Erel N, Herman E, Breiman A. The wheat peptidyl prolylcis-trans-isomerase FKBP77 is heat induced and developmentally regulated. Plant Physiol, 1999, 119(2): 693–704.
[44] Vittorioso P, Cowling R, Faure JD, Caboche M, Bellini C. Mutation in the Arabidopsis PASTICCINO1 gene, which encodes a new FK506-binding protein-like protein, has a dramatic effect on plant development. Mol Cell Biol, 1998,18(5): 3034–3043.
[45] Carol RJ, Breiman A, Erel N, Vittorioso P, Bellini C. PASTICCINO1 (AtFKBP70) is a nuclear-localised immunophilin required during Arabidopsis thaliana embryogenesis. Plant Science, 2001, 161(3): 527–535.
[46] Smyczynski C, Roudier F, Gissot L, Vaillant E, Grandjean O, Morin H, Masson T, Bellec Y, Geelen D, Faure JD. The C terminus of the immunophilin PASTICCINO1 is required for plant development and for interaction with a NAC-like transcription factor. J Biol Chem, 2006, 281(35): 25475–25484.
[47] Roudier F, Gissot L, Beaudoin F, Haslam R, Michaelson L, Marion J, Molino D, Lima A, Bach L, Morin H, Tellier F, Palauqui JC, Bellec Y, Renne C, Miquel M, Dacosta M, Vignard J, Rochat C, Markham JE, Moreau P, Napier J, Faure JD. Very-long-chain fatty acids are involved in polar auxin transport and developmental patterning in Arabidopsis. Plant Cell, 2010, 22(2): 364–375.
[48] Luan S, Kudla J, Gruissem W, Schreiber SL. Molecular characterization of a FKBP-type immunophilin from higher plants. Proc Natl Acad Sci USA, 1996, 93(14): 6964–6969.
[49] Nigam N, Singh A, Sahi C, Chandramouli A, Grover A. SUMO-conjugating enzyme (Sce) and FK506-binding protein (FKBP) encoding rice (Oryza sativa L.) genes: genome-wide analysis, expression studies and evidence for their involvement in abiotic stress response. Mol Genet Genomics, 2008, 279(4): 371–383.
[50] Jääskeläinen T, Makkonen H, Palvimo JJ. Steroid up-regulation of FKBP51 and its role in hormone signaling. Curr Opin Pharmacol, 2011, 11(4): 326–331.
[51] Li H, Luan S. AtFKBP53 is a histone chaperone required for repression of ribosomal RNA gene expression in Arabidopsis. Cell Res, 2010, 20(3): 357–366.
[52] Luan S, Albers MW, Schreiber SL. Light-regulated, tissue-specific immunophilins in a higher plant. Proc Natl Acad Sci USA, 1994, 91(3): 984–988.
[53] Gupta R, Mould RM, He ZY, Luan S. A chloroplast FKBP interacts with and affects the accumulation of Rieske subunit of cytochrome bf complex. Proc Natl Acad Sci USA, 2002, 99(24): 15806–15811.
[54] Gollan PJ, Ziemann M, Bhave M. PPIase activities and interaction partners of FK506-binding proteins in the wheat thylakoid. Physiol Plant, 2011, 143(4): 385–395.
[55] Edvardsson A, Shapiguzov A, Petersson UA, Schröder WP, Vener AV. Immunophilin AtFKBP13 sustains all peptidyl-prolyl isomerase activity in the thylakoid lumen from Arabidopsis thaliana deficient in AtCYP20–2. Biochemistry, 2007, 46(33): 9432–9442.
[56] Gopalan G, He ZY, Balmer Y, Romano P, Gupta R, Héroux A, Buchanan BB, Swaminathan K, Luan S. Structural analysis uncovers a role for redox in regulating FKBP13, an immunophilin of the chloroplast thylakoid lumen. Proc Natl Acad Sci USA, 2004, 101(38): 13945–13950.
[57] Lima A, Lima S, Wong JH, Phillips RS, Buchanan BB, Luan S. A redox-active FKBP-type immunophilin functions in accumulation of the photosystem II supercomplex in Arabidopsis thaliana. Proc Natl Acad Sci USA, 2006, 103(33): 12631–12636.
[58] Edlich F, Weiwad M, Erdmann F, Fanghänel J, Jarczowski F, Rahfeld JU, Fischer G. Bcl-2 regulator FKBP38 is activated by Ca2+/calmodulin. EMBO J, 2005, 24(14): 2688–2699.
[59] Owens-Grillo JK, Stancato LF, Hoffmann K, Pratt WB, Krishna P. Binding of immunophilins to the 90 kDa heat shock protein (hsp90) via a tetratricopeptide repeat domain is a conserved protein interaction in plants. Biochemistry, 1996, 35(48): 15249–15255.
[60] Davies TH, Sánchez ER. FKBP52. Int J Biochem Cell Biol, 2005, 37(1): 42–47.
[61] Ahn JC, Kim DW, You YN, Seok MS, Park JM, Hwang H, Kim BG, Luan S, Park HS, Cho HS. Classification of rice (Oryza sativa L. Japonica nipponbare) immunophilins (FKBPs, CYPs) and expression patterns under water stress. BMC Plant Biol, 2010, 10: 253–275.
[62] Bouchard R, Bailly A, Blakeslee JJ, Oehring SC, Vincenzetti V, Lee OR, Paponov I, Palme K, Mancuso S, Murphy AS, Schulz B, Geisler M. Immunophilin-like TWISTED DWARF1 modulates auxin efflux activities of Arabidopsis P-glycoproteins. J Biol Chem, 2006, 281(41): 30603–30612.
[63] Bailly A, Sovero V, Vincenzetti V, Santelia D, Bartnik D, Koenig BW, Mancuso S, Martinoia E, Geisler M. Modulation of P-glycoproteins by auxin transport inhibitors is mediated by interaction with immunophilins. J Biol Chem, 2008, 283(31): 21817–21826.
[64] Scheidt HA, Vogel A, Eckhoff A, Koenig BW, Huster D. Solid-state NMR characterization of the putative membrane anchor of TWD1 from Arabidopsis thaliana. Eur Biophys J, 2007, 36(4–5): 393–404.
[65] Granzin J, Eckhoff A, Weiergräber OH. Crystal structure of a multi-domain immunophilin from Arabidopsis thaliana: a paradigm for regulation of plant ABC transporters. J Mol Biol, 2006, 364(4): 799–809.
[66] Park J, Song WY, Ko D, Eom Y, Hansen TH, Schiller M, Lee TG, Martinoia E, Lee Y. The phytochelatin transport-ers AtABCC1 and AtABCC2 mediate tolerance to cadmium and mercury. Plant J, 2012, 69(2): 278–288.
[67] Harrar Y, Bellec Y, Bellini C, Faure JD. Hormonal control of cell proliferation requires PASTICCINO genes. Plant Physiol, 2003, 132(3): 1217–1227.
[68] Hoekstra D, Maier O, van der Wouden JM, Slimane TA, van IJzendoorn SC. Membrane dynamics and cell polarity: the role of sphingolipids. J Lipid Res, 2003, 44(5): 869–877.
[69] Bach L, Michaelson LV, Haslam R, Bellec Y, Gissot L, Marion J, Da Costa M, Boutin JP, Miquel M, Tellier F, Domergue F, Markham JE, Beaudoin F, Napier JA, Faure JD. The very-long-chain hydroxy fatty acyl-CoA dehydratase PASTICCINO2 is essential and limiting for plant development. Proc Natl Acad Sci USA, 2008, 105(38): 14727–14731.
[70] Schubert M, Petersson UA, Haas BJ, Funk C, Schroder WP, Kieselbach T. Proteome map of the chloroplast lumen of Arabidopsis thaliana. J Biol Chem, 2002, 277(10): 8354–8365.
[71] Peltier JB, Emanuelsson O, Kalume DE, Ytterberg J, Friso G, Rudella A, Liberles DA, Soderberg L, Roepstorff P, von Heijne G, van Wijk KJ. Central functions of the lumenal and peripheral thylakoid proteome of Arabidopsis determined by experimentation and genome-wide prediction. Plant Cell, 2002, 14(1): 211–236.
[72] Shapiguzov A, Edvardsson A, Vener AV. Profound redox sensitivity of peptidyl-prolyl isomerase activity in Arabidopsis thylakoid lumen. FEBS Lett, 2006, 580(15): 3671–3676.
[73] Ingelsson B, Shapiguzov A, Kieselbach T, Vener AV. Peptidyl-prolyl isomerase activity in chloroplast thylakoid lumen is a dispensable function of immunophilins in Arabidopsis thaliana. Plant Cell Physiol, 2009, 50(10): 1801–1814.
[74] Peng LW, Fukao Y, Fujiwara M, Takami T, Shikanai T. Efficient operation of NAD(P)H dehydrogenase requires supercomplex formation with photosystem I via minor LHCI in Arabidopsis. Plant Cell, 2009, 21(11): 3623–3640.
[75] Gopalan G, He ZY, Battaile KP, Luan S, Swaminathan K. Structural comparison of oxidized and reduced FKBP13 from Arabidopsis thaliana. Proteins, 2006, 65(4): 789–795.
[76] DalCorso G, Pesaresi P, Masiero S, Aseeva E, Schunemann D, Finazzi G, Joliot P, Barbato R, Leister D. A complex containing PGRL1 and PGR5 is involved in the switch between linear and cyclic electron flow in Arabidopsis. Cell, 2008, 132(2): 273–285.
[77] Iwai M, Takizawa K, Tokutsu R, Okamuro A, Takahashi Y, Minagawa J. Isolation of the elusive supercomplex that drives cyclic electron flow in photosynthesis. Nature, 2010, 464(7292): 1210–1213.
[78] Majeran W, Zybailov B, Ytterberg AJ, Dunsmore J, Sun Q, van Wijk KJ. Consequences of C4 differentiation for chloroplast membrane proteomes in maize mesophyll and bundle sheath cells. Mol Cell Proteomics, 2008, 7(9): 1609–1638.
[79] Marivet J, Frendo P, Burkard G. DNA sequence analysis of a cyclophilin gene from maize: developmental expression and regulation by salicylic acid. Mol Gen Genet, 1995, 247(2): 222–228.
[80] Riggs DL, Cox MB, Tardif HL, Hessling M, Buchner J, Smith DF. Noncatalytic role of the FKBP52 peptidyl-prolyl isomerase domain in the regulation of steroid hormone signaling. Mol Cell Biol, 2007, 27(24): 8658–8669.
[81] Galat A. A note on clustering the functionally-related paralogues and orthologues of proteins: a case of the FK506-binding proteins (FKBPs). Comput Biol Chem, 2004, 28(2): 129–140.
[82] Lu KP, Finn G, Lee TH, Nicholson LK. Prolyl cis-trans isomerization as a molecular timer. Nat Chem Biol, 2007, 3(10): 619–629.
[83] Li L, Lou Z, Wang L. The role of FKBP5 in cancer aetiology and chemoresistance. Br J Cancer, 2011, 104(1): 19–23.
(责任编委: 陈受宜)
Structure and biological functions of plant FKBP family
Yanli Yu, Yanjiao Li, Kaiyuan Pang, Fajun Zhang, Qi Sun, Wencai Li, Zhaodong Meng
National Engineering Laboratory for Wheat and Maize, Institute of Maize, Shandong Academy of Agricultural Sciences, Jinan 250100, China
FK506-binding proteins (FKBPs) are well known as both the receptor for the immunosuppressant drug FK506 and the prolyl isomerase (PPIase) enzyme. FKBPs are widely and constitutively expressed, and highly conserved during evolution. In higher plants, FKBPs usually form a relative large and diverse family compared with that in other eukaryotes, and serve as important molecular chaperones that interact with specific protein partners to regulate a diversity of cellular processes which mainly influence the plant development and stress responding. More recently, studies discovered a series of new interacting partners of FKBPs, which implicate FKBPs in gene expression regulation and photosynthetic adaptation. This review mainly focuses on the structural characteristics, classification, and the latest discoveries in the physiological functions of FKBPs in higher plants.
FKBP; structural characteristics; biological functions; immunophilin
2013-10-12;
2013-12-09
转基因生物新品种培育科技重大专项(编号:2013ZX08003-001), 山东省自然科学基金项目(编号:ZR2013CQ036), 山东省现代农业产业技术体系建设经费(编号:SDAIT-01-022-04)和山东省农业生物资源创新利用专项资金资助
于彦丽, 博士, 副研究员, 研究方向:玉米分子育种与分子生物学。Tel: 0531-83179313; E-mail: lily_yu74@hotmail.com
孟昭东, 博士, 研究员, 研究方向:玉米遗传育种。E-mail: mengzd@saas.ac.cn
10.3724/SP.J.1005.2014.0536
时间: 2014-4-25 14:13:39
URL: http://www.cnki.net/kcms/detail/11.1913.R.20140425.1413.002.html

