槲寄生内生真菌发酵液抗肿瘤作用机制研究
缪红梅 章浙忠 骆 丰 王文文 浙江省中医院检验科 杭州 310006
槲寄生内生真菌发酵液抗肿瘤作用机制研究
缪红梅 章浙忠 骆 丰 王文文 浙江省中医院检验科 杭州 310006
目的 观察槲寄生内生真菌抗肿瘤活性菌株发酵液的抗肿瘤作用机制。方法 利用实时细胞分析系统(RT-CES)对该菌株发酵液作用于细胞群落的整体生物学功能进行实时检测,构建发酵液作用效果的“细胞指纹图谱”,推断发酵液可能的抗肿瘤作用机制;透射电镜、DNA琼脂糖凝胶电泳和流式细胞术检测该菌株发酵液诱导的肿瘤细胞凋亡作用。结果 槲寄生内生真菌发酵液具有诱导肿瘤细胞凋亡效应。结论 发酵液的抗肿瘤作用机制可能通过抑制微管解聚使肿瘤细胞有丝分裂终止,促进肿瘤细胞凋亡,或通过诱导肿瘤细胞凋亡抑制其生长,从而导致细胞死亡。
内生真菌;发酵液;抗肿瘤;细胞凋亡
恶性肿瘤是全球性的公共健康问题。21世纪初我国每年恶性肿瘤新发病例约为180~200万,死亡140~150万,为2010年我国城市居民死亡原因第1位,农村居民死亡原因第2位[1]。恶性肿瘤对人类的威胁日益突出的今天,天然抗癌药物的合成具有无法比拟的优越性,是今后研究的重点方向。内生菌长期与植物共生,通过真核细胞进行初步筛选,可能产生多种全新的生物活性物质,如抗癌活性物质。笔者利用实时细胞分析系统(RT-CES)对槲寄生内生真菌抗肿瘤活性菌株发酵液的抗肿瘤机制进行初步研究,报道如下。
1 实验材料
1.1 仪 器 超净工作台(型号:SW-CJ-1F,苏州安泰空气技术有限公司);隔水式恒温培养箱(型号:GNP-9160,上海精宏实验设备有限公司);细胞培养箱(型号:303309-1503,Thermo Electron Corporation);高速离心机(Eppendorf);流式细胞仪(Beckman,France);稳压稳流电泳仪(京市六一仪器厂DYY-6B型);96X Device(ACEA BioSciences INC,San Diego,US);透射电镜(型号:H-7650,日本HITACHI公司);LEICA超薄切片机(EM UC7);ACEA RT-CESTM分析仪(ACEA BioSciences INC,San Diego,US)。
1.2 试 剂 PBS(吉诺生物医药技术有限公司,批号100923);培养基:DMEM/RPMI 1640+10%FBS+ 1%P/S(DMEM/RPMI 1640购自Hyclone,FBS购自GIBCO,Penicillin-Streptomycin购自Hyclone);0.05%胰蛋白酶(购自吉诺生物医药技术有限公司);细胞凋亡DNA Ladder检测试剂盒(南京凯基生物科技发展有限公司);Annexin V-FITC凋亡检测试剂盒(南京凯基生物科技发展有限公司);DNA Ladder Marker(Takara宝生物工程有限公司)。
1.3 细 胞 细胞株A549:非小细胞肺癌细胞,购自美国模式菌种收集中心(ATCC)。
1.4 内生真菌发酵液的制备 摇床发酵:50mL察式液体培养基装于100mL锥形瓶中,取保种管中的菌株的菌丝接种于液体培养基中,27℃,125rpm摇床培养,第6天将发酵液-20℃保存备用。冻存3d以上解冻,将菌丝过滤,发酵液浓缩备用。
2 实验方法
2.1 RT-CES检测 从培养箱中取出细胞,用PBS液清洗2次,用0.05%胰蛋白酶溶液消化,加入培养基终止消化,将细胞连同培养液一并转移到离心管内,1000rpm离心5min,去除上清,加新的培养液到离心管内,配制成适当浓度的细胞悬液。细胞生长18~22h后,待细胞信号值达到0.5~1.0时,将细胞置于无血清培养基中进行血清饥饿,2h后加入发酵液1μL,对照加去离子水10μL,每个样品3个复孔,每隔15min检查1次,连续72h观察。
2.2 透射电镜观察发酵液处理的肿瘤细胞
2.2.1 固 定 取含10%BCS的RPMI 1640培养液培养HeLa细胞至对数期,24h后取菌株ⅠA-4-2最佳发酵时间、最佳剂量的发酵液加至细胞培养液中,待观察至具有明显使细胞变化时收集细胞,以正常肿瘤细胞作对照,两个样品在2.5%的戊二醛溶液中4℃条件下固定过夜。反复漂洗固定后,用乙醇溶液进行脱水处理。
2.2.2 切片观察 将进过渗透处理的样品分装到0.5mL的epprndorf管中包埋起来,70℃加热过夜,即得到包埋好的样品。样品在LEICA超薄切片机切片,获得50~70nm的切片,该切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色15min,即可在H-7650型透射电镜(日本HITACHI公司)中观察。
2.3 DNA琼脂糖凝胶电泳检测细胞凋亡 含10% BCS的RPMI1640培养液20mL培养HepG-2细胞至对数期,37℃,5%CO2条件培养。24h后取菌株ⅠA-4-2最佳发酵时间、最佳剂量的发酵液加至细胞培养液中,剂量分别为10、50、100、200μL,作用时间分别为4h和20h。之后用凯基细胞凋亡DNA Ladder检测试剂盒测定细胞凋亡。
2.4 流式细胞术检测细胞凋亡 含10%BCS的RPMI 1640培养液20mL培养HepG-2细胞至对数期,37℃,5%CO2条件培养。24h后取菌株ⅠA-4-2最佳发酵时间、最佳剂量的发酵液加至细胞培养液中,剂量分别为50、200μL,作用时间分别为4h和20h。之后做流式细胞仪分析细胞凋亡情况。
3 结 果
3.1 RT-CES对发酵液处理细胞检测结果 通过发酵液对A549细胞株的细胞指纹图谱构建,发现对细胞的细胞学图谱呈浓度梯度依赖。其中发酵液对A549细胞具有明显的瞬间正应激作用(见图1)。与已知作用机制小分子化合物进行图谱匹配,发酵液A549细胞动力学模型与影响细胞周期的化合物图谱具有相似性(见图2)。

图1 发酵液对A549细胞株的细胞指纹图谱

图2 已知作用机制的小分子化合物的功能标识图谱

图3 透射电镜对细胞的观察结果

图4 凋亡细胞梯状DNA条带率

图5 剂量50μL,作用时间4h
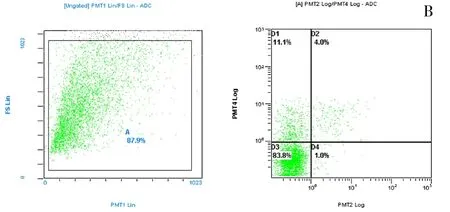
图6 剂量200μL,作用时间4h

图7 剂量50μL,作用时间20h
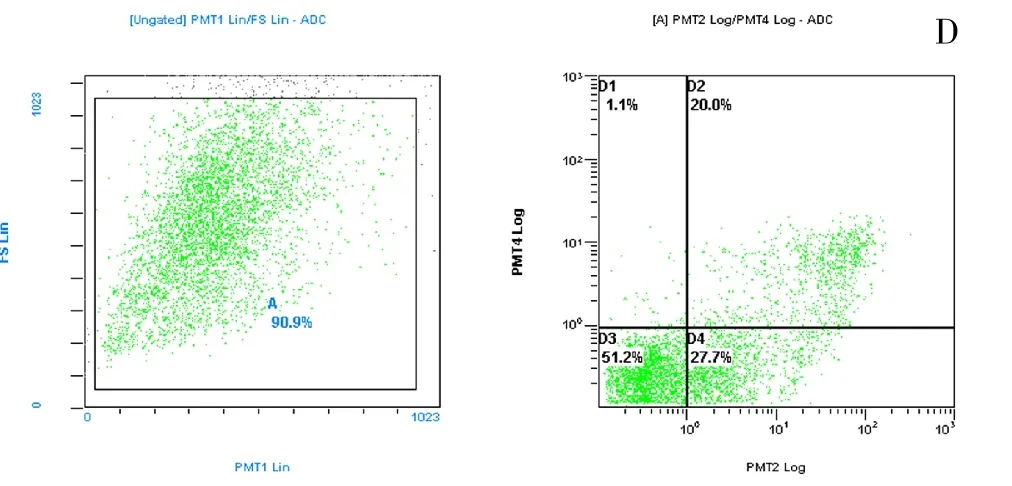
图8 剂量200μL,作用时间20h
3.2 透射电镜对调亡细胞观察结果 通过透射电镜可观察到经发酵液处理过的HepG-2细胞呈现早期凋亡特征:胞浆浓缩、成空泡状,核皱缩及碎裂,见图3(插页)。
3.3 DNA琼脂糖凝胶电泳检测凋亡细胞结果 琼脂糖凝胶电泳显示,发酵液适宜浓度作用于HepG-2细胞20h,可见凋亡细胞典型的梯状DNA条带,见图4(插页)。
3.4 流式细胞术检测凋亡细胞的结果 不同剂量的发酵液不同时间处理细胞后上机检测,结果显示,剂量50μg作用4h后,HepG-2细胞存活率为94.5%,低于空白的99.8%,剂量200μg作用4h后,HepG-2细胞存活率为83.8%,低于空白的87.9%,剂量50μg HepG-2细胞凋亡率优于剂量200μg(P<0.05);剂量剂量50μg作用20h后,HepG-2细胞存活率为87.8%,低于空白的97.5%,剂量200μg作用20h后,HepG-2细胞存活率为51.2%,低于空白的90.9%;剂量200μg HepG-2细胞凋亡率明显优于50μg剂量(P<0.05)。因此,推测细胞凋亡率与剂量和作用时间具有一定的量效时效关系,且随发酵液浓度的增加,HepG-2细胞死亡或晚期凋亡率也逐渐增加。见图5~8(插页)。
4 讨论
RT-CES系统能全面监控细胞群落,其检测结果被证明与其他传统分析得到结果一致[1-3]。RT-CES动态监测提供了许多在药物活性作用下细胞变化过程的信息,目前实时细胞电子分析技术已广泛并成功地运用于抗肿瘤药物筛选和研制[1]、抗肿瘤转移药物筛选和研究[2]、药物毒理学分析[3]、G-蛋白偶联受体相关疾病药物的筛选和研究等[4-6]。大量与医学前沿相关的课题如器官移植、恶性肿瘤防治等也都需要在细胞水平上深入研究才能得到根本性的解决[7-8]。
我们采用RT-CES系统对槲寄生内生真菌发酵液对肿瘤细胞的作用进行了初步探讨。与已知化合物功能图谱比对分析,发现该发酵液与影响细胞周期的小分子化合物的功能图谱相似,由此推断发酵液的细胞水平生物学作用机制为影响Ca2+离子通道、细胞周期或细胞凋亡;与紫杉醇的功能图谱的相似,进一步推断发酵液的抗肿瘤作用机制是通过抑制微管解聚使肿瘤细胞有丝分裂终止促进肿瘤细胞凋亡,最后导致肿瘤细胞死亡。这个推断与我们之后通过具体分析该发酵液的活性物质是小分子类物质是一致的。
肿瘤的发生不仅与细胞的异常增殖和分化有关,也与细胞凋亡的异常有关[9]。细胞凋亡是一种特殊的死亡方式,涉及一系列凋亡基因的激活、表达以及调控。生物学特征表现为一些形态学变化和生物化学变化[10]。本实验采用电镜技术对槲寄生发酵液作用HepG-2细胞进行凋亡形态学观察,可见发酵液处理组细胞胞浆浓缩、核皱缩,有空泡化现象。通过琼脂糖凝胶电泳,溴化乙锭染色呈现为梯状条带(DNA Ladder),并据此判断细胞凋亡产生。
Annexin V-FITC/PI双染色法是目前检测细胞凋亡和区分坏死细胞特异性的较好的方法[11],能比PI染色法更灵敏的检测到早期的凋亡细胞。Annexin V可与细胞凋亡早期的胞膜结合[12]。碘化丙啶(PI)能够透过凋亡中晚期的细胞和死细胞细胞膜而使细胞核染红。本研究表明,细胞凋亡率与剂量和作用时间具有一定的量效时效关系。同时我们发现随浓度的增加,死亡或晚期凋亡率也逐渐增加,表明发酵液通过诱导HepG-2细胞凋亡抑制其生长,死亡也可能于此有关,其具体机制有待进一步研究。
我们利用实时细胞分析系统(RT-CES)对菌株ⅠA-4-2的发酵液作用于细胞群落的整体生物学功能(细胞增殖、凋亡、毒性和细胞周期等)进行实时检测,从“细胞指纹图谱”中我们可以发现菌株ⅠA-4-2发酵液可能能够通过影响Ca2+离子通道、细胞周期及诱导细胞凋亡发挥药效;此外,发酵液作用与阳性药物紫杉醇的功能图谱也明显相似,进一步推断该发酵液可能还能够通过抑制微管解聚使肿瘤细胞有丝分裂终止从而促进肿瘤细胞凋亡。另外电镜观察发现,经发酵液处理后HepG-2细胞表现为核固缩、边集呈现早期凋亡特征;DNA凝胶电泳呈现为典型的梯状条带(DNA Ladder);因此,从多个角度确证发酵液具有诱导肿瘤细胞凋亡效应。通过本研究,我们推断发酵液的抗肿瘤作用机制是:通过抑制微管解聚使肿瘤细胞有丝分裂终止促进肿瘤细胞凋亡,最后导致肿瘤细胞死亡;通过诱导肿瘤细胞凋亡抑制其生长,从而导致细胞死亡。但其具体机制还有待于进一步研究。
[1]中华人民共和国国家统计局.中国统计年鉴(2011)[M].北京:中国统计出版社,2011.
[2]Atienza JM,Zhu J,Wang X.DynamicMonitoring of Cell Adhesion and Spreading on Microelectronic Sensor Arrays[J].J Biomol Screen,2005,10(8):795.
[3]Heidel JD,Liu JY,Yen Y.Potent siRNA inhibitors of ribonucleotide reductase subunit RRM2 reduce cell proliferation in vitro and in vivo[J].Clin Cancer Res,2007,13(7):2207.
[4]Glamann J,Hansen AJ.Dynamic detection of natural killer cell-mediated cytotoxicity and cell.adhesion by electrical impedance measurements[J].Assay Drug Dev Technol,2006,4(5):555.
[5]Helen Y Zou,Qiuhua Li,Joseph H.An Orally Available Small-Molec Le Inhibitor of c-Met,PF-2341066,Exhibits Cytoreductive Antitumor Efficacythrough Antiproliferative and Antiangiogenic Mechanisms[J].Cancer Res,2007,67(9):4408.
[6]Xing JZ,Zhu L,Gabos S.Microelectronic cell sensor assay for detection of cytotoxicity and prediction of acute toxicity[J].Toxicol In Vitro,2006,20(6):995.
[7]Yu N,Atienza JM,Bernard J,et al.Real-time monitoring of morphological changes in living cells by electronic cell sensor arrays:an approach to study G protein-coupled receptors[J].Anal Chem,2006,78(1):35.
[8]Xie Z,Vallender EJ,Yu N.Cloning,expression,and functional analysis of rhesus monkey trace amine-associated receptor 6:Evidence for lack of monoaminergic association[J].J Neurosci Res,2008,86(15):3435.
[9]Olsen MWB,Ley CD,Junker N.Angiopoietin-4 Inhibits angiogenesis and Reduces Interstitial Fluid Pressure[J].Neoplasia,2006,8(5):364.
[10]Li Z,Tan F,Thiele CJ.Inactivation of glycogen synthase kinase-3beta contributes to brain-derived neutrophic factor/TrkB-induced resistance to chemotherapy in neuroblastoma cells[J].Mol Cancer Ther,2007,6(12 Pt 1):3113.
[11]周柔丽.医学细胞生物学[M].北京:北京大学医学出版社,2006:14.
[12]徐先祥,戴岳,刘青云.细胞通讯与中药药理作用[J].世界科学技术—中医药现代化,2008,10(1):97.
The Mechanism Underlying the Anti-tumor Effect of Mistletoe Endophytic Fungi Fermentation Broth
MIAOHongmei,ZHANG Zhezhong,LUO Feng,WANG Wenwen. Clinical Laboratory,Zhejiang Provincial Hospital of TCM,Hangzhou(310006),China
Objective To explore the underlying mechanism of the anti-tumor effect of mistletoe endophytic fungi fermentation broth.Methods The whole biological function of the fermentation broth acting on colonies of cells was detected with real-time cell analysis system(RT-CES),and the"cell fingerprint"of the effect was structured in order to speculate the possible antitumor mechanism.At the same time,the inhibitory effect on tumor cells was observed by transmission electron microscopy,DNA agarose gel electrophoresis,and flow cytometry.Results Mistletoe endophytic fungi fermentation broth induced apoptosis of tumor cells.Conclusion The mechanism of anti-tumor effect of mistletoe endophytic fungi fermentation broth mechanism is by inhibiting microtubule depolymerization to stop the mitosis of tumor cells then promote apoptosis or by inducing apoptosis to inhibit the growth of the tumor cell,leading the tumor cell to death.
endophytic fungi;zymotic fluid;antitumor;apoptosis
2014-05-20
修回日期:2014-06-27
王文文,Tel:86-0571-86919357;E-mail:1987duckly@163.com

