灯盏花素对脓毒血症模型大鼠急性肾损伤保护作用的实验研究
杨 梅 张艳杰 朱海萍 王 丹 王晓蓉 高秋琦 李卓英 潘景业
温州医科大学附属第一医院重症医学科 温州 325000
灯盏花素对脓毒血症模型大鼠急性肾损伤保护作用的实验研究
杨 梅 张艳杰 朱海萍 王 丹 王晓蓉 高秋琦 李卓英 潘景业
温州医科大学附属第一医院重症医学科 温州 325000
目的 观察灯盏花素对脓毒血症模型大鼠急性肾损伤的保护作用。方法 清洁级Wistar雄性大鼠60只,随机分为假手术组、脓毒血症模型组和灯盏花素大、中、小剂量组,每组12只。采用盲肠结扎穿孔术(CLP)复制大鼠脓毒血症模型。灯盏花大、中、小剂量组在造模后立即分别给予灯盏花素5、10、20mg/kg尾静脉注射。术后24h处死大鼠,下腔静脉取血测定肌酐(Scr)、血尿素氮(BUN)水平,采用酶联免疫法(ELISA)测定血清中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、肾损伤分子1(KIM-1)的水平;摘取肾组织标本进行病理组织学观察,免疫印迹法检测肾脏NGAL和KIM-1蛋白含量。结果 与脓毒血症组比较,灯盏花素大、中剂量组大鼠血清Scr、BUN、NGAL和KIM-1水平及肾组织NGAL和KIM-1蛋白表达水平均显著降低(P均<0.05);肾脏病理改变好转。灯盏花素小剂量组肾脏病理改变未见好转(P>0.05)。结论 灯盏花素可以显著改善脓毒血症模型大鼠肾组织损伤,降低血清NGAL和KIM-1水平及肾组织NGAL和KIM-1蛋白表达量,对脓毒血症所致急性肾损伤具有保护作用。
大鼠;感染性休克;脓毒血症;急性肾损伤;灯盏花素;NGAL;肾损伤分子1

急性肾损伤(acute kidney injury,AKI)是由多种病因引起的短时间内(几个小时或几天)肾功能突然下降而出现的临床综合征。严重感染和感染性休克是AKI最常见发病原因之一,约占急性肾功能衰竭(acute renal failure,ARF)的50%[1]。AKI发生后,又会促进和加重其它脏器的损伤,导致MODS(多器官功能障碍综合征),增加死亡率。严重感染的患者并发ARF的病死率高达70%,明显高于其它原因所致ARF的病死率[2]。灯盏花素是灯盏花中提取而来,其有效成分是总黄酮[3],主要为灯盏乙素,也含有少量灯盏甲素。具有扩张血管、降低血液黏滞度、改善微循环、防治血栓形成的作用,在心脑血管疾病治疗中已应用多年。本研究通过建立脓毒血症大鼠模型,给予灯盏花素干预,观察其对脓毒血症急性肾损伤的保护作用。
1 实验材料
1.1 动 物 6周龄清洁级雄性Wistar大鼠,60只,体质量225g左右,由温州医学院实验动物中心提供和饲养,许可证号:SCXK(温)2013-0023。所有大鼠手术前3d单独放入代谢笼内,给予标准规格的啮齿类食物喂养,可自由饮水。喂养环境设置:12h∶12h人工白天黑夜循环,室内温度维持在(21±2)℃,湿度维持在(55±2)%。
1.2 药 物 灯盏花素注射液(规格:20mg/5mL,纯度>95%,神威药业有限公司赠送,批号Z13020778)。
1.3 试 剂 尿素氮(BUN)试剂盒(南京建成生物工程研究所,批号20130509);肌酐(Cr)试剂盒(南京建成生物工程研究所,批号20130412);中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)检测试剂盒(北京博奥森生物有限公司,批号20130510);肾损伤分子(kidney injury molecule-1,KIM-1)检测试剂盒(北京博奥森生物有限公司,批号20130301);BCA蛋白定量试剂盒(Pierce公司,批号Pierce23225,NO.126);兔抗大鼠NGAL多克隆抗体(武汉博士德公司,BA3435);兔抗大鼠KIM-1多克隆抗体(武汉博士德公司,批号BA3537)。
2 实验方法
2.1 造模及分组 大鼠按照随机数字表法随机分成假手术组、脓毒血症模型组和灯盏花素大、中、小剂量组,每组12只。灯盏花素大、中、小剂量组分别于术前及术后给予灯盏花素0.28、0.56、1.12mL尾静脉注射;假手术组及模型组术前及术后用0.5mL生理盐水静脉注射。实验前禁食过夜,自由饮水。大鼠予0.3%戊巴比妥钠(30mg/kg)腹腔注射麻醉,常规腹部碘伏消毒,备皮和铺无菌纱布洞巾。沿腹中线切开腹壁皮肤约1cm,用无菌镊探查到盲肠后用手术缝线结扎盲肠(避免结扎回肠及盲肠系膜血管),20G无菌针头分别于被结扎盲肠头尾端穿孔,然后挤压盲
2.3 统计学方法 应用SPSS17.0软件进行统计分析。计量资料用均数±标准差(±s)表示,采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05表示差异有统计学意义。
3 实验结果
3.1 各组大鼠血清Cr、BUN水平比较 术后24h,脓毒血症组大鼠Scr、BUN含量显著高于假手术组(P<0.05)。大、中、小剂量灯盏花素治疗后,大鼠Scr、BUN含量明显下降,但仍然高于假手术组(P均<0.05);灯盏花素大、中剂量组大鼠Scr、BUN含量比较差异无统计学意义(P>0.05);与脓毒血症组比较,差异有统计学意义(P<0.05);小剂量组与脓毒血症组比较,差异无统计学意义(P>0.05),见表1。
3.2 各组大鼠血清NGAL和KIM-1水平比较 与假手术组比较,脓毒血症组大鼠血清NGAL和KIM-1水平显著升高(P均<0.05);与脓毒血症组比较,灯肠,使其内容物沿穿孔部位挤出0.3mL,将盲肠和挤出内容物一起送回腹腔,逐层缝合腹壁切口。假手术组动物只进行相同的操作,不进行盲肠结扎和穿孔。
2.2 标本采集及检测 术后24h处死大鼠,收集尿液、采血、解剖肾脏去除包膜、称重、取一半肾脏组织做光镜标本,余肾组织置于冻存管中放液氮保存。
2.2.1 血肌酐(Scr)、血尿素氮(BUN)测定 血标本常温下放置1h,3000r/min分离血清,-20℃冻存待测。采用全自动多功能生化分析仪严格按照试剂盒要求进行测定。
2.2.2 肾脏病理组织学观察 取肾组织置10%甲醛固定后石蜡包埋、切片,行HE染色,光镜下观察肾组织病理改变。
2.2.3 肾脏组织NGAL和KIM-1蛋白测定 匀浆器充分研磨、匀浆肾脏髓质组织,RIRA细胞裂解液裂解,在冰上放置 30min,4℃、14 000r/min离心15min,弃沉淀,BCA法测定蛋白浓度。取蛋白质总量为30μg的蛋白,在12%的聚丙烯酰胺(SDS-PAGE)凝胶上电泳,电压150V、约70min,在4℃、250mA电流1.5h转移至PVDF膜,5%脱脂奶粉封闭1h,分别加入山羊抗大鼠NGAL和KIM-1抗体,4℃过夜,去一抗,TBST缓冲液洗3次,每次10min,再加入相应辣根过氧化物酶标记的第二抗体,室温孵育1.5h,ECL试剂显色并曝光成像,扫描图像。采用Quantity One V6.42软件分析各条带灰度值,将各目的条带灰度值与同一标本内参照β-肌动蛋白条带灰度值的比值作为该目的蛋白的半定量结果。盏花素大、中剂量组NGAL和KIM-1水平明显降低(P均<0.05),小剂量组NGAL和KIM-1水平与脓毒血症组比较,差异无统计学意义(P>0.05),见表1。
表1 各组大鼠血清肌酐、尿素氮、NGAL、KIM-1水平比较(±s)

表1 各组大鼠血清肌酐、尿素氮、NGAL、KIM-1水平比较(±s)
注:与假手术组比较,*P<0.05;与脓毒血症组比较,△P<0.05
组别假手术组脓毒血症组灯盏花素大剂量组灯盏花素中剂量组灯盏花素小剂量组n/只12 12 12 12 12肌酐/(μmol/L)34.03±3.26 54.70±5.02* 37.46±4.39*△39.49±4.28*△53.78±4.99*尿素氮/(mmol/L)8.59±0.90 26.85±4.90* 13.92±2.66*△14.15±2.71*△24.12±4.64* NGAL/(ng/mL)4.24±0.52 7.90±0.83* 5.13±0.59*△5.15±0.57*△7.88±0.81* KIM-1/(ng/L)21.76±3.59 100.30±13.28* 54.23±6.92*△53.76±6.67*△96.42±14.19*
3.3 肾脏组织病理改变 脓毒血症组大鼠肾小球皱缩明显,肾组织弥漫嗜中性粒细胞浸润,组织间隙水肿明显,球囊扩张,肾小管上皮部分管型形成,细胞空泡变性、肿胀,肾小管腔闭塞,肾小管囊腔扩张,管型形成。盏花素大、中剂量组单核—巨噬细胞浸润较脓毒血症组减轻,肾小管呈灶状损害,部分肾小管上皮浊肿、空泡变性,组织间隙水肿减轻;小剂量组与脓毒血症组病理损伤无显著差异,见图1(封三)。
3.4 各组大鼠肾脏组织NGAL和KIM-1蛋白表达量比较 与假手术组比较,脓毒血症组大鼠肾脏组织NGAL和KIM-1蛋白表达显著升高(P均<0.05);与脓毒血症组比较,灯盏花素大、中剂量组肾脏组织NGAL和KIM-1蛋白表达水平明显降低(P均<0.05),而小剂量组肾脏组织中NGAL和KIM-1蛋白表达水平与脓毒血症组比较,差异无统计学意义(P>0.05),见图2(封三),表2。
表2 各组大鼠肾组织NGAL、KIM-1表达量比较(±s)
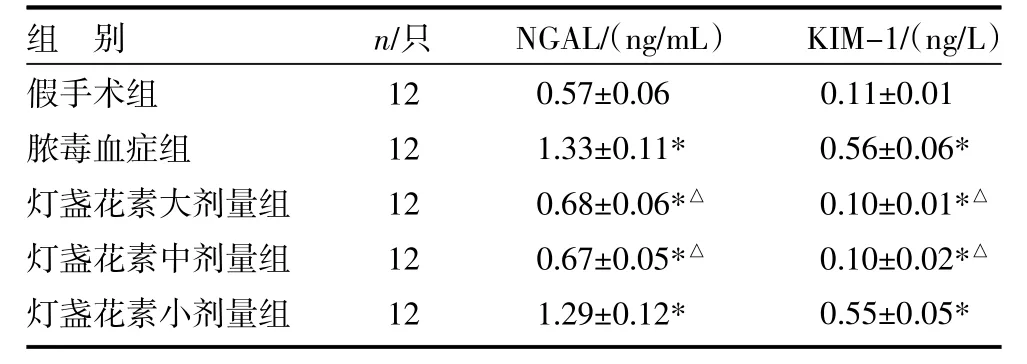
表2 各组大鼠肾组织NGAL、KIM-1表达量比较(±s)
注:与假手术组比较,*P<0.05;与脓毒血症组比较,△P<0.05
组别假手术组脓毒血症组灯盏花素大剂量组灯盏花素中剂量组灯盏花素小剂量组n/只12 12 12 12 12 NGAL/(ng/mL)0.57±0.06 1.33±0.11* 0.68±0.06*△0.67±0.05*△1.29±0.12* KIM-1/(ng/L)0.11±0.01 0.56±0.06* 0.10±0.01*△0.10±0.02*△0.55±0.05*
4 讨论
全身感染导致AKI的发病率约占全部AKI的一半[1]。严重感染患者并发急性肾功能衰竭的病死率高达70%[4-5],国内研究中严重感染患者并发急性肾功衰竭的病死率甚至高达近80%[6]。目前全球范围内对脓毒血症休克的早期治疗方法不断涌现,如早期目标指导治疗、强化血糖控制、应激剂量激素治疗、活性蛋白C的应用及集束化治疗等等[7],但临床上尚没有能够有效防治AKI和缩短自然病程的措施和方法。
药理研究证实,灯盏花素是一种较强的活血化瘀药物,可抑制血小板聚集,抑制内凝血及促进纤维蛋白原溶解,降低血黏度,改善高凝状态和血管痉挛[8];通过改善肾脏微循环而抑制肾小球系膜增殖和肾小球局灶硬化[9]。我们的研究也发现灯盏花素可减轻输尿管梗阻大鼠肾脏间质纤维化[10]。
本实验发现,脓毒血症组大鼠出现明显的急性肾脏功能损伤,病理表现为肾脏水肿、肾小球皱缩明显,肾组织弥漫嗜中性粒细胞浸润,球囊扩张,肾小管上皮部分管型形成,细胞空泡变性、肿胀,肾小管腔闭塞,肾小管囊腔扩张,管型形成。同时伴随肌酐、尿素氮升高。使用灯盏花素注射液可以显著改善脓毒血症大鼠肾脏病理改变,并且显著降低血清肌酐、尿素氮水平,保护肾功能。
NGAL和KIM-1是近年发现的急性肾损伤的新的生物学标志物。NGAL是载脂蛋白家族成员,生理状态下表达于中性粒细胞、肾小管上皮细胞等[11],病理条件下由上皮细胞分泌。在寻找新型AKI标记物的研究中发现,从缺血和肾毒性小鼠模型中可以迅速检测到NGAL浓度升高[12]。临床研究证实,NGAL可以被视为评价幼儿患者行体外循环后发生AKI风险的指标[13]。目前NGAL被认为是一种早期的、灵敏的、非损伤性的反应AKI的标记物。KIM-1是肾脏近曲小管上皮细胞表达的一种跨膜蛋白,正常肾组织中表达水平极低,但在受损后再生的近曲小管上皮细胞中表达显著增强并持续到细胞损伤完全修复[14]。其具有促进上皮细胞黏附的作用,与肾损伤的严重程度相关,尿中可检测其可溶性片段[15],并且在动物实验中证实随着肾损伤的加重,KIM-1的表达具有时间依赖性[16-17]。且具有较好的敏感性和特异性[18],为一种检测肾损伤的理想生物标志物。本研究发现,造模24h后脓毒血症组大鼠血清NGAL和KIM-1水平及肾脏组织NGAL和KIM-1蛋白表达水平明显升高(P<0.05),灯盏花素注射液可明显降低脓毒血症大鼠血清NGAL和KIM-1水平及肾脏组织NGAL和KIM-1蛋白表达水平。该结果进一步证实灯盏花素注射液对脓毒血症小鼠急性肾损伤具有保护作用。
综上所述,灯盏花素注射液对脓毒血症大鼠急性肾损伤具有保护作用,从而为其应用于临床脓毒血症急性肾损伤患者的治疗提供了实验依据,其具体机制还需作进一步深入研究。
[1]Schrier RW,Wang W.Acute renal failure and sepsis[J].N Engl J Med,2004,8,351(2):159-169.
[2]Bagshaw SM,Uchino S,Bellomo R,et al.Septic acute kidney injury in critically ill patients:clinical characteristics and outcomes[J].Clin J Am Soc Nephrol,2007,2(3):431-439.
[3]周曾同.灯盏细辛研究概况[J].临床口腔医学杂志,2001,17:238-239.
[4]Srisawat N,Lawsin L,Uchino S,et al.Cost of acute renal replacement therapy in the intensive care unit:results from The Beginning and Ending Supportive Therapy for the Kidney(BEST Kidney)study[J].Crit Care,2010,14(2):R46.
[5]Lameire N,Van Biesen W,Vanholder R.Acute renal failure[J].Lancet,2005,365(9457):417-430.
[6]杨荣利.感染性休克所致急性肾损伤的临床和实验研究[D].中国协和医科大学博士论文,2008.
[7]Dellinger RP,Levy MM,Carlet JM,et al.Surviving Sepsis Campaign:international guidelines for management of severe sepsis and septic shock:2008[J].Crit Care Med,2008,36(1):296-327.
[8]石森林,张韩清,储利胜.灯盏花素不同途径给药对大鼠实验性脑缺血防治作用的比较研究[J].中草药,2009,2(40):274-276.
[9]史冀华,王海溥,唐哲.灯盏花素对脑死亡巴马小型猪肾脏的保护作用[J].中华器官移植杂志,2006,12(27):755-758.
[10]杨梅,张岩,陈必成,等.灯盏花素对单侧输尿管梗阻大鼠肾间质纤维化的保护作用[J].解放军医学杂志,2009,34(10):1206-1210.
[11]Cowland JB,Srensen OE,Sehested M,et al.Neutrophil gelatinase-associated lipocalin is up-regulated in human epithelial cells by IL-1 beta,but not by TNF-alpha[J].J Immunol,2003,171(12):6630-6639.
[12]Mishra J,Ma Q,Prada A,et al.Identification of neutrophil gelatinase-associated lipocalin as a novel early urinary biomarker for ischemic renalinjury[J].J Am Soc Nephrol,2003,14(10):2534-2543.
[13]Mishra J1,Dent C,Tarabishi R,et al.Neutrophil gelatinaseassociated lipocalin(NGAL)as a biomarker for acute renal injury after cardiac surgery[J].Lancet,2005,365(9466):1231-1238.
[14]Han WK,Waikar SS,Johnson A,et al.Urinary biomarkers in the early diagnosis of acute kidney injury[J].Kidney Int,2008,73(7):863-869.
[15]Vaidya VS,Ramirez V,Ichimura T,et al.Urinary kidney injury molecule-1:a sensitive quantitative biomarker for early detection of kidney tubular injury[J].Am J Physiol Renal Physiol,2006,290(2):F517-529.
[16]Vaidya VS,Ozer JS,Dieterle F,et al.Kidney injury molecule-1 outperforms traditional biomarkers of kidney injury in preclinical biomarker qualification studies[J].Nat Biotechnol,2010,28(5):478-485.
[17]王芳,张岩,庄垟垟,等.雷帕霉素对双侧输尿管梗阻再通大鼠肾脏的保护作用[J].医学研究杂志,2013,42(3):45-49.
[18]Vaidya VS,Waikar SS,Ferguson MA,et al.Urinary biomarkers for sensitive and specific detection of acute kidney injury in humans[J].Clin Transl Sci,2008,1(3):200-208.
Protective Effects of Breviscapus on Acute Kidney Injury in Rats with Sepsis
YANG Mei,ZHANG Yanjie,ZHU Haiping,WANG Dan,WANG Xiaorong,GAO Qiuqi,LI Zhuoying,PAN Jingye. Intensive Care Unit,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou(325000),China
Objective To investigate the effect of breviscapine on acute kidney injury in a rat model of sepsis. Methods Sixty male Wistar rats were randomly(random number)assigned to sham operation group(n=12),sepsis group(n=12),and sepsis treated with breviscapine groups(36 rats were divided into 3 groups according to the dose, n=12).The rat model of sepsis was established by cecal ligation and puncture(CLP).The rats were injected once a day with breviseapine i.v.(5mg/kg,10mg/kg,and 20mg/kg)after CLP were done;then the rats were killed after operations for 24 h to get blood and kidney.The levels of blood urea nitrogen(BUN)and serum creatinine(Scr)were assayed by enzymatic assays,the serum level of neutrophil gelatinase associate lipoprotein(NGAL)and kidney injury molecule 1(KIM-1)was detected by ELISA,renal tissue injury was determined by HE,and the expression of NGAL and KIM-1 in kidney was detected by western blot.Results Compared with sepsis model,rats in breviscapine groups(10mg/kg and 20mg/kg)had the levels of BUN,Scr in plasma and NGAL and KIM-1 in both plasma and renal tissue decreased(all P<0.05),and improved renal pathology,but no significant improvement of renal pathology was observed in 5mg/kg breviscapine group(P>0.05).Conclusion Breviscapine can improve renal injury by reducing the level of NGAL and KIM-1 in plasma and renal tissue,thus it has protective effects on renal function in rats with sepsis.
rats;septic shock;sepsis;acute renal injury;breviscapine;NGAL;KIM-1
2014-03-28
修回日期:2014-07-15
浙江省温州市科技计划项目(No.Y20120207)
潘景业,Tel:15868724786;E-mail:biobabry@gmail.com

