m iR-203提高白血病K562细胞对熊果酸的敏感性研究
黄之虎,农朝赞,农少云,郭凌霄,李育敏,何金花,韦仕喻
(1.广西壮族自治区民族医院检验科,广西 南宁 530001;2.广东省广州市番禺区中心医院检验科,广东广州 511400)
microRNA(miRNA)是近年来发现的一类非编码单链小分子RNA。与小干扰RNA(siRNA)不同,miRNA是内源性的,它存在于真核生物中,长约19 24个碱基,与靶mRNA的3′端非编码区(3′untranslated region,3′UTR)结合,在转录后水平调控基因表达。研究表明miRNA参与调节肿瘤的发生与发展,发挥癌基因或肿瘤抑制基因的功能,近年来还发现参与肿瘤化疗的敏感性和耐药性调节。miR-203在各类白血病细胞中表达缺失或低表达,在慢性粒细胞白血病细胞株K562细胞内高表达miR-203后可抑制细胞增殖,诱导细胞凋亡[1-3]。熊果酸(ursolic acid,UA)又名乌索酸、乌苏酸、α-香树脂醇,是一种弱酸性五环三萜类化合物,具有抗炎、降血脂等作用。近年来,熊果酸的抗肿瘤活性一直倍受科学界关注,已在多种肿瘤细胞实验中发现其抗肿瘤作用。张秋萍等[4]研究发现熊果酸具有促进K562细胞凋亡的作用。本实验旨在研究miR-203与熊果酸联合应用于K562细胞的作用效果及可能的分子机制。
1 材料与方法
1.1 材料慢性粒细胞白血病细胞株K562细胞由本实验室保存。miR-203真核表达载体(PmiR-203)由广州市番禺区中心医院检验科提供,构建方法见文献[5]。熊果酸购自Sigma公司。DMEM/F12培养基和胎牛血清购自Gibco公司。脂质体LipofectamineTM2000购自Invitrogen公司。MTT和DMSO购自Sigma公司。Annexin V/PI双染试剂盒购自美国BD公司。BCA蛋白浓度定量试剂盒购自博奥森生物公司。鼠抗人β-actin抗体购自博士德生物公司。鼠抗人 bcr/abl抗体购自 Abcam公司。ECL试剂盒购自碧云天生物技术研究所。
1.2 方法
1.2.1 细胞培养 将K562细胞接种于体积分数为0.10胎牛血清和无抗生素的DMEM/F12培养基,于37℃、体积分数为0.05的CO2培养箱中饱和湿度下培养。每2~3天传代一次。
1.2.2 MTT法检测细胞增殖抑制率 实验分为空白对照组、随机对照组、PmiR-203组、熊果酸组、熊果酸联合随机对照组和熊果酸联合PmiR-203组。PmiR-203质粒DNA和随机对照质粒DNA的转染终浓度均为0.05 mg·L-1。熊果酸浓度分别为10、20、30、40及 50μmol·L-1。将 K562细胞接种于96孔板,转染方法参照脂质体说明书。转染6 h后,加入体积分数为0.20胎牛血清培养基。培养48 h后,加入MTT液继续培养4 h,离心弃上清,加入DMSO检测,并计算增殖抑制率和IC50。增殖抑制率/% =[A(对照组)-A(实验组)]/A(对照组)×100%。增敏倍数=单纯药物组的IC50/联合用药组的IC50。采用金正均Q值法分析PmiR-203与熊果酸联合用药的效果。计算公式为Q=Ea+b/(Ea+Eb-Ea×Eb),Ea代表单用PmiR-203的抑制率,Eb代表单用熊果酸的抑制率,Ea+b代表两者联合用药的抑制率。Q<0.85表示为拮抗,0.85≤Q<1.15表示为相加,Q≥1.15表示为协同[6]。
1.2.3 Annexin V/PI双染检测细胞早期凋亡率
实验分组同前。PmiR-203质粒DNA和随机对照质粒DNA的转染终浓度为0.05 mg·L-1,熊果酸浓度为40μmol·L-1。将K562细胞接种于24孔板,转染方法参照脂质体说明书。转染6 h后,加入体积分数为0.20胎牛血清培养基。培养48 h后收集各组细胞,用PBS洗3次,按Annexin V-PI双染试剂盒说明书加入Annexin V和PI染液,流式细胞仪检测。
1.2.4 Western blot检测 K562细胞内 bcr/abl蛋白表达水平 实验分组及转染方法同前。48 h后收集细胞提取蛋白。按BCA蛋白定量试剂盒说明书操作,进行蛋白定量分析。将蛋白样品和样品溶解液置沸水中煮5 min后,进行不连续的聚丙烯酰胺凝胶电泳,电压80 V,进入分离胶后调整电压为120 V,40 min。采用半干式转膜法将凝胶上的蛋白条带转到硝酸纤维膜上,电压15 V,18 min。用TBST洗膜5 min后,于体积分数为0.05牛血清白蛋白缓冲液中室温封闭1 h。用TBST洗膜3次,每次5 min,于4℃过夜孵育一抗。用TBST洗膜3次,每次5 min,于37℃孵育二抗1 h。用TBST洗膜3次,每次5 min,ECL显影。
1.2.5 统计学处理 采用SPSS 13.0统计软件进行数据处理,完全随机设计的单因素方差分析法(one-way ANOVA)分析各组数据间差异的显著性。数据用±s表示。
2 结果
2.1 P m iR-203与熊果酸联合使用对K562细胞的增殖活性影响单纯使用熊果酸的IC50为47.6 μmol·L-1;熊果酸与随机对照质粒联合使用后的IC50为44.3μmol·L-1;熊果酸与PmiR-203联合使用后的 IC50为30.7μmol·L-1,表现为协同作用(Q≥1.15),增敏倍数为 1.55(Tab 1)。
Tab 1 Inhibition rate of K 562 cells after treatment with UA in combination with P m iR-203(±s,n=4)

Tab 1 Inhibition rate of K 562 cells after treatment with UA in combination with P m iR-203(±s,n=4)
The concentrationof P miR-203 in allgroups is0.05mg·L-1,*P<0.05 vs UAgroup
UA/μmol·L-1 UA inhibition rate/%UA+negative control UA+PmiR-203 inhibition rate/% Q inhibition rate/% Q 0 5.6±2.7 19.1±2.7 10 11.9±3.6 15.8±4.5 0.92 28.1±5.3*0.98 20 16.8±3.3 22.1±2.0 1.02 35.1±3.4*1.07 30 23.9±4.8 31.1±3.3 1.09 50.4±5.4*1.31 40 37.7±4.9 42.6±7.0 1.03 61.5±4.5*1.24 50 54.5±3.6 61.9±5.1 1.08 73.8±4.0*1.17
2.2 P m iR-203与熊果酸联合使用对K562细胞凋亡的影响Annexin V/PI双染检测结果显示,与随机对照组相比,PmiR-203组和熊果酸组细胞早期凋亡率增加(P<0.05)。与熊果酸组相比,PmiR-203联合熊果酸组的细胞早期凋亡率增加(P<0.05)(Fig 1)。
2.3Pm iR-203对细胞内 bcr/abl蛋白表达水平的影响Western blot检测结果表明,转染PmiR-203可明显下调 K562细胞中 bcr/abl蛋白的表达水平(Fig 2)。
3 讨论
miRNA是近年来在真核生物中发现的一类内源性的非编码单链小分子RNA。miRNA和相应的靶mRNA的3’UTR互补,参与基因转录后负性调控。miRNA与肿瘤的关系一直是研究的热点。与正常组织相比,某些miRNA在肿瘤组织中低表达或不表达时,其可能发挥肿瘤抑制基因的作用。它们通过调控细胞增殖或凋亡相关基因的表达,参与调节肿瘤的发生与发展。由于miRNA所调控的下游靶基因数目众多,设想利用有效手段上调细胞内这些miRNA的表达水平,进而使它们所调控的下游一系列基因也发生变化,将可能改变整个基因网络的生物学功能。因此改变miRNA的表达可能是一种新的基因治疗手段。
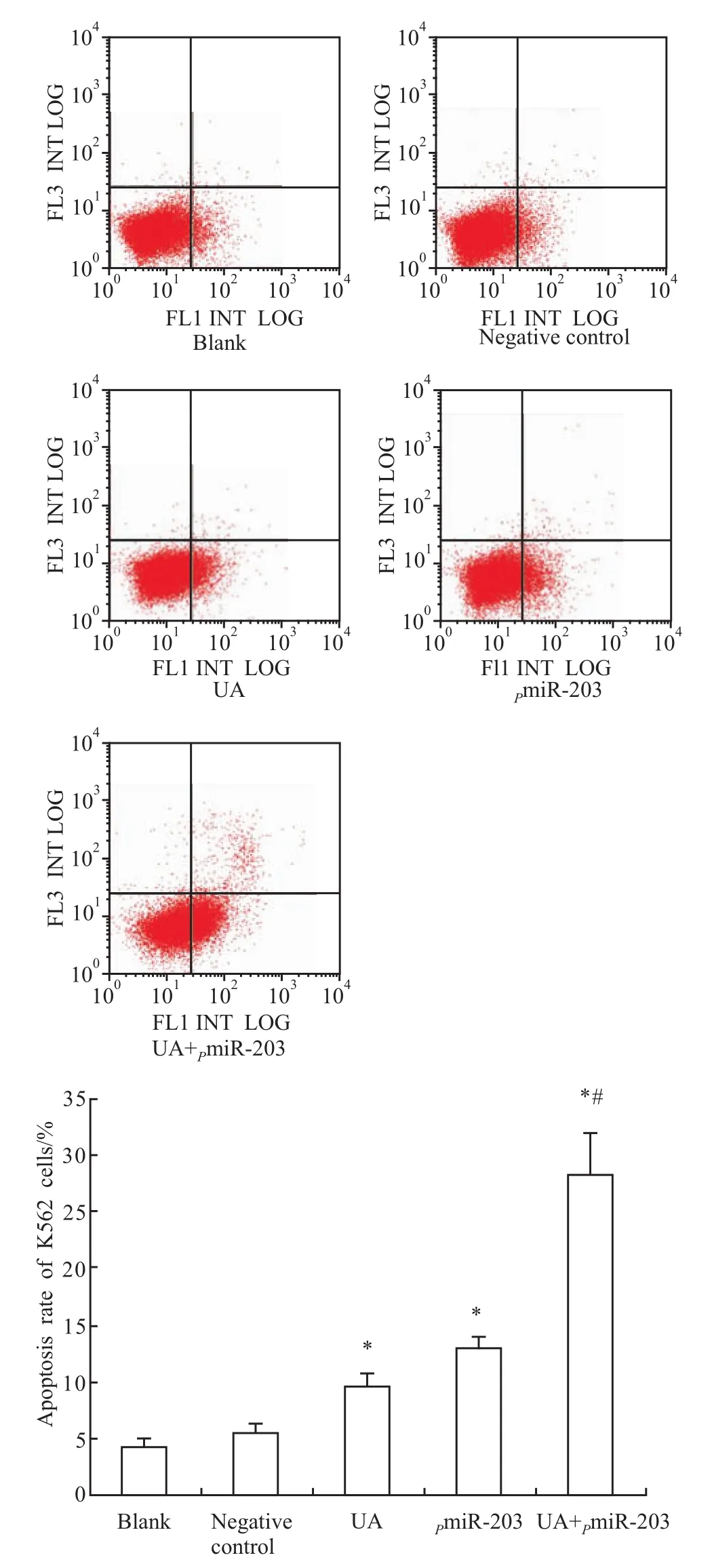
Fig 1 m iR-203 promoted the apoptosis of K 562 cells induced by UA

Fig 2 Down-regulation of bcr/abl protein by m iR-203 in K562 cells1:miR-203 group;2:Negtive control group;3:Blank control group.
研究发现miR-203在多种慢性粒细胞白血病细胞中表达缺失或低表达,在细胞内高表达miR-203后可诱导细胞凋亡[1-3]。因此靶向作用miR-203可作为抗白血病基因治疗研究的新手段。熊果酸,又名乌索酸、乌苏酸、α-香树脂醇,是一种弱酸性五环三萜类化合物,在自然界分布较广,如在陆英、枇杷叶、熊果、山楂、车前草、苦丁茶等植物中存在。熊果酸生物活性广泛,具有抗炎、降血脂、抗氧化、保肝、降血压和降血糖等方面作用。日本已经将其作为天然抗氧化剂应用于食品中。近年来大量的研究表明熊果酸具有抗肿瘤的作用。研究表明熊果酸影响细胞增殖、凋亡、周期、迁移及侵袭等一系列生物学进程,在多种肿瘤的预防及治疗中发挥极其重要的作用[7-11]。熊果酸在抗白血病方面也作用显著,能抑制白血病细胞株K562细胞及HL-60细胞增殖,诱导细胞凋亡[4,12-15]。本研究通过将 miR-203的真核表达载体(PmiR-203)转染 K562细胞,使 miR-203在细胞内高表达,与熊果酸联合作用后,IC50明显降低,敏感性提高到单独使用熊果酸的1.55倍,表现为协同作用,表明miR-203可提高熊果酸对白血病K562细胞的敏感性。PmiR-203联合熊果酸使用后细胞的早期凋亡率明显高于单独使用PmiR-203或熊果酸,表明其增敏效应可能与诱导细胞凋亡相关。
miRNA通过在转录后水平调控基因表达而发挥作用。本研究初步探讨了miR-203调控的下游基因。在慢性粒细胞白血病患者中,0.95以上的患者具有Ph染色体,形成bcr/Abl融合基因,表达具有酪氨酸激酶活性的bcr/Abl蛋白。本实验发现在慢性粒细胞白血病细胞株K562细胞中高表达miR-203后可下调bcr/Abl的表达,这提示miR-203提高熊果酸抗白血病的敏感性的作用机制可能与其调控bcr/Abl融合基因的表达相关。但是miR-203是直接调控bcr/Abl的表达还是通过调控其他相关基因而间接调控其表达还需要进一步实验证实。
目前慢性粒细胞性白血病的治疗仍主要为常规化疗,靶向bcr/Abl融合基因的药物伊马替尼治疗效果较好,但易产生耐药性。因此开发基因治疗的靶向药物仍是慢性白血病治疗研究的重要方向。本实验发现 miR-203可下调 bcr/Abl融合基因的表达,为白血病的基因治疗提供了新的实验依据。本实验将靶向miRNA技术与熊果酸联合使用,提高了慢性白血病细胞对熊果酸的敏感性,为白血病的治疗提供新的方法和思路,具有重要的理论意义和潜在的临床应用价值。
参考文献:
[1]Chim C S,Wong K Y,Leung C Y,et al.Epigenetic inactivation of the hsa-miR-203 in haematologicalmalignancies[J].JCellMol Med,2011,15:1582-934.
[2]Bueno M J,Pérez de Castro I,Gómez de cedrón M,etal.Genetic and epigenetic silencing ofmicroRNA-203 enhances ABL1 and BCR-ABL1 oncogene expression[J].Cancer Cell,2008,13(6):496-506.
[3]Faber J,Gregory R I,Armstrong SA.LinkingmiRNA regulation to BCR-ABL expression:the next dimension[J].Cancer Cell,2008,13(6):467-9.
[4]张秋萍,谢路现,邓 涛,等.熊果酸促进 K562细胞凋亡[J].基础医学与临床,2004,24(4):414-7.
[4]Zhang Q P,Xie L X,Deng T,et al.Effectof ursolic acid on apoptosis in K562 cells.[J].Basic Med Sci Clin,2004,24(4):414-7.
[5]何金花,黎毓光,谢杏仪,等.hsa-miR-203真核表达载体的构建及对K562细胞增殖与凋亡的影响[J].临床检验杂志,2012,30(8):595-8.
[5]He J,Li YG,Xie X Y,etal.Effectof eukaryotic expression vector of hsa-miR-203 on proliferation and apoptosis in K562 cells.[J].Chin JClin Lab Sci,2012,30(8):595-8.
[6]金正均.合并用药中的相加[J].中国药理学通报,1985,1(2):70-1.
[6]Jin Z J.Addition in drug combination[J].Chin Pharmacol Bull,1985,1(2):70-1.
[7]Hsu Y L,Kuo P L,Lin C C,et al.Proliferative inhibition,cellcycle dysregulation,and induction of apoptosis by ursolic acid in human non-small cell lung cancer A549 cell[J].Life Sci,2004,75(19):2303.
[8]Kondo M,Mackinnon S L,Craft CC,et al.Ursolic acid and its esters:occurrence in cranberries and other vaccinium fruit and effects onmatrixmetalloproteinase activity in DU145 prostate tumor cells[J].JSci Food Agric,2011,91(5):789-96.
[9]Wu H Y,Chang C I,Lin BW,et al.Suppression of hepatitis B virus x protein-mediated tumorigenic effects by ursolic Acid[J].J Agric Food Chem,2011,59(5):1713-22.
[10]于丽波,王 晶,马宝璋,等.酸果酸对卵巢癌细胞HO-8910PM侵袭转移的影响[J].四川大学学报,2010,41(6):986-8.
[10]Yu L B,Wang J,Ma B Z,etal.Inhibitive effectof ursolic acid on the invasion and metastasis of ovarian carcinoma cells HO-8910PM[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2010,41(6):986-8.
[11]Limami Y,Pinon A,Leger D Y,et al.HT-29 colorectal cancer cells undergoing apoptosis overexpress COX-2 to delay ursolic acidinduced cell death[J].Biochimie,2011,93(4):749-57.
[12]黄 镜,孙 燕,陆士新,等.芦荟有效成分熊果酸诱导HL60细胞凋亡的实验研究[J].中国中西医结合杂志,1999,19(5):296-8.
[12]Huang J,Sun Y,Lu SX,et al.Experimental study on apoptosis induced by ursolic acid isolated from asparagus in HL 60 cells[J].Chin J Integr Med,1999,19(5):296-8.
[13]Arendds M J,Wyllie A H.Apoptosis:Mechanisms and roles in pathology[J].Inv Rev Exp Path,1991,32:233-4.
[14]Barry M A,Behnek C A,Eastman A.Activation of programmed cell death(apoptosis)by cisplatin,or her anticancer drugs,toxins and hyperthermia[J].Biochem Pharmacol,1990,40(10):2353-62.
[15]Baek JH,Lee Y S,Kang CM,et al.intracellular Ca2+release mediates ursolic acid-induced apoptosis in human leukemic HL 60 cells[J].Int JCancer,1997,73(5):725-8.

