微透析与LC-MSn联用测定脑组织中咪达唑仑/1′-羟基咪达唑仑及其脑内药代特征的研究
何雪辉,杨志宏,孙晓波
细胞色素 P450(cytochrome P450,CYP450)是体内重要的I相代谢酶,参与众多内外源性化合物的代谢。CYP450在体内分布广泛,研究发现大脑中存在少量的CYP450,约是肝脏CYP450的0.5~2%[1]。虽然大脑中CYP450酶的含量远低于肝脏,但脑内CYP450酶活性或表达的小幅度变化,可能明显影响脑内环境下中枢药物的代谢、脑部内环境稳定及脑组织功能。CYP3A亚族是CYP450的重要成员,约占CYP450酶系的30%,临床上约60%药物是经CYP3A代谢的[2]。脑部CYP3A主要分布在神经元、神经胶质细胞和脑微血管内皮细胞上[3],对脑内药物的生物转化过程起重要作用;同时,药物同样能够影响脑部CYP3A的活性和表达。例如抗抑郁药阿普唑仑[4]、抗癫痫药物苯妥英钠和卡马西平[5]。因此,进行脑CYP3A和药物脑内药代特征的研究对中枢神经系统药物的开发和临床用药指导具有重要价值。
微透析技术(microdialysis,MD)是一种在线活体取样技术,在脑内药物代谢动力学研究中具有重要应用,如脑内药物转运、脑靶向分布研究等。咪达唑仑(midazolam,MDZ)几乎全部经CYP3A代谢,是2006年以来FDA药物相互作用研究指南中的推荐探针[6],广泛用于体内及体外CYP3A酶研究。其主要代谢产物为 1′-羟基咪达唑仑(1′-hydroxymidazolam,1′-OH MDZ)。MDZ作为非 P-糖蛋白底物,脂溶性强,易于跨越血脑屏障,其清除主要与CYP3A活性有关。本实验将采用 MD技术研究 MDZ/1′-OH MDZ的脑内药代特征。由于脑中CYP450酶的含量较低,因此开发灵敏度高、准确稳定的LC-MSn检测方法尤为关键。MDZ/1′-OH MDZ的 LC-MSn测定方法已有报道,本文对已有方法进行改进,提升灵敏度、缩短检测分析时间,以满足脑CYP3A酶研究的需求。
1 材料
1.1 仪器 Agilent 1200液相色谱仪(美国Agilent公司);3200 QTrap串联四极杆线性离子阱质谱仪(美国AB SCIEX公司),Turbo Ionspray离子源,Analyst 1.6数据处理系统;脑立体定位仪(美国Stoeling公司),微透析系统(瑞典 CMA公司),MAB6.14.4同心圆型脑微透析探针(截留分子量15 ku,瑞典MAB公司)。
1.2 药品与试剂 MDZ、1′-OH MDZ对照品购自美国 Cerilliant公司,批号分别为 FE042209-01和FD050034-02;咪达唑仑注射液购自江苏恩华药业股份有限公司,批号为20130502;地西泮(diazepam,DZP)对照品购自中国食品药品检定研究院,批号100364-200301。乙腈(色谱纯)购自美国Honeywell公司,乙酸铵购自Dikmapure公司,实验用水为超纯水。微透析液为人工脑脊液(artificial cerebrospinal fluid,aCSF):NaCl 147 mmol·L-1、KCl 2.7 mmol·L-1、CaCl21.2 mmol·L-1、MgCl20.85 mmol·L-1,调节pH在7.20~7.40。
1.3 动物 SPF级健康♂ SD大鼠4只,体质量(270±10)g,由北京维通利华实验动物技术有限公司提供,合格证号SCXK(京)2012-0001。
2 方法和结果
2.1 溶液的配置 对照品溶液的制备:将MDZ和1′-OH MDZ对照品分别用适量甲醇稀释成1 mg·L-1的标准溶液。用 aCSF分别稀释 MDZ和1′-OH MDZ标准溶液,制备二者工作曲线。MDZ浓度为0.78、1.56、3.125、6.25、12.5、25、50、100μg·L-1;1′-OHMDZ浓度为 0.195、0.39、0.78、1.56、3.125、6.25、12.5μg·L-1。
IS溶液的制备:精密称取DZP对照品1 mg,置于1 ml甲醇中,配制成1 g·L-1溶液作为贮备液(于4℃下避光保存)。用aCSF稀释成30μg·L-1的内标溶液。
静脉注射用MDZ溶液的配制:以生理盐水稀释MDZ注射液,配制成2.5 g·L-1药液。
2.2 测定条件 色谱条件:Agilent Eclipse Plus-C18色谱柱(2.1 mm×50 mm,3.5μm);流动相A水(2 mmol·L-1乙酸铵),B乙腈,梯度洗脱(0~0.2 min,乙腈30%~95%;0.2~5 min,95%乙腈,流速0.3 ml·min-1;进样量 8μl;柱温 30℃。质谱参数:电喷雾离子化(ESI);离子极性 Positive;多反应离子监测(MRM);离子喷雾电压(5500 V);离子源温度(400℃);气帘气压力(40 psi);MDZ m/z:326.1/291.1;1′-OH MDZ m/z:342.1/324.1;DZP(IS)m/z:285.1/154.0。
2.3 微透析样品处理 取微透析样品16μl,加入8μl的地西泮(30μg·L-1),混匀,取 8μl直接在线进样。
2.4 专属性考察 将空白aCSF溶液及微透析样品进行LC-MSn检测。本实验条件下,MDZ、1′-OH MDZ及内标DZP色谱峰形良好且无干扰。结果如Fig 1,2所示,本方法具有较好的专属性。
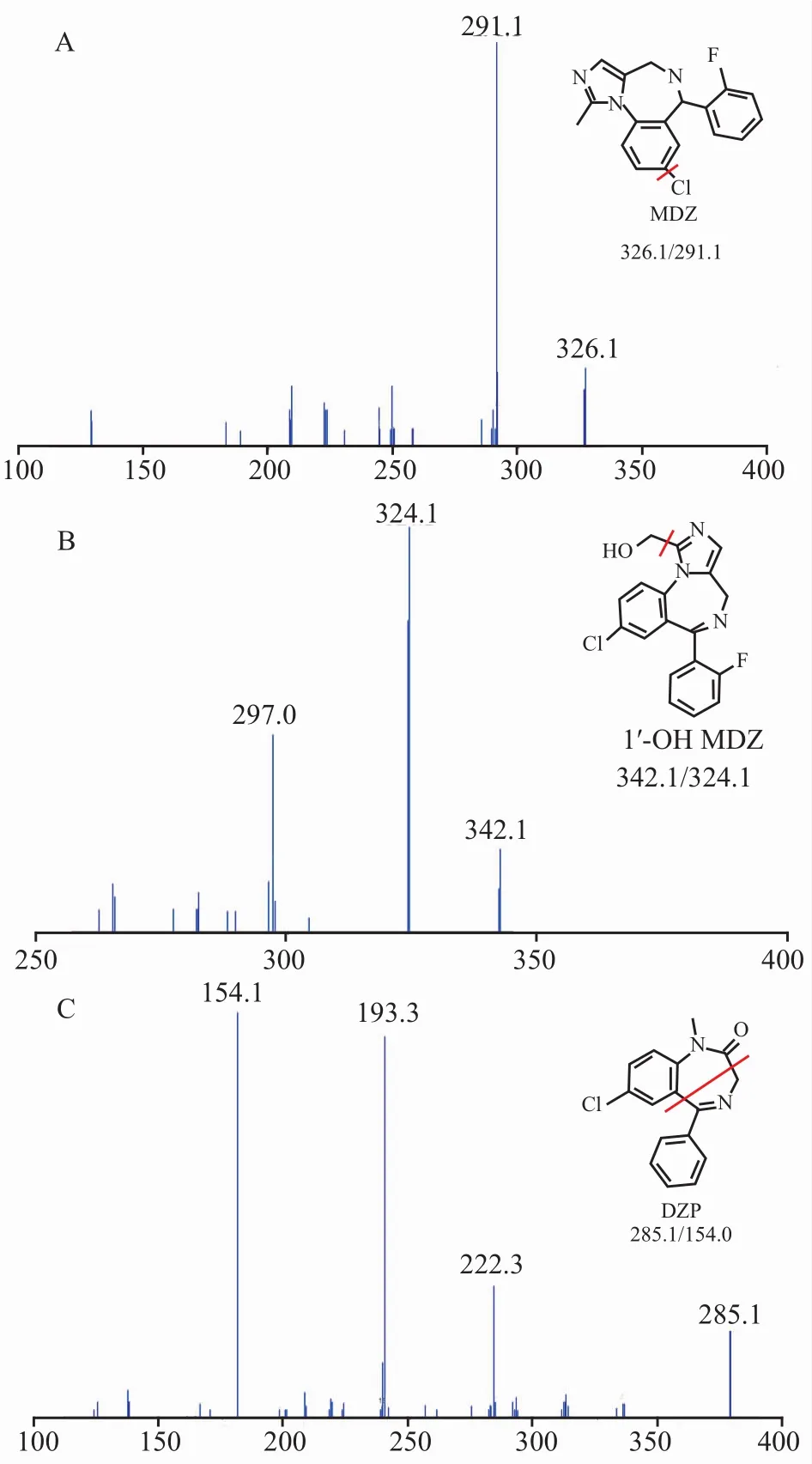
Fig 1 Full-scan mass spectra of MDZ(A),1′-OH MDZ(B)and IS(C)
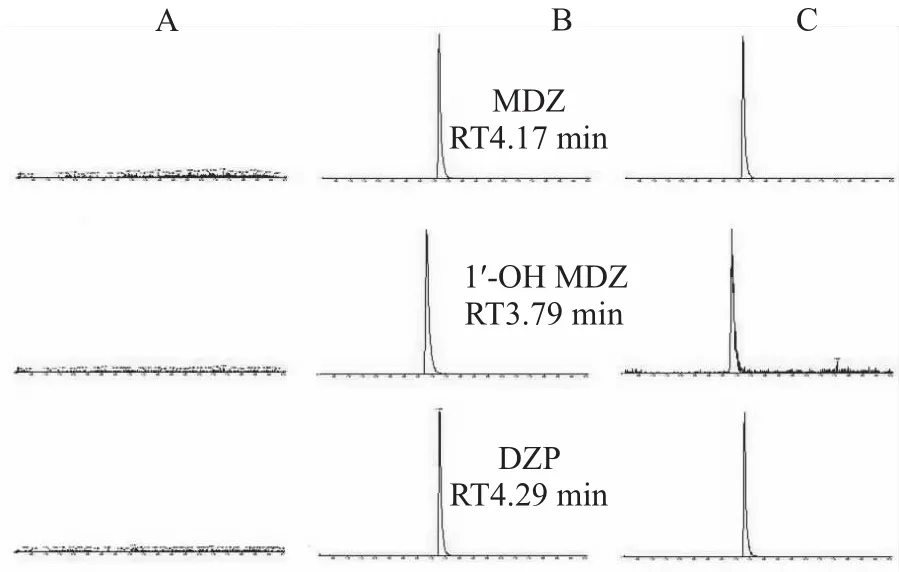
Fig 2 MRM chromatograms of MDZ,1′-OH MDZ and IS
2.5 线性关系及最低定量限 如“2.1”项制备MDZ和1′-OH MDZ的工作曲线,按微透析样品处理方法处理进样。利用样品与内标峰面积比值Y对样品质量浓度X(μg·L-1)做权重为X-2的线性回归,计算回归方程及相关系数(r)。所得回归方程^YMDZ=0.02320X+0.00318(r=0.9976),^Y1′-OHMDZ=0.1101X-0.007137(r=0.9993)。以 S/N=10为最低定量限,MDZ及1′-OH MDZ的最低定量限为0.2μg·L-1。
2.6 精密度和准确度 取低、中、高浓度为1.56、6.25、50μg·L-1的 MDZ对照品工作液;低、中、高浓度为 0.39、1.56、6.25μg·L-1的 1′-OH MDZ对照品工作液。考察批内变异和连续3 d的批间变异情况。结果见Tab 1,测得MDZ及1′-OH MDZ的批内和批间RSD、RE均小于10%。
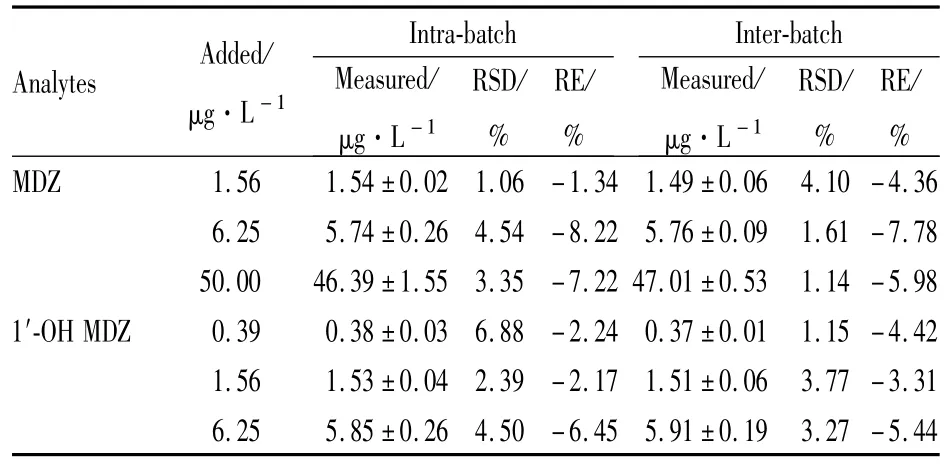
Tab 1 Precision and accuracy of MDZ and 1′-OH MDZ(¯x±s,n=5)
2.7 稳定性 取低、中、高浓度为1.56、6.25、50μg·L-1的 MDZ对照品工作液,低、中、高浓度为0.39、1.56、6.25μg·L-1的 1′-OH MDZ对照品工作液。每个浓度5个样品。①放置-20℃冰箱保存1周,取出后室温融解,按“2.3”项处理样品,测定药物浓度。②4℃放置12 h后进样,测定药物浓度。测得 MDZ、1′-OH MDZ的 RE值分别在 -9.86%~5.47%、-9.50%~-6.65%范围内,RSD值在2.60%~6.02%、2.18%~6.15%范围内。结果表明,MDZ和1′-OH MDZ在-20℃保存1周及4℃放置12 h较为稳定。
2.8 方法回收率 使用空白aCSF稀释MDZ,其浓度为 1.56、6.25、50μg·L-1,空白 aCSF稀释1′-OH MDZ其浓度为0.39、1.56、6.25μg·L-1,对照品溶液在拟定分析条件下测定记录样品和IS峰的比值,带入同一条标准曲线,计算相应浓度后除以真实样品浓度。测得MDZ、1′-OH MDZ方法回收率分别在91.78%~98.67%、93.55%~98.18%范围内。
2.9 基质效应 分别使用空白aCSF、纯水稀释MDZ对照品溶液,其浓度为 1.56、6.25、50μg·L-1;分别使用空白 aCSF、纯水稀释 1′-OH MDZ对照品溶液,其浓度为 0.39、1.56、6.25μg·L-1,按“2.3”项处理样品,进样。记录峰面积比A1/A2。测得结果A1/A2的值在90.09% ~109.14%之间,表明MDZ和1′-OH MDZ基本无基质效应。
3 药动学研究
3.1 微透析样品采集 大鼠腹腔注射乌拉坦(1.2 g·kg-1)麻醉后采用脑立体定位仪固定大鼠头部,探针植入左侧侧脑室(定位 AP:-0.8 mm,ML:-1.6 mm,DV:-2.0 mm)。探针在2μl·min-1流速下体内平衡1 h后,股静脉注射 MDZ(5 mg·kg-1),持续收集大脑的微透析样品2.4 h,收集时间间隔为 8 min。LC-MSn方法检测 MDZ和 1′-OH MDZ浓度。
3.2 探针回收率测定 采用增量法在37℃水浴条件以相同的流速、时间间隔测定MDZ和1′-OH MDZ脑微透析探针回收率。Cm代表已知浓度的对照品溶液,Cdial代表微透析样品。根据公式R=Cdial/Cm计算探针回收率 RMDZ=(19.93±2.35)%、R1′-OHMDZ=(21.83±2.62)% 。
3.3 数据处理 通过探针回收率分别将MDZ和1′-OH MDZ折算为脑内真实浓度,绘制药时曲线,见Fig 3。采用WinNonlin 6.1软件以统计矩方法计算其主要的代谢动力学参数:消除速率常数(K e)、半衰期(T12)、表观分布容积(Vd-F)、消除率(CLF)、药时曲线下面积(AUC)和平均滞留时间(MRT),结果见 Tab 2。
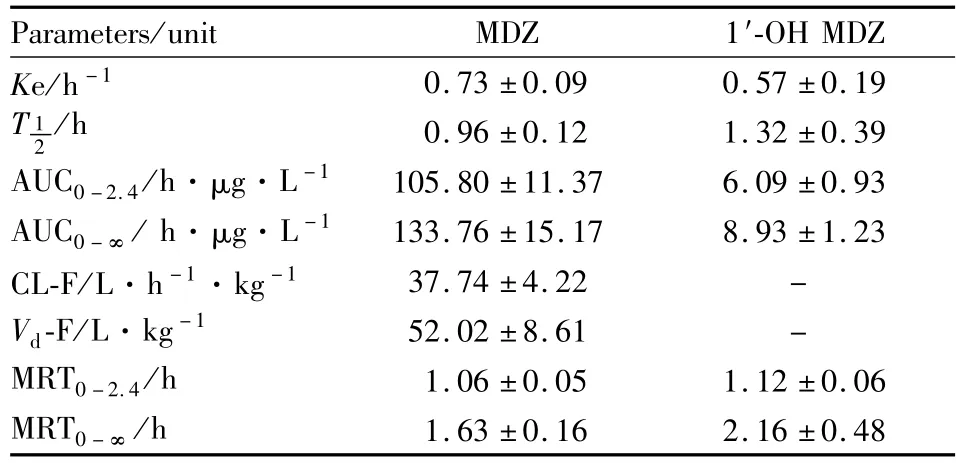
Tab 2 Pharmacokinetic parameters of MDZ and 1′-OH MDZ in rat brain(¯x±s,n=4)
4 讨论
4.1 脑代谢 脑代谢研究在中枢神经系统药物的开发、临床用药指导及个体化给药方案中具有重要地位。由于代谢酶的含量及种类具有组织特异性,药物在脑局部与肝脏的代谢行为可能具有明显差异。抗抑郁药阿普唑仑在大脑主要代谢成药理活性较强的α-羟基阿普唑仑;在肝脏中主要代谢产物则为4-羟基阿普唑仑[4],研究发现造成此现象的主要原因是代谢酶CYP3A43在脑中表达较高。
MDZ已经广泛用于体内及体外CYP3A酶研究,但是其在大鼠脑内药代特征未见报道,此次MDZ/1′-OH MDZ大鼠脑内药代参数为国内外首次报道。
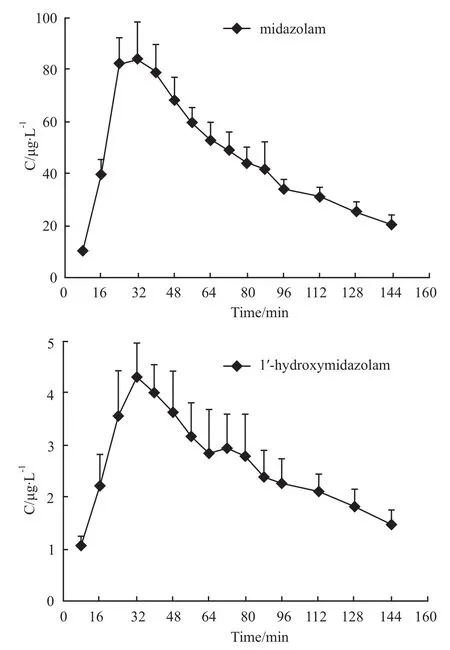
Fig 3 Concentration-time curve of MDZ and1′-OH MDZ in brain after iv administration of MDZ(n=4)
4.2 微透析取样方式 脑内药代动力学的研究方式主要包括全脑匀浆法[7]、脑脊液抽取法[8]和微透析法[9]。与其他方法相比,微透析技术对实验动物伤害较小,能够连续取样,动态监测脑内游离药物浓度。此外微透析样品较为洁净不需要进行样品前处理,与HPLC、LC-MSn等技术联用,可实现样品的实时、连续、在线检测,因此微透析技术是研究脑代谢的重要、有效手段。
4.3 LC-MSn条件优化 本实验采用MRM扫描方式,选择正离子模式[M+H]+,待测物及IS的离子响应较好,且信号稳定。在流动相方面,由于MDZ/1′-OH MDZ具有一定脂溶性,并且呈弱碱性,对酸敏感,在酸性条件下易出现双峰现象,因此选择乙腈和含有2 mmol·L-1乙酸铵水作为流动相。采用梯度洗脱方式,MDZ/1′-OH MDZ峰形较好,在 5 min内即可完成一次MDZ/1′-OH MDZ的分析,并且最低定量限达0.2μg·L-1。
4.4 MDZ剂量选择 MDZ作为CYP3A的探针药物,静脉注射给药剂量范围为 0.5~10 mg·kg-1[10-13],前期实验发现股静脉注射 MDZ剂量为1、2 mg·kg-1时,微透析液中只可检测到 MDZ;MDZ注射剂量为5、10 mg·kg-1时,微透析液中可同时检测到MDZ和1′-OH MDZ。由于MDZ在高剂量时具有中枢抑制作用,因此本实验最终选择注射剂量为5 mg·kg-1。通过药时曲线和药代参数分析,MDZ可迅速跨越血脑屏障,给药8 min微透析液即可检出,28 min左右脑内MDZ浓度达峰,此后迅速消除,脑内1′-OH MDZ/MDZ转化率约为5.75%。
此LC-MSn方法快速、灵敏,准确,结合微透析技术研究大鼠脑内MDZ/1′-OH MDZ药代动力学特征,其脑内药代参数为国内外首次报道,为深入进行脑部代谢酶CYP3A以及药物脑部代谢的相关研究奠定基础。
参考文献:
[1] Ferguson C S,Tyndale R F.Cytochrome P450 enzymes in the brain:emerging evidence of biological significance[J].Trends Pharmacol Sci,2011,32(12):708-14.
[2] 李 蒙,朱传江.CYP3A4高表达细胞模型及其应用于药物代谢研究进展 [J].中国药理学通报,2012,28(1):16-9.
[2] Li M,Zhu C J.Advances in CYP3A4 over-expressed cell models and their application to drug metabolism research[J].Chin Pharmacol Bull,2012,28(1):16-9.
[3] Woodland C,Huang T T,Gryz E,et al.Expression,activity and regulation of CYP3A in human and rodent brain[J].Drug Metab Rev,2008,40(1):149-68.
[4] Agarwal V,Kommaddi R P,Valli K,et al.Drug metabolism in human brain:high levels of cytochrome P4503A43 in brain and metabolism of anti-anxiety drug alprazolam to its active metabolite[J].PLoSOne,2008,3(6):e2337.
[5] Killer N,Hock M,Gehlhaus M,et al.Modulation of androgen and estrogen receptor expression by antiepileptic drugs and steroids in hippocampus of patients with temporal lobe epilepsy[J].Epilepsia,2009,50(8):1875-90.
[6] Food and Drug Administration.Guidance for industry:drug interaction studies:study design,data analysis and recommendations for dosing and labeling recommendations(Draft Guidance)[EB/OL].(2006-10-16)[2013-11-01]http://www.tebu-bio.com/upload/cms/FDADraftDDI_guidance_2006.pdf.
[7] Bera R,Ahmed SK,Sarkar L,et al.Pharmacokinetic analysis and tissue distribution of andrographolide in rat by a validated LCMS/MSmethod[J].Pharm Biol,2014,52(3):321-9.
[8] 杨雁芳,李 智,王 磊,等.黄芩苷及三七总皂苷配伍脑脊液药代动力学研究 [J].中国药理学通报,2012,28(7):1005-10.
[8] Yang Y F,Li Z,Wang L,et al.Pharmacokinetic studies of baicalin and compatibility of baicalin-Panax Notoginsenosides in rat cerebrospinal fluid[J].Chin Pharmacol Bull,2012,28(7):1005-10.
[9] 张群林,张云静,吴 亮,等.微透析-液相色谱-化学发光法测定大鼠脑组织中丹参酚类化合物浓度及其药代动力学研究 [J].中国药理学通报,2010,26(9):1230-7.
[9] Zhang Q L,Zhang Y J,Wu L,et al.Determination of phenolic compounds of Salvia miltiorrhiza in rat brain by liquid chromatography with chemiluminescence detection using microdialysis sampling and application to pharmacokinetic study[J].Chin Pharmacol Bull,2010,26(9):1230-7.
[10]陈 烨,袁 瑾,王新宏,等.葛根芩连汤及不同配伍对肝细胞色素450酶的影响 [J].中成药,2013,35(8):1593-8.
[10]Chen Y,Yuan J,Wang X H,et al.Effect of gegen qinlin decoction and different synergies on liver CYP450 isofoems[J].Chin Tradit Patent Med,2013,35(8):1593-8.
[11]Kanazu T,Sato N,Kadono K,et al.Investigation of drug-drug interaction via mechanism-based inhibition of cytochrome P450 3A by macrolides in dexamethasone-treated female rats[J].Biopharm Drug Dispos,2012,33(4):195-206.
[12]Taesotikul T,Nakajima M,Tassaneeyakul W,Yokoi T.Effects of Phyllanthus amarus on the pharmacokinetics of midazolam and cytochrome P450 activities in rats[J].Xenobiotica,2012,42(7):641-8.
[13]赵娜萍,余露山,曾 苏.HPLC法测定大鼠血浆中咪达唑仑的含量及其在药物相互作用研究中的应用[J].药物分析杂志,2007,27(6):821-4.
[13]Zhao N P,Yu L S,Zeng S.HPLC determintion of midazolam in rat plasma and applied toinvestigation the drug interaction[J].Chin J Pharm Anal,2007,27(6):821-4.

