灵芝多糖联合二甲双胍对2型糖尿病大鼠心肌AGEs及CTGF的影响及其机制
乔 进,窦志华,吴 锋,孟国梁,陈 惠,郑惠华
糖尿病心肌病作为糖尿病(diabetes mellitus,DM)的慢性并发症之一,是独立于心脏大血管病变的一种特异性疾病,其发病的可能机制包括代谢障碍、心肌纤维化、胰岛素抵抗及细胞因子异常[1]。心肌纤维化在糖尿病心肌病的发生发展中起着重要的作用。糖尿病状态下,由于基质的大量增生和胶原的降解异常,导致心肌间质纤维化的发生与发展。其病理学表现为心脏成纤维细胞数量的增加,心肌间质中胶原沉积增多、各型比例失调和排列紊乱[2]。灵芝多糖(GLPs)是灵芝中最有效的成分之一,一系列的研究表明灵芝多糖具有降血糖、抗氧化、抗肿瘤和免疫调节活性[3]。吴锋等[4]研究发现灵芝多糖能抑制大鼠体内氧化应激。二甲双胍(metformin,Met)为临床常用降糖药,具有明显降糖和改善胰岛素抵抗的作用,近年来研究证实了其具有一定的防治糖尿病血管并发症和保护心血管的作用[5]。它们联合应用治疗糖尿病心肌病具有某些理论上的优点,在降低血糖的同时抑制体内氧化应激水平和AGEs水平。但两种药合用的疗效是否优于单用,尚未见灵芝多糖联合二甲双胍治疗糖尿病的报道,本研究建立2型糖尿病大鼠模型,观察灵芝多糖和二甲双胍联合应用对2型糖尿病大鼠心肌AGEs和CTGF的抑制作用,并初步探讨其作用机制。
1 材料与方法
1.1 实验动物 健康SD大鼠80只,♀♂各半,体质量160~180 g,购自南通大学实验动物中心,使用许可证号:FYXK(苏)2007-0021。
1.2 药品与仪器 灵芝多糖(江苏安惠生物科技有限公司,批号:100601);二甲双胍(上海信谊天平药业有限公司,批号:67100507);链脲佐菌素(streptozotocin,STZ,Sigma公司),临用前用 0.1 mol·L-1柠檬酸缓冲液配成浓度为1%的STZ溶液;过氧化氢酶(CAT)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成生物工程研究所产品);其余试剂均为国产分析纯。即用型第2代免疫组化Elivision TM plus广谱试剂盒(福州迈新生物技术开发有限公司);兔抗AGEs、CTGF多克隆抗体(武汉博士德生物工程有限公司);BCA蛋白浓度测定试剂盒(碧云天生物技术研究所);辣根过氧化物酶(HRP)标记的羊抗兔及羊抗小鼠IgG(上海康成生物工程有限公司);小鼠抗β-actin多克隆抗体(上海康成生物工程有限公司);预染蛋白Marker(分子质量6.5~175.0 ku,New England Biolabs)。One Touch血糖仪购自美国强生医疗器材有限公司;BH-NIC-B型倒置显微镜购自日本Olympus公司;蛋白电泳仪购自美国Bio-Rad公司;SH-100型凝胶图像分析仪购自上海复旦四星高科技技术公司。
1.3 分组与给药 80只SD大鼠分笼喂养,自由饮水,分为正常对照组和造模组。正常对照组(CON)10只,给予普通饲料喂养。造模组70只给予高脂饮食(脂肪20%、奶粉5%、蛋黄粉5%、基础饲料70%),喂养4周后禁食12~14 h,予 STZ 30 mg·kg-1腹腔注射。1周后,空腹血糖值≥11.1 mmol·L-1即造模成功,继续高脂饮食。取40只成模大鼠随机分为 4组:糖尿病组(DM);灵芝多糖组(GLPs),灵芝多糖 600 mg· kg-1;二甲双胍组(Met),二甲双胍 600 mg· kg-1;联合用药组(COM),灵芝多糖300 mg·kg-1+二甲双胍300 mg·kg-1。每日上午11∶00时灌胃给药1次,正常对照组和糖尿病组予生理盐水灌胃,连续给药12周。
1.4 观察指标
1.4.1 血糖测定 给药12周末,禁食14~16 h后,经尾静脉取血测空腹血糖。
1.4.2 心肌组织饱和苦味酸天狼猩红染色 将组织按常规冲洗,不同浓度乙醇梯度脱水,二甲苯透明,浸蜡,包埋,切片(厚度5μm)。切片脱蜡至水,在0.1%苦味酸天狼猩红溶液中染1 h,自来水冲洗,再经Harris苏木精染核,常规脱水,透明,树胶封片。在普通显微镜下,观察心肌间质及血管周围纤维化情况。
1.4.3 血清糖基化终末产物含量测定 取0.2 ml血清用双蒸水稀释10倍,即稀释成2 ml放入比色皿中,设置荧光分光光度计激发光波长370 nm,发射光波长440 nm,狭缝间隙3nm,测定荧光强度。AGEs含量以每毫升样品中所含荧光强度为一个任意单位,用 AU(arbitary unit)表示,即 kAU·L-1。
1.4.4 心肌CAT、GSH-Px检测 分离心肌组织,使用测试盒分别测定心肌组织CAT、GSH-Px含量。
1.4.5 免疫组织化学法测定心肌组织AGEs、CTGF的表达 取部分心肌组织,常规固定,石蜡包埋。采用免疫组织化学法检测心肌组织中AGEs、CTGF的含量,具体操作按照试剂盒说明书进行。各抗体按1∶50的方法稀释,以PBS替代一抗作为阴性对照,将切片置于高倍镜下(×200),每张切片随机选取10个视野,细胞胞膜和胞质内棕黄色颗粒即为阳性信号。采用JEDA801D型形态学图像分析软件测定阳性信号所占面积及平均灰度,二者乘积(即积分光密度值)越大表明组织中该抗原含量越高。
1.4.6 免疫印迹AGEs、CTGF蛋白的表达 取心肌组织100 mg,加入含有蛋白酶抑制剂的组织裂解液冰上提取蛋白,BCA法蛋白定量。8%的 SDSPAGE凝胶电泳分离蛋白,电流100 V;300 mA转膜150 min;含有5%脱脂奶粉TBST室温封闭1 h,分别加入AGEs、CTGF和β-actin抗体4℃过夜。滴加相应的二抗室温反应1 h,扫膜并使用Image J进行灰度分析。
1.5 统计学分析 采用Stata 7.0统计软件分析处理数据,计量资料以¯x±s表示,比较采用单因素方差分析,q检验。
2 结果
2.1 大鼠空腹血糖 糖尿病组空腹血糖水平高于正常对照组,差异有显著性(P<0.01)。用药组空腹血糖水平均低于糖尿病组性(P<0.01),其中联合用药组下降幅度最大,见Tab 1。
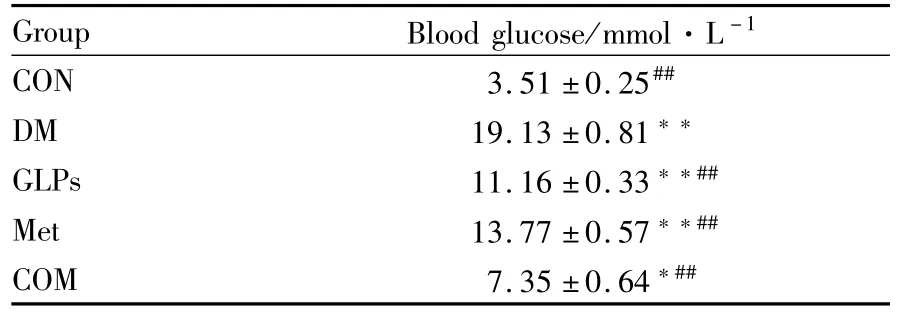
Tab 1 Blood glucose in rats of each group(¯x±s,n=10)
2.2 心肌组织天狼猩红染色 血管纤维化和间质纤维化是心肌纤维化病变的两种主要形式。在饱和苦味酸-天狼猩红染色下,心肌细胞呈黄色,胶原纤维呈红色。Fig 1A~E显示了各组大鼠左室心肌壁内血管周围纤维化情况,可见CON组血管周围有少许红色胶原增生,不向周围间质发射;DM组血管周围有大量的束状、片状红色胶原纤维异常堆积,并向周围心肌组织间隙延伸;与DM组相比,其余各治疗组大鼠心肌壁内血管周围胶原明显减少,其中联合用药组减少最为明显。Fig 1a~e显示了各组大鼠左室心肌间质纤维化情况,可见CON组大鼠左室心肌间质内仅有少量胶原;而DM组间质胶原明显增多,纤维条索较粗;与DM组相比,其余各治疗组大鼠心肌间质胶原增生明显减轻,其中联合用药组减轻最为明显。
2.3 大鼠血清AGEs含量测定 糖尿病组大鼠血清AGEs含量明显高于正常对照组(P<0.01),灵芝多糖组和二甲双胍组较模型组明显下降(P<0.05),联合用药组血清AGEs含量明显低于模型组(P<0.01),见 Tab 2。
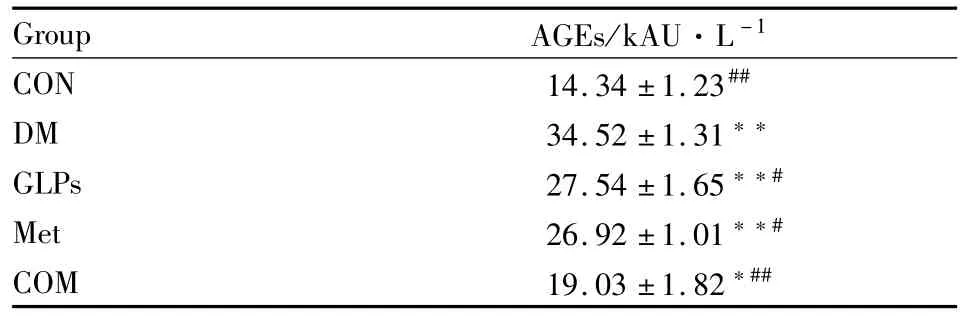
Tab 2 AGEs levels of serum in rats of each group(¯x±s,n=10)
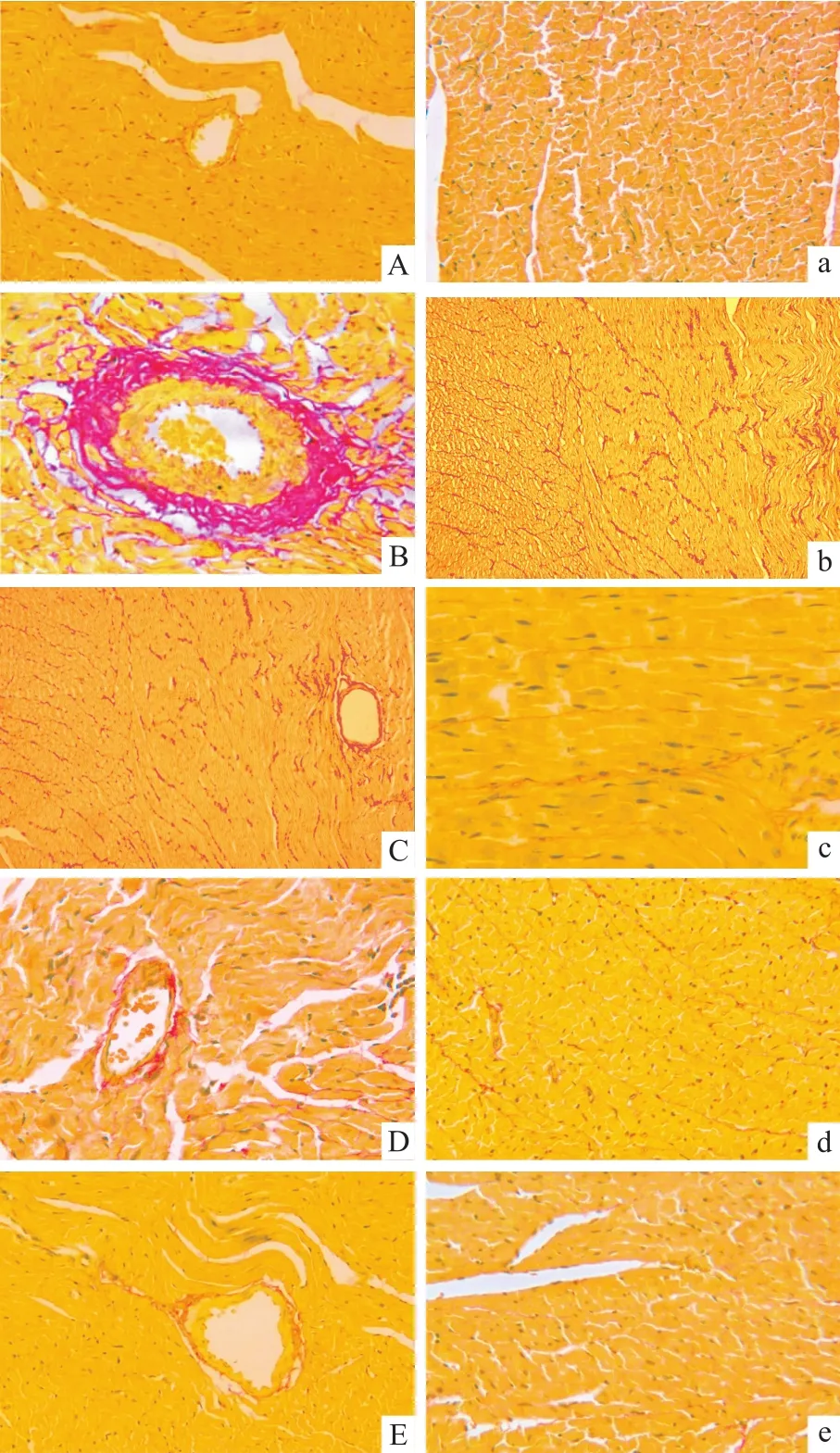
Fig 1 Myocardium of left ventricle collagen of rats(Picro-sirius red staining)(×400)
2.4 大鼠心肌CAT、GSH-Px变化 与正常对照组相比,糖尿病组心肌组织CAT和GSH-Px水平明显降低(P<0.01),灵芝多糖组和二甲双胍组较模型组略有升高(P<0.05),联合用药组明显高于模型组(P<0.01),见 Tab 3。

Tab 3 CAT and GSH-Px levels on myocardium in rats of each group(¯x±s,n=10)
2.5 免疫组化检测心肌组织中AGEs、CTGF的表达 免疫组织化学(immunohistochemistry,IH)结果如Fig 2所示:大鼠心肌组织AGEs和CTGF免疫组化结果,细胞胞膜和胞质内棕黄色颗粒即为阳性信号。Fig 2可见,CON组大鼠左室心肌组织AGEs和CTGF低表达,阳性颗粒散在,染色较浅;DM组高表达,棕黄色信号强,融合成片,而各治疗组表达均明显降低,其中联合用药组降低更为明显。每张切片随机选取10个视野,采用JEDA801D型形态学图像分析软件测定阳性信号所占面积及平均灰度,二者乘积(即积分光密度值)越大表明组织中该抗原含量越高。结果见 Tab 4:与 CON组相比,AGEs和CTGF的表达在DM组中明显升高(P<0.01);与DM组相比,3个治疗组AGEs和CTGF的表达明显降低(P<0.01),其中联合用药组的两种蛋白表达最低(P<0.01)。
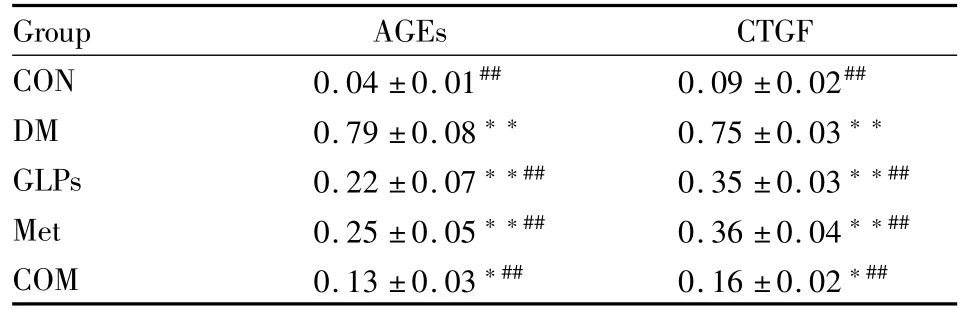
Tab 4 Expression of AGEs and CTGF in myocardium of diabetic rats(¯x±s,n=10)
2.6 蛋白印记检测心肌组织中AGEs、CTGF的表达 蛋白印迹结果见 Fig 3,β-actin(42 ku)作为内参,在各组中有较均一的表达;AGEs和CTGF在各组中的蛋白条带深浅不一。
用四星图像处理系统测出各组AGEs和CTGF蛋白表达量与β-actin的表达量,并计算出其比值。DM组的AGEs和CTGF蛋白表达明显高于CON组(P<0.01),与DM组相比,3个治疗组的两种蛋白表达均下调,联合用药组组下调最为明显(Tab 5)。
Tab 5 AGEs and CTGF in myocardium of diabetic rats by Western blot(¯x±s,n=10)
3 讨论
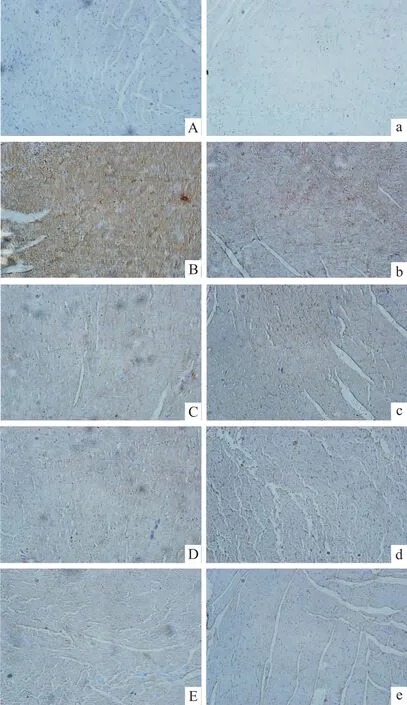
Fig 2 Myocardium of left ventricle of rats by immunohistochemistry(×200)

Fig 3 AGEs and CTGF in myocardium of diabetic rats by Western blot
糖尿病心肌病变是由糖尿病所致的一种心脏疾病,随着病情的发展逐渐出现心肌收缩力减弱,心肌舒张受限,每搏心输出量减少,并出现代偿性的左心室肥厚,心肌纤维化,最终导致充血性心力衰竭。糖尿病时,机体的高糖环境是糖尿病心肌病发生和发展的始动因素[6]。临床研究表明,持续的高血糖状态可引起蛋白质的 AGEs增多[7],而 AGEs水平与糖尿病患者左室舒张功能呈正相关[8]。
AGEs是 Yamamoto等[9]首先提出来的,糖尿病的慢性持续高血糖状态,可导致血液中葡萄糖醛基或酮基与体内蛋白质分子中赖氨酸或羟赖氨酸的ε-氨基进行非酶糖基化反应[10]。该反应生成的AGEs是一种不可逆的大分子产物。AGEs主要通过两个途径发挥生物学效应:(1)通过对蛋白质、脂质、核酸等的直接修饰改变其结构功能。(2)通过与特异受体结合导致机体的病理改变,而后者则在其所致的损伤中发挥更重要的作用[11]。有研究表明[12],AGEs一旦在高糖环境下形成,此后再严格控制血糖,也无法阻止AGEs交联过程的继续进行,所以抑制AGEs的生成对治疗糖尿病并发症有重要意义。我们证实灵芝多糖联合二甲双胍具备抑制血清中AGEs的含量和降低心肌组织中AGEs的表达,并且效果优于单独用药组。
结缔组织生长因子(connective tissue growth factor,CTGF)广泛存在于人类多种组织器官,在生理状况下,表达水平比较低。而在病理情况下,特别是在纤维化组织中表达上升。它通过促进细胞增殖,直接诱导胶原生成,促进细胞黏附等自身的生物学效应参与纤维化的发生与发展[13-14]。CTGF的检测可能是判断心肌纤维化预后的一个有用指标,其水平增加往往先于心肌纤维化的临床症状,而对于确诊心肌纤维化的患者来说,它又有预测疾病进展的价值[15]。我们研究证实2型糖尿病心肌纤维化同时伴随着CTGF蛋白表达的上调,表明CTGF与糖尿病心肌纤维化密切相关。联合用药治疗12周后,大鼠心肌CTGF的表达明显减少(P<0.01),大鼠心肌纤维化明显减轻。
Kakkar等[16]学者研究发现2型糖尿病大鼠的心脏脂质过氧化程度明显增加,Cai等[17]也在2型糖尿病患者的血液和心肌组织中发现有氧化应激标志物的存在。在高糖环境下,机体一方面清除氧自由基的酶(CAT、GSH-Px)活性降低,另一方面体内的氧化应激作用增强,造成了体内大量活性氧自由基的积聚,导致活性氧连锁反应,从而促进糖尿病心脑血管以及其他一系列并发症的发生和发展[18]。本研究中,糖尿病组大鼠心肌CAT和GSH-Px活性明显降低。联合用药组的CAT和GSH-Px活性明显升高,效果优于单独用药组,说明灵芝多糖和二甲双胍联合使用能更好的增强心肌抗氧化能力。
本实验提示,在2型糖尿病大鼠模型中,联合应用灵芝多糖和二甲双胍在改善心肌纤维化方面明显优于单用,可能与调节机体氧化应激水平,降低血清AGEs的含量,减少糖尿病心肌纤维化过程中AGEs和CTGF的表达有关。在总的剂量不变的情况下联合两种药物可以减少其中一种药物的剂量。本研究中联合用药减少了二甲双胍的剂量,同时也降低了二甲双胍对降血糖可能带来的副作用。一定剂量的灵芝多糖能对抗对大鼠机体氧化应激水平,两种药物起到了互补的作用。联合使用灵芝多糖和二甲双胍可能会成为今后临床治疗糖尿病心血管疾病的一个新的方向。
参考文献:
[1] 郑 辉,于德明.糖尿病心肌病的发病机制和诊断[J].国际内分泌代谢杂志,2006,26(2):116-8.
[1] Zheng H,Yu D M.The pathogenesis and diagnosis of diabetic cardiomyopathy[J].Int J End Met,2006,26(2):116-8.
[2] 王 婧,符丽娟.曲尼司特对糖尿病大鼠心肌纤维化的作用[J].中国药理学通报,2013,29(6):837-41.
[2] Wang J,Fu L J.Effects of tranilast on myocardial fibrosis of diabetic rats[J].Chin Pharmacol Bull,2013,29(6):837-41.
[3] Chen X P,Chen Y,Li SB,et al.Free radical scavenging of Ganoderm lucidum polysaccharides and its effect on antioxidant enzymes and immunity activities in cervical carcinams rats[J].Carbohydrate Polymers,2009,77:389-93.
[4] 吴 锋,孟国梁,徐济良,等.灵芝多糖抑制NADPH氧化酶表达防治大鼠动脉粥样硬化[J].中国药理学通报,2012,28(7):944-7.
[4] Wu F,Meng G L,Xu J L,et al.The anti-atherosclerotic effect of Ganoderma lucidum Polysaccharides via down-regulation of vascular NADPH oxidases expression in atherosclerosis rats[J].Chin Pharmacol Bull,2012,28(7):944-7.
[5] Anfossi G,Russo I,Bonomo K,et al.The cardiovascular effects of metformin:further reasons to consider an old drug as a cornerstone in the therapy of type 2 diabetes mellitus[J].Curr Vasc Pharmacol,2010,8(3):327-37.
[6] 周庆峰,王洪新,王桂君,等.高糖对去甲肾上腺素诱导的心肌细胞肥大的促进作用[J].中国药理学通报,2003,19(9):1054-7.
[6] Zhou QF,Wang H X,Wang GJ,et al.Accelerating effects of high glucose on NE-induced cardiac hypertrophy of the cultured myocardial cells[J].Chin Pharmacol Bull,2003,19(9):1054-7.
[7] Gopal V R,Indira M.Investigation on the correlation of advanced glycated end products associated fluorescence with blood glucose and oxidative stress in ethanol-administered diabetic rats[J].Exp Toxicol Pathol,2010,62(2):157-62.
[8] Jasper W L,Hartog M D,Yoran M H,et al.Skin-auto fluorescence,a measure of tissue advanced glycation end-products,is related to diastolic function in dialysis patients[J].Cardiac Failure,2008,14:596-602.
[9] Yamamoto Y,Yamagishi S,Yonekura H,et al.Roles of the AGERAGE system in vascular injury in diabetes[J].Ann N Y Acad Sci,2000,902:163-70.
[10] Comazzi S,Bertazzolo W,Bonfanti U,et al.Advanced glycation endproducts and sorbitol in blood from differently compensated diabetic dogs[J].Res Veterinary Sci,2008,84:341-6.
[11]Tomoyuki M,Masayuki K,Chie O,et al.Involvement of advanced glycation end-products,pentosidine and Nε-(carboxymethyl)lysine,in doxorubicin-induced cardiomyopathy in rats[J].Toxicol,2010,268:89-97.
[12]孙 敏,孙 晶,朱 荃.复方HSF3对体外蛋白质非酶糖化反应的影响[J].中华中医药杂志,2006,21(10):622-3.
[12]Sun M,Sun J,Zhu Q.Effect of HSF3 on protein nonenzymaticglycation reaction in vitro[J].Chin J Tradit Chin Med,2006,21(10):622-3.
[13]Kothapalli D,Grotendorst G R.CTGF modulates cell cycle progression in cAMP-arrested NRK fibroblasts[J].J Cell Physiol,2000,182(1):119-26.
[14]Gore-Hyer E,Shegogue D,Markiewicz M,et al.TGF-βand CTGF have overlapping and distinct fibrogenic effects on human renal cells[J].Am J Physiol Renal Physiol,2002,283(4):707-16.
[15]常文静,蔡 辉.结缔组织生长因子在心肌纤维化中的作用[J].微循环学杂志,2012,22(4):62-6.
[15]Chang W J,Cai H.Role of connective tissue growth factor in myocardial fibrosis[J].J Microcircul,2012,22(4):62-6.
[16]Kakkar R,Kalra J,Mantha SV,et al.Lipid peroxidation and activity of antioxidant enzymes in diabetic rats[J].Mol Cell Biochem,1995,151(2):113.
[17]Cai L,Kang Y J.Oxidative stress and diabetic cardiom yopathy.Abrief review[J].Cardiovasc Toxicol,2001,1(3):181.
[18]Johansen J S,Harris A K,Rychly D J,et al.Oxidative stress and the use of antioxidants in diabetes:linking basic science to clinical practice[J].Cardiovasc Diabetol,2005,4(1):5.

