微藻反应器用于水气净化与产氧的功能验证
吴祖成,冯道伦,常园园,边磊,任琼,廖文
(浙江大学环境工程系环境电化学与化学贮能实验室能源清洁利用国家重点实验室,杭州310058)
微藻反应器用于水气净化与产氧的功能验证
吴祖成,冯道伦,常园园,边磊,任琼,廖文
(浙江大学环境工程系环境电化学与化学贮能实验室能源清洁利用国家重点实验室,杭州310058)
将微藻和电去离子技术引入密闭生态系统,设计单元反应器旨在验证其在空气再生、水净化和潜在食物的生产。在反应器中对尿液进行消解和NH+硝化转化得到超过90%NH+-44N硝化为NO3--N-的培养液适宜于螺旋藻养殖并获得高质量的微藻生物量;此时,CO2的平均吸收速率VCO2=458.6 mL/m3·min、O2产生速率VO2=616.5 mL/m3·min,即螺旋藻的同化系数VCO2/VO2≈0.74,接近人的呼吸系数VCO2/VO2=0.86;EDI法水净化率97%可直接回用。结果表明:该体系能实现CO2吸收、O2释放和螺旋藻生物量的生产,同时将水净化。
微藻反应器;水气净化;放氧速率;EDI净水
1 引言
长期空间载人飞行的生命保障系统[1]要求能连续不断地供O2、给水、生产食物、净化空气、清除废物,从而维持人、植物、动物的生存,保持一个基本平衡稳定的闭环微小生态环境。因此,密闭生态系统在载人航天上引起了高度的重视。“礼炮”号、“和平”号到“国际”空间站的实践表明,利用物理和化学手段只能实现系统中O2和H2O的部分再生,在系统中引入生物以实现食物的循环逐渐成为共识[2]。前苏联“人-藻类”证明藻类能够成功地完成与系统中大气和水交换的功能[1],“BIOS-3人-植物”在大气调控、食物生产、水循环以及废物处理方面获得了大量的实验结果[3]。NASA提出受控生态生命保障系统实验模型,对高等植物生物再生部分的性能进行试验和证实[3]。然而,像“生物圈II号”这样一个庞大的密闭生态系统尚且难以实现稳定的生态平衡,在小型的密闭生态系统中实现较高闭合度的循环更是存在诸多科学问题和影响因素需要进一步地探索[4]。
事实上,由于植物的大量不可食部分重新进入废物处理循环消耗氧气是造成闭合程度降低的主要原因。为提高生态平衡和提供蛋白质来源,一些学者研究动物来解决航天员的食物供给。显然,培养动物将给系统增加复杂程度。藻类既具有植物的吸收CO2和释放O2的特性,又能制造动物性蛋白,在密闭生态系统中起着不可替代的关键作用。欧空局的MELISSA方案中,将螺旋藻作为一个生物部件引入生保系统[5]。基于藻类的光合自养特性和空间尿液N,P和K含量丰富的特点,可以利用尿液来培养微藻,不但可以实现废物中资源的净化回收,而且还能提供高蛋白食物,但直至目前藻类在密闭循环中的关系仍不清楚,有必要深入研究。本工作旨在确定以螺旋藻为例的微藻在密闭生态系统中对水的再生、CO2的净化和食物循环的作用,实验验证单元反应器的效率和测定放氧速率。
2 反应器设计原理
基于MELISSA,本课题组经过近二十多年的探索研究,设计如图1所示的单元反应,首先在舱I内进行收集和分类预处理。硝化舱IIA的任务是将尿液中的NH4+转化成NO3-,为后继舱的植物和螺旋藻提供最适合其生长的N源。该舱的优势菌种为亚硝化细菌和硝化细菌,前者将NH4+氧化成NO2-,后者将生成的NO2-进一步氧化成NO3-。舱IIIA/IIIB(光合自养/植物舱)包括两个部分,舱IIIA为能进行光合自养的钝顶螺旋藻,舱IIIB为植物舱,以经过硝化和矿化处理的生活废水为营养液进行培养,获得螺旋藻和植物的可食部分可作为宇航员食物,两者的光合作用可吸收CO2,同时释放出O2。植物中的不可食部分经过预处理后返回送入舱IIA进行氧化分解。
本方案不仅极大程度地降低了系统的复杂程度、提高了整个系统的稳定性,而且实现了MELISSA的全部功能。将尿液和其他废物分开处理是基于以下理由:人体产生的卫生废物中,尿液中的有机物只占总量的5%,却包含80%的N,50%的P以及90%的K[6],因此可以直接制备用于生物的营养液;此外,尿液中的低有机物含量和高NH4+-N浓度有利于硝化细菌的生长,适宜的硝化细菌硝化后的尿液可以为藻类和高等植物提供适合的N源(NO3--N)。
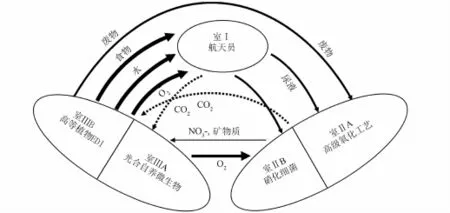
图1 反应器中物质的循环Fig.1 Components cycle inm icroalgae reactor
3 反应器中螺旋藻的养殖
3.1 螺旋藻在尿液中的生长
螺旋藻在Zarrouk培养基中生长至对数生长期(4天)后,收集并接种至模拟,实际以及硝化尿液中培养。培养过程中每天定时测定各种培养液中的生物量浓度,pH。并基于这些数据计算螺旋藻的生长速率(v)和最大生物量浓度(Pmax)[7]。
螺旋藻能在实际尿液中快速生长,但需将其稀释至180倍,尿液中较高浓度的铵抑制其生长。表1列出尿液中培养获得螺旋藻主要组分测定结果,对比于Zarrouk培养基,各组分含量与其他研究者结果大致在同一水平上[8]。
实际尿液和模拟尿液[7]中获得的螺旋藻成分相差不大,但在蛋白质和脂肪的含量上有明显差别,蛋白质含量在Zarrouk组中的高达67.2%,而在合成尿液(SHU)[7]和真实尿液(RHU)组中分别为32.4%和34.78%。脂肪在Zarrouk组较低,只有11.93%,而SHU和RHU组却分别上升20.43%和17.58%。在间歇投加试验中,N源并不存在不足,其所造成螺旋藻蛋白质含量低的原因与N源的形态有关。
螺旋藻在以NaNO3作为N源和以NH4+-N作为N源相比,其v为0.237 g/L·d大致相当,但Pmax稍大些。物理观感上,NaNO3组培养的质量与Zarrouk培养基无明显差别,优于实际和模拟尿液中的培养藻体。通过对藻体叶绿素含量的分析表明,NaNO3组和Zarrouk培养的含量无明显差别[8]。吸收光谱分析表明两种N源的螺旋藻在整个测试波长范围内的波形基本吻合、类胡萝卜素以及灰分含量亦处于同一水平。更为重要的是蛋白质含量丰富,NaNO3组的螺旋藻54.6%与Zarrouk培养基组67.2%接近。同时,脂肪含量为9.53%,亦和Zarrouk培养基组差别不大(11.93%)。可以认为,在尿液中培养螺旋藻,-N是合适的N源。

表1 Zarrouk、SHU、RHU培养液中获得螺旋藻的主要成分含量(SHU、RHU均稀释180倍)Table 1 M ain com position of Spirulina p latensis cultured in Zarrouk,real urine and synthetic urine

表2 螺旋藻在不同培养液中的v和Pmax对比Table 2 Com parison of v and Pmaxof Spirulina platensis cultured in differentmedia
尿液中NO3--N含量>90%时,培养获得螺旋藻的主要组分差别不大。因此,显著改善螺旋藻在尿液中的培养需至少将90%的NH4+-N转换成NO3--N,同时避免NO2--N的生成。
3.3 尿液的硝化
尿液的硝化在硝化反应器中进行:在进行尿液硝化之前,需完成硝化反应器内硝化细菌的增殖和挂膜,将硝化培养基加入到硝化反应器中随后接种硝化细菌。培养7天后,硝化培养基开始连续添加,使硝化反应中的硝化细菌逐渐得以纯化和累积,并在陶瓷环表面形成生物膜。在适宜的NH4+-N负荷和浓度水平下,控制硝化反应器中的pH值并确保反应器中的尿液处于高DO,能实现对实际尿液的完全硝化,且不会产生NO2--N的累积;当反应器的DO处于较低水平时,硝化过程难以完整进行,NH4+-N只能氧化到NO2--N,溶液中出现了大量的NO2--N累积,调节DO直至90%转化率[9];螺旋藻能顺利在硝化尿液中生长,获得生物量的主要营养组分与Zarrouk培养基中的相当或接近,其中每100g中蛋白质、脂肪、叶绿素、胡萝卜素分别为58.43、10.67、1376.97、264.37 g,对比于Zarrouk为67.20、11.93、1399.68、337.76 g。
3.4 共存有机物中螺旋藻生长
尿液中含有少量有机物,故亦探讨了其对螺旋藻生长的影响。尿液中有机物去除后,尽管培养过程中螺旋藻的颜色未发生明显改变,但在去除有机物后的尿液培养液中螺旋藻难以生长。进一步将含有机物的液体加入尿液中,在培养的前半阶段随着螺旋藻生物量的增加,尿液中CODcr的下降明显,由154.2 mg/L下降到最低约64.2 mg/L。这表明螺旋藻在增殖过程中吸收利用了尿液中的部分有机物[10]。
3.5 微量元素的影响
微量元素尽管量少,但对螺旋藻的生长非常重要。尿液稀释后,除Zn外其它微量元素含量大都远低于Zarrouk培养基。为此,添加足够的微量元素,结果表明对于NaNO3组来说,Pmax大致相同,但v由0.237 g/L·d降至0.163 g/L·d;对于NH4Cl组来说,加入微量元素后,其v为0.182 g/ L·d,Pmax为1.84 g/L。对于未改变N源组来说,加入微量元素后,v为0.182 g/L·d,Pmax为1.84 g/L。对比于对照组,在尿液中加入微量元素对螺旋藻生长的改善并不显著。由此可见,微量元素存在的多少对螺旋藻生长不是关键影响因素。由废弃物在氧化舱(图1中IIA)获得的微量元素即能形成循环。
3.6 反应器中pH值的变化
pH值在对数生长期都会有所提高,当NH+-4N作为N源,稀释尿液(180倍)中pH值会由停滞期的8.4上升到对数生长期的9.2左右。当NO3--N作为N源时,pH值会由停滞期的8.2上升到9.6左右。螺旋藻在Zarrouk培养基中培养时,基本没有停滞期,pH值由最初的8.2迅速上升至10.0左右。这表明,无论是以NaNO3或是以NH Cl作为N源,碱度都和培养液中的4和HCO3-浓度相关,反过来,碱度的变化亦会影响到尿液中和的浓度。水溶液中溶解的有CO2,H2CO3,和四种形态。
当溶液pH值较低,C源主要以CO2形式存在,光合藻类以其为C源,合成有机物,构成藻体自身的一部分,当pH值较高时CO2已经不存在,C源主要以和的形式存在。在此情况下,一些藻类能产生脱水酶将脱去水分子,生成CO2,提供给藻类生长[11]。Binaghi等人[12]的实验结果表明:螺旋藻优先利用的无机C源为。在高pH值条件下,螺旋藻亦能吸收利用甚至,这可能是螺旋藻在pH值高达10.0的尿液中,亦能快速生长的原因。
对pH值与生长速率作指数模拟,得到如下的指数函数:

上式表明,螺旋藻的线性生长速率(v)和ΔpH之间存在指数增长的经验关系,由于pH值的测量简便快速,也有助于快捷确定螺旋藻生长速率,R2=0.9823。
4 吸收CO2和放O2速率
4.1 CO2吸收速率VCO2测定
螺旋藻吸收CO2装置依据前期工作[13]参数控制如下:光照强度444.4W/m2;光照时间14 h;培养温度30℃。进气中CO2的含量(C0,%)以1.8 L/min速率鼓入反应器,每天定时测出口处的CO2含量(C,%),螺旋藻的CO2吸收速率VCO2(mL/m3·min)按下式计算:

在将生物引入密闭生态系统后,可以通过其光合作用来同时实现密闭体系中CO2的去除和O2的制造。螺旋藻在不同培养液中的吸收CO2和放O2速率是一个重要参数,密闭体系中利用硝化尿液培养螺旋藻时,N、P和S元素,以及O2,CO2和食物的闭合循环率是能否实现长期载人运行的依据。
螺旋藻吸收CO2速率对批次培养螺旋藻过程中的吸收CO2速率进行了测定,结果见图2。不同培养基中CO2速率的变化基本相同。实际尿液中吸收CO2的速率迅速升高,在大约4天后达到峰值,并维持在此水平上,随后逐渐降低并趋于稳定。相应的,螺旋藻在硝化尿液和Zarrouk培养基中分别在3天和4天后达到峰值。对于实际尿液和硝化尿液,螺旋藻合成的C源基本上来自空气中的CO2。因此螺旋藻的合成最大时,CO2的吸收速率亦达到最大。实际尿液的最大CO2吸收速率为467.5 m L/m3·min,略高于硝化尿液的443.95 mL/m3·min。Zarrouk培养基中的生物量增长速率是最高的,但其最大CO2吸收速率(410.29 mL/m3·min)低于实际和硝化尿液组,这可能是由于Zarrouk培养基中含大量的NaHCO3作为C源被吸收,因此减少了对空气中CO2的需求量。
4.2 螺旋藻的放O2特性
实际尿液和硝化尿液培养螺旋藻时,密闭体系空气中O2浓度的变化情况见图3。在向密闭光生物反应器中注入400 mL CO2后,在试验时间段内O2浓度呈线性上升,螺旋藻生物量的合成符合零级反应,放O2速率达到极大值,据此计算出螺旋藻在不同培养液中的放O2速率,结果见表3。
密闭体系中O2和CO2的含量始终都保持着近乎线性的变化,这表明:即使在高浓度CO2的环境中螺旋藻的光合速率都没有受到影响。造成这种差别的原因可能在于植物大都是直接从空气中获取CO2来完成光合作用,空气中CO2含量高低直接影响到植物的光合作用。对于螺旋藻来说,其光合作用所利用的C源基本上是HCO3-或CO32-。在培养过程中,螺旋藻液的pH大都不低于9,此时即使空气中CO2含量很高,藻液中CO2却基本不存在。因此,即使CO2对螺旋藻的光合作用有影响,螺旋藻所处的高pH值环境都会确保其不受影响。
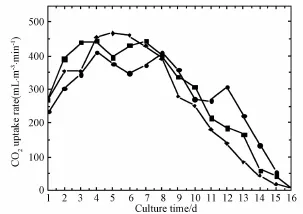
图2 批次培养时的CO2吸收速率Fig.2 Uptake rate changes of CO2(●)Zar rouk,(■)95.0%nitrifying urine,(◆)180-diluted RHU

图3 对数生长期螺旋藻的放O2Fig.3 O2release in ZM,95.0%nitrifying urine and 180-diluted RHU during batch cultu re(●)Zar rouk(■)95.0%nitrifying urine(◆)180-diluted RHU

表3 不同培养液中螺旋藻的放O2速率Table3 Rates of O2release by Spirulina platensis in different cultu rem edia
试验时间段内CO2的平均吸收速率为458.61 mL/m3·min(VCO2),相应O2的平均产生速率为616.53 m L/m3·min(VO2)。亦即螺旋藻的同化系数约为0.74(VCO2/VO2)。相应的人的呼吸系数(VCO2/VO2)约为0.86[13],两者之间存在一定的差异。这表明:密闭体系中生物部件需辅以一定物化手段改善和维持O2和CO2含量的稳定。
5 EDI水净化回收
从营养液成分的影响可知,氮、磷、有机物浓度高,则螺旋藻生长快,且吸收CO2和释放O2速率也高。为维持营养液浓度又能对水进行回收利用,在本反应器中引入电去离子(EDI)技术。EDI目前主要应用于纯水制备,基于EDI在去除和回收废水中氮、磷营养盐方面具有技术优势和良好潜力[15],首次对螺旋藻培养中含有的营养盐进行浓缩和水回收利用。
EDI中原水离子浓度越高迁移至浓室的离子越多浓室中离子浓度就越高,浓室中溶液适宜返回培养螺旋藻;淡室中离子浓度就越低,淡化/净化后可以回用。反应器中三种浓度配比培养液进行比较:第一种浓度运行后,浓室NO3-为8.0×mol/L,为2.1×10-4mol/L,NO3-和的浓缩倍数分别为6.0和3.1;第二种浓室为5.0×10-4mol/L,为2.7×10-4mol/L,NO3-和-的浓缩倍数分别为5.0和2.7;第三种浓室为3.2×10-4mol/L,为3.7×10-4mol/L,和的浓缩倍数分别为4.8和2.8。浓缩倍数为4.8~6.0,浓缩倍数为2.7~3.1。NO3-的浓缩程度高于,去除率在97%以上,出水中和离子浓度均低于0.1 mg/L,符合回用标准。
6 结语
基于螺旋藻一类的微藻具有光合自养与异养特性,不仅能充分利用空间尿液中的无机和有机物营养成分,还能将CO2转化为O2,起到空气再生、水净化、提供食物高蛋白的作用:
2)螺旋藻能够利用废弃物中的有机物进行异养生长,脱除氮、磷,达到水体的净化;
3)进一步改善螺旋藻培养条件使其保持稳定释放O2和吸收CO2含量,将有可能实现密闭系统中大气的自我循环净化;
4)EDI技术对N、P浓缩倍数分别为4.8~6.0和2.7~3.1,有效维持螺旋藻培养液较高浓度有利养殖。出水N、P营养盐去除率97%以上,离子浓度均低于0.1 mg·L-1,可直接回用。
[1] Salisbury F B,Gitelson J I,Lisovsky GM.Bios-3:Siberian experiments in bioregenerative life support[J].BioScience,1997,47(9):575-585.
[2] Ashida A.Considerations of design for life support systems [J].Advances in Space Research,2003,31(7):1805-1809.
[3] Wheeler R M,Mackowiak C L,Stutte GW,et al.NASA's biomass production chamber:a testbed for bioregenerative life support studies[J].Advances in Space Research,1996,18(4):215-224.
[4] Bluem V,Paris F.Aquatic modules for bioregenerative life support systems based on the CEBASbiotechnology[J].Acta astronautica,2001,48(5):287-297.
[5] Godia F,Albiol J,Montesinos JL,et al.MELISSA:a loop of interconnected bioreactors to develop life support in space [J].Journal of biotechnology,2002,99(3):319-330.
[6] Fittschen I,Hahn H H.Characterization of the municipal wastewaterpart human urine and a preliminary comparison with liquid cattle excretion[J].Water science and technology,1998,38(6):9-16.
[7] Feng D,Wu Z,Xu S.Nitrification of human urine for its stabilization and nutrient recycling[J].Bioresource technology,2008,99(14):6299-6304.
[8] Shimamatsu H.Mass production of Spirulina,an ediblemicroalga[M]//Asian Pacific Phycology in the 21st Century:Prospects and Challenges.Springer Netherlands,2004:39-44.
[9] Feng D,Wu Z,Wang D.Effects of N source and nitrification pretreatment on growth of Arthrospira platensis in human urine [J].Journal of Zhejiang University SCIENCE A,2007,8(11):1846-1852.
[10] Chang Y,Wu Z,Bian L,et al.Cultivation of Spirulina platensis for biomass production and nutrient removal from synthetic human urine[J].Applied Energy,2013,102:427-431.
[11] Azov Y.Effect of pH on inorganic carbon uptake in algal cultures[J].Applied and environmentalmicrobiology,1982,43(6):1300-1306.
[12] Binaghi L,Del BorghiA,LodiA,et al.Batch and fed-batch uptake of carbon dioxide by Spirulina platensis[J].Process Biochemistry,2003,38(9):1341-1346.
[13] 边磊.微藻对氮磷营养盐的脱除利用与废水净化[D].杭州:浙江大学,2010.
[14] Doerr D F,Convertino V A,Blue J,et al.Interaction between exercising humans and growing plants in a closed ecological life support system[J].Acta astronautica,1995,36(8):601-605.
[15] 冯霄.电去离子技术浓缩与脱除水中重金属离子和营养盐研究[D].杭州:浙江大学,2008.
Oxygen Production in M icroalgal Reactor for W ater,Air and W aste Reclam ation
WU Zucheng,FENG Daolun,CHANG Yuanyuan,BIAN Lei,REN Qiong,LIAOWen
(Department of Environmental Engineering,Laboratory for Electrochemistry and Energy Storage,State Key Laboratory of Clean Energy Utilization,Zhejiang University,Hangzhou 310058,China)
In order to evaluate the feasibility of introducingmicroalgae into closed ecological system and achieving potential food production aswellas air revilization and water reclaimation,-N in wastes urine was nitrified to-N as proper N source for culture of edible protein,Spirulina platensis,which was utilized to absorb CO2and produce O2.More than 90%-N was successfully oxidized to-N,which was an optimum medium for culture of Spirulina platensis.Mean CO2uptake rate VCO2was458.61 mL/m3·min and O2evolution rate was 616.53 mL/m3·min respectively,assimilation factor(VCO2/VO2)was about 0.74 which is close to human respiration factor 0.86.The utilizability of urine has been proved and 97%water can be reused with EDI technique.The results showed that the system could realize CO2 absorption,O2 production and Spirulina biomass production and the water was purified at the same time.
microalgae reactor;culture;air revitalization and water reclamation;oxygen evolution.
V444.3;S965.89
A
1674-5825(2014)03-0196-06
2013-11-20;
2014-05-14
国家自然科学基金(No.21173188)
吴祖成(1956-),男,教授、博士,研究方向为受控生命保障系统技术。E-mail:wuzc@zju.edu.cn

