红蓝LED光照强度对密闭生态系统中生菜生长状况及光合速率的影响
沈韫赜,郭双生,艾为党,唐永康
(1.中国航天员科研训练中心,北京100094;2.中国航天员科研训练中心人因工程重点实验室,北京100094)
红蓝LED光照强度对密闭生态系统中生菜生长状况及光合速率的影响
沈韫赜1,郭双生2,艾为党2,唐永康2
(1.中国航天员科研训练中心,北京100094;2.中国航天员科研训练中心人因工程重点实验室,北京100094)
研究利用红蓝LED进行不同光照强度下的生菜培养实验。通过设置不同生长期的对照试验,确定了CELSS中生菜的最佳收获期。试验结果显示,生菜光合速率(Pn)和产量均随光照强度增加而上升,但增幅逐渐变小;通过公式拟合,光照强度达到556μmol·m-2·s-1时,继续增加光照强度产量不再增加,同时光能利用率随着光照强度的增加而降低。在保证生菜供氧能力及产量满足乘员对氧气、食物需求的前提下,选择合适的光照强度水平,可有效提高系统的能源利用效率。出苗后第40天为最佳收获期,此时收获,生菜的日产量和光能利用率最高,营养品质最好。
受控生态生保系统;生菜;光照强度;光合速率;光能利用率;生长期
1 引言
航天员在太空中的生存需要依赖生命保障系统。目前国际上通用的生命保障系统主要利用物化手段为航天员提供水和氧气,但无法提供食物,也不能实现物质的循环。目前国际上普遍认为,实现人类在太空中长期居住的根本途径是建立受控生态生保系统(Controlled Ecological Life Support System,CELSS)。在CELSS中,植物作为核心部件,承担着为航天员提供氧气和食物的关键作用[1-3]。
太空环境与地球环境有很大不同,如低压、低氧、高二氧化碳等,同时,航天员在太空活动中面临能源匮乏、空间狭小等诸多限制。因此,CELSS中的蔬菜培养技术与地面培养是有差别的。CELSS中蔬菜培养的研究,基本方法是在地面试验中模拟太空环境的部分特征,探索在该环境下蔬菜的生长特点,并发展适合该环境的培养技术[4-5]。CELSS中的蔬菜培养需要满足两个要求:一是空间利用率高,在有限的空间中产生尽可能多的氧气和食物;二是高效节能,尽可能的提高能量利用率。因此,作物种类的选择具有关键意义[6-7]。生菜作为目前CELSS植物培养研究中的重要作物,其优点是产氧能力强,可食生物量比例高(地上部均可食用)。同时,光照是植物的能量来源,也是植物培养中能耗的主要构成。因此光源的选择对于提高能效至关重要。中国航天员科研训练中心在之前的研究中,发现油麦菜(生菜的一种)在90%红光+10%蓝光的红蓝LED下生长良好[8-10]。在此基础上,确定对于生菜最适宜的光照强度也是提高能效比的关键。
为研究在红蓝LED光源下光照强度对生菜生长状况和光能利用率的影响,确定最适宜CELSS中生菜培养的光照强度,本研究进行了不同光照强度处理下的生菜培养实验。
2 材料与方法
2.1 试验材料
供试植物选用大速生生菜(Lactuca sativa L var.Dasusheng),该生菜品种具有生长周期短(40天左右),产量高,叶型紧凑的特点。
2.2 试验设备
该实验在受控生态生保系统集成试验平台的植物舱中进行[11]。植物舱容积为224 m3。植物培养采用90%红光+10%蓝光的组合LED(波长为400~500 nm及600~700 nm)作为光源。植物舱环境参数(温湿度、压力、氧浓度、二氧化碳浓度、风速等)均可控。
利用LI6400便携式光合仪测定叶片光合速率,叶室光源采用与试验平台类似的红蓝LED,保证了测定条件与实验条件的一致性。测定时,可设定叶室中的环境条件,如光照强度、温湿度等。
2.3 试验方法
2.3.1 试验设计
设置4个光照强度水平:300μmol·m-2·s-1、400 μmol·m-2·s-1、500μmol·m-2·s-1、600μmol·m-2·s-1,其它试验条件一致。试验舱内温度为25±0.5℃,湿度为65±5%,二氧化碳浓度在实验前10天不控制,第11天至收获控制在8‰~10‰。光周期设置为24 h光照。收获后,对其进行营养成分测定。
2.3.2 培养方法
本实验采用陶瓷基质培养,直接将生菜种子播种至湿润的陶瓷基质内,每个点同时播3粒生菜种子。播种后的基质用薄膜覆盖。出苗后将薄膜掀开。出苗后第10天间苗,每个播种位点只留一株苗。试验采用改良的Hoagland营养液,前10天浇灌1/2营养液(各成分浓度为正常的1/2,以避免在生长初期对幼苗造成胁迫),第11天开始浇灌全营养液(各成分浓度升至正常值)。
2.3.3 测定方法
生育期内,每5天进行一次数据测定。测定项目有叶片数、光合速率等。光合速率可通过便携式光合仪自动测定。
3 结果与讨论
3.1 生长状况
实验过程中,环境参数始终控制在设定范围内。生菜在生长发育过程中,长势良好。图1为生菜生长状况,图2为各处理生菜叶片数增加趋势比较。从图2可以看出,光照强度越强,生菜叶片数越多。第40天时,600μmol·m-2·s-1光照强度下的生菜叶片数比300μmol·m-2·s-1下的生菜多25.6%。高光照强度下,较多的光能输入量导致生菜光合产物产量增多,用于营养体构建的原料充足,因而叶片数增长较快。
3.2 光合速率与蒸腾速率
各光照强度下生菜生长期内叶片光合速率及蒸腾速率(Tr)对比如图3和图4所示:
由图3可以看出,整个生长期内,生菜叶片光合速率(Pn)随着光照强度的增强而上升。这是因为光照强度增强导致叶片光合机构接受的光能增加,从而促进了光合作用的进行,导致光合速率的上升。而光合速率上升使得光合产物增加,光合机构的发育得到促进,进一步促进了光合作用。光照强度对光合速率的影响非常强烈,几乎呈线性相关。光照强度相同时,红蓝LED下培养的生菜比白光下培养的生菜光合速率高。分析认为该现象与植物对光照的吸收特性有关,叶绿素对光能的吸收主要集中在两个波长范围:640~660 nm的红光部分和430~450 nm的蓝紫光部分,而其中又以红光部分为主。因此生菜对90%红光+ 10%蓝光的组合LED吸收效率更高。这有利于提高系统光能利用率。
随着光照强度的持续增强,光合作用会达到光饱和点,此时光合速率不再随着光照强度的继续增强而上升,而是受到抑制而下降,该现象称为光抑制[12-14]。本实验未出现光抑制现象,可能是所设光照强度未达到生菜的光饱和点。
由图4可以看出蒸腾速率也随光照强度增强而上升,其可能的原因是光照强度增加导致光合速率增强,所需的二氧化碳增加,因此气孔导度变大以吸收更多的二氧化碳,而气孔导度的增加使得蒸腾速率上升。
3.3 产量与光能利用率
不同光照强度下生菜的产量情况及光能利用率见表1。

图1 红蓝LED下的生菜生长状况Fig.1 Grow th condition of lettuce under red-blue LEDs
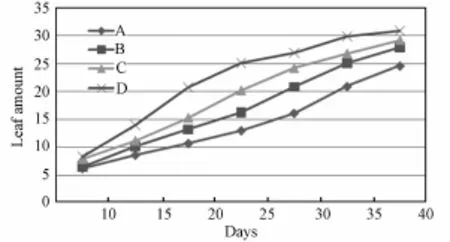
图2 不同光照强度下生菜叶片数比较Fig.2 Com parison of leaf numbers under different light intensities(A:300μmol·m-2·s-1;B:400μm ol·m-2·s-1;C:500μmol·m-2·s-1;D:600μmol·m-2·s-1)
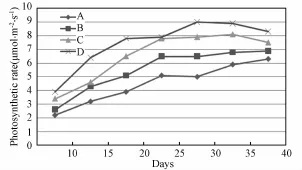
图3 不同光照强度下生菜光合速率对比Fig.3 Comparison of photosynthetic rates of lettuce under different light intensities(A:300μmol·m-2·s-1;B:400μm ol·m-2·s-1;C:500μmol·m-2·s-1;D:600μmol·m-2·s-1)
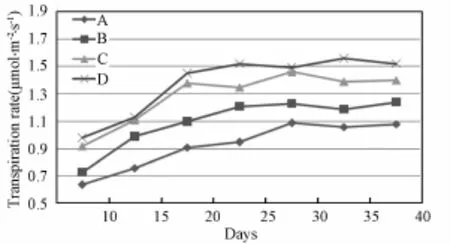
图4 不同光照强度下生菜蒸腾速率对比Fig.4 Com parison of transpiration rates of lettuce under different light intensities(A:300μmol·m-2·s-1;B:400μm ol·m-2·s-1;C:500μmol·m-2·s-1;D:600μmol·m-2·s-1)
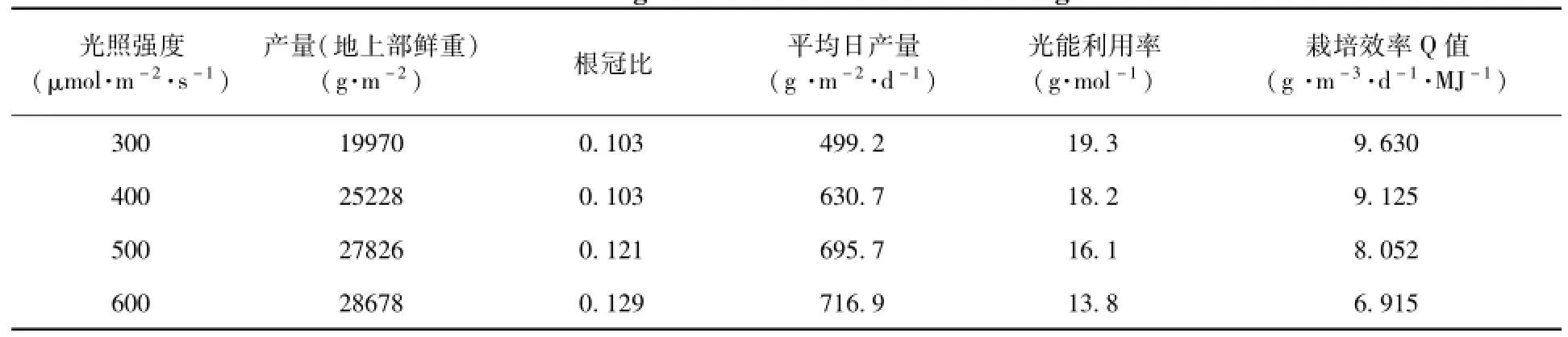
表1 不同光照强度下生菜产量及光能利用率对比Table 1 Yields and ligh t efficiencies under different light intensities
其中根冠比、日产量和光能利用率的定义如式(1)~(3)所示。

日产量用来衡量每平米生菜每天可为乘员提供多少新鲜蔬菜(收获后称量)。相比于总产量,日产量更能客观评价生菜的生产能力,因为时间成本也必须考虑,平均每天可提供多少蔬菜,对于空间飞行来说更有意义。光能利用率用来衡量植物对光能的利用效率,即光源每提供1 mol的光量子,生菜可积累多少干物质。光能利用率越高,能源利用率就越高,越有利于减少受控生态生保系统的能耗。
利用多项式对日产量及光能利用率随光照强度的变化趋势进行拟合,得拟合公式(4)和(5)。
式中,y—日产量,g·m-2·d-1;
e—光能利用率,g·mol-1;
L—光照强度,μmol·m-2·s-1。
对公式(4)求导数得式(6)。
y'=-0.004L+2.223(6)
式中,y'—光照强度增加1μmol·m-2·s-1时日产量的增加值。
光照强度对产量及光能利用率的影响规律如图5所示。
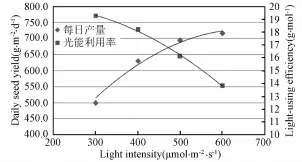
图5 光照强度对产量及光能利用率的影响规律Fig.5 Effects of light intensity on yield and light efficiency
光照强度逐渐增加时,生菜产量增加,但增幅越来越小。由公式(6)可得,光照强度达到556μmol·m-2·s-1时,y'为0,继续增加光照强度,不会对产量有所贡献。同时,光能利用率随着光照强度增加而下降。因此适当提高光照强度有利于生菜增产,但不利于能源的高效利用,高产与高效之间一定意义上是对立的。在四种不同的光照强度下,每平米生菜每天分别可生产新鲜蔬菜499.2 g、630.7 g、695.7 g和716.9 g。
通过公式(4)(5),可估算生菜在CELSS环境中不同光照强度下的产量和光能利用率,从而达到高产与高效之间的平衡。实际应用中,可根据需求调整光照强度,从而得到足够的产量和较高的光能利用率[15]。
除能耗及时间成本外,由于空间站或太空基地空间有限,空间利用率对于植物培养来说也非常重要。综合考虑能耗、培养周期及占用空间,可利用如式(7)所示空间植物栽培效率评价标准。
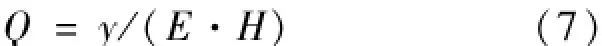
式中,Q—空间植物栽培效率,即单位时间,利用单位能耗,占用单位空间所得到的生菜产量,单位g·m-3·d-1·MJ-1
y—日产量,单位g·m-2·d-1;
E—能耗,单位MJ;
H—培养床高度,单位m。
该公式全面考虑了空间植物栽培中的各种资源投入与产出的关系,可有效评价系统的生产效率。其中,培养床高度为1 m,300μmol·m-2· s-1、400μmol·m-2·s-1、500μmol·m-2·s-1和600μmol·m-2·s-1的光源功率分别为600 W、800 W、1000 W和1200 W。
根冠比随着光照强度增加而增大。根冠比增大的原因,可能是光照强度增强导致蒸腾作用增强,生菜需水量增大,从而使得根系更加发达。
3.4 生长期的选择
生菜为叶用作物,因此其收获时间具有可选择性。生长期的长短可根据产量、营养品质等指标进行选择。前期植物培养试验中,生菜出苗后50天收获,光照强度为500μmol·m-2·s-1。本次试验设有生长期30天的对照试验,光照强度也为500μmol·m-2·s-1。对不同生长期的产量情况进行对比分析,结果如表2:
由表2可看出,虽然生长期为50天时,生菜的地上部鲜重高于生长期40天的生菜,但其日产量和光能利用率均低于生长期为40天的生菜。生长期为30天的生菜地上部鲜重、日产量和光能利用率均低于生长期为40天的生菜。生菜在生长期内的产量形成趋势及不同发育阶段的日产量见图6。

表2 不同生长期的生菜产量情况对比Table 2 Comparison of lettuce yieldswith different grow th stage
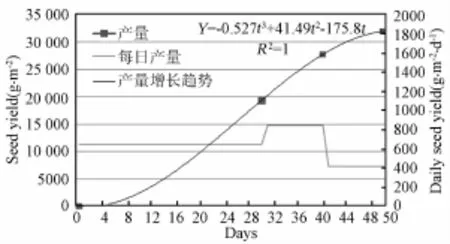
图6 生长期内生菜产量增长趋势及不同发育阶段日产量Fig.6 Yield increasing trend and daily yield at different stage of grow th stage
可以看出,生菜在出苗后30~40天内产量增长最快,日产量最高,这与光合速率变化趋势相一致。40~50天内产量增长最慢。对产量增长趋势进行多项式拟合,可得该环境下的产量形成公式(8)。
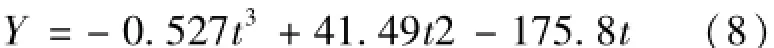
式中,Y—产量,g·m-2;t—生长时间,天;
不同生长期的生菜营养品质对比如表3所示。
由表3可看出,生长期为40天的生菜,其氮、磷、钾、钙和铁的含量均高于生长期为50天的生菜,而粗纤维、镁和锌的含量低于后者。总的来看,生长期为40天的生菜营养品质更好[16]。
综合分析,可以看出生长期为40天时,生菜的生产效率和营养品质都是最好的。虽然生菜在40~50天这段时间会继续积累一定的光合产物,但此时由于其已进入生长后期,各方面生理指标均已呈现衰老状态,因此其生产效率降低,从而使得其每日平均产量降低。且前期积累的营养物质部分流失,导致营养品质下降。从光合速率测试结果可看出,30~40天为生菜光合速率最高的阶段,生产效率也最高,因此,生长期为30天也不利于生菜的高效生产。
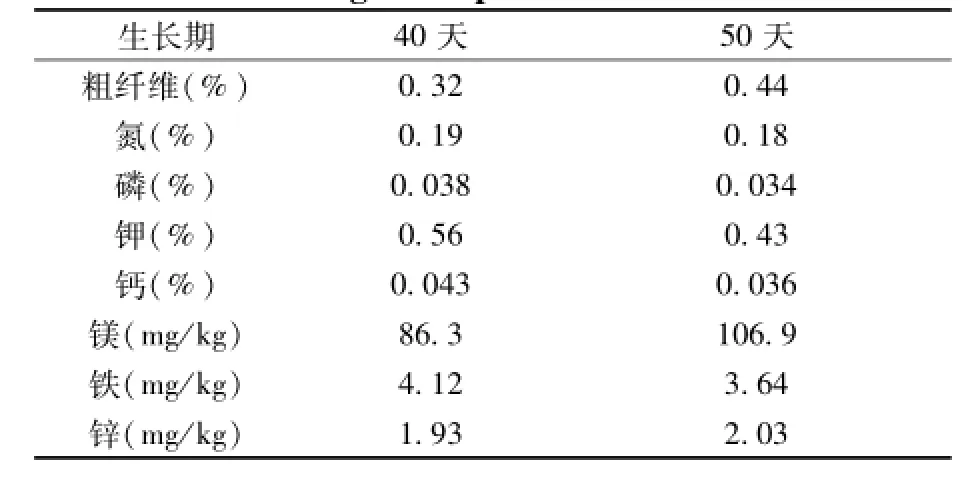
表3 不同生长期的生菜营养品质对比Table 3 Comparison of lettuce nutrition qualities w ith different grow th periods
4 结论与展望
生菜光合速率和蒸腾速率均随着光照强度的增加而上升。产量方面,生菜地上部鲜重随光照强度增加而上升,但增幅逐渐变小,光照强度达到556μmol·m-2·s-1时,继续增加光照强度产量不再增加。光能利用率随着光照强度的增加而降低。即适当增强光照强度有利于生菜的增产,但会降低其光能利用效率。
出苗后第40天为最佳收获期,此时收获,生菜的日产量和光能利用率最高,营养品质最好。
确定CELSS中生菜的最佳光照强度和生长期,对于提高生菜的生产效率和CELSS能源利用率具有重要意义。
在模拟CELSS环境下,利用红蓝LED作为光源,生菜可正常生长并形成较高产量,且营养品质良好,能作为CELSS构建的重要植物部件。
植物在整个生育期内生理特征不断变化,会影响整个系统的稳定性。食物及氧气供应的连续性对于CELSS的稳定运转非常重要,因此,在后续试验中应对生菜分批次培养方式进行探索。另外,在后续实验中,应开展其它品种的生菜培养研究,比较不同品种在CELSS环境下的生长状况和光能利用效率,筛选出最高效的品种作为CELSS的候选植物品种。
[1] Salisbury FB.Growing crops for space explorers on themoon,Mars,or in space[J].Adv Space Biol Med:1999,7:131-162.
[2] Wheeler R M,Stutte G W,Subbarao G V,et al.Plant growth and human life support for space travel[J].Handbook of plant and Crop Physiology,2001,2:925-941.
[3] Tibbits TW,Alford DK.Controlled ecological life support system.Use of higher plants[J].NASA Conf.Publ:1982,2231.
[4] Guo S,Tang Y,Gao F,etal.Effectsof low pressure and hypoxia on growth and development of wheat[J].Acta Astronautica,2008,63(7):1081-1085.
[5] 郭双生,唐永康,艾为党,等.受控环境中高CO2浓度条件下油麦菜生长特性研究[J].航天医学与医学工程,2010,23(2):100-106.
[6] Hoff JE,Howe JM,Mitchell CA.Nutritional and cultural aspects of plant species selection for a regenerative life support system[R].Report to NASA Ames Research Center,NSG2401 and NSG:1982,2404.
[7] Salisbury FB,Clark MA.Choosing plant to be grown in a controlled ecological life supportsystem(CELSS)based upon attractive vegetarian diets[J].Life Support and Biosphere Science,1996,2(2):169-179.
[8] 唐永康,郭双生,艾为党,等.不同比例红蓝LED光照对油麦菜生长发育的影响[J].航天医学与医学工程:2010, 23(3):206-212.
[9] Tang Y K,Guo SS,AiW D,et al.Effects of red and blue light emitting diodes(LEDs)on the growth and development of lettuce(var.Youmaicai)[J].SAE Technical paper series,2009,No.2009-01-2565.
[10] 郭双生,艾为党,赵成坚,等.受控生态生保系统中植物生长光源的选择[J].航天医学与医学工程,2003,16(增):490-494.
[11] 郭双生,董文平,艾为党,等,2人30天受控生态生保系统物质流调控技术研究[J].载人航天,2013,19(5):67-74. [12] da CA Alves P L,Magalhães A C N,Barja P R.The phenomenon of photoinhibition of photosynthesis and its importance in reforestation[J].The Botanical Review,2002,68(2):193-208.
[13] Krause G H.Photoinhibition of photosynthesis.An evaluation of damaging and protectivemechanisms[J].PhysiologiaPlantarum,1988,74(3):566-574.
[14] Zhu SQ,Zhao H,Liang JS,et al.Relationships between Phosphatidylglycerol Molecular Species of Thylakoid Membrane Lipids and Sensitivities to Chilling-induced Photoinhibition in Rice[J].Journal of integrative plant biology,2008,50(2):194-202.
[15] Perez LU,Miranda AJ.Lettuce production and antioxidant capacity are differentiallymodified by salt stress and light intensity under ambient and elevated CO2[J].JPlant Physiol,2013,170(17):1517-1525.
[16] 郭双生,艾为党,唐永康,等.密闭系统中四种共培养植物光合作用效率研究[J].航天医学与医学工程,2013,26(4):283-287.
Effects of the Red and Blue LED Light Intensity on Lettuce Grow thand Photosynthetic Ratein a Closed System
Shen Yunze1,Guo Shuangsheng2,AiWeidang2,Tang Yongkang2
(1.China Astronaut Research and Training Center,Beijing 100094,China;2.National Key Laboratory of Human Factors Engineering,China Astronaut Research and Training Center,Beijing 100094,China)
A lettuce cultivation experimentwas performed under different light intensitieswith 90% red+10%blue LEDs.Meanwhile,contrastexperimentswith differentgrowth period were set to determine the best time for harvest.As a result,the photosynthetic rate(Pn)and yield of lettuce rose as the light intensity elevated,but the rising extent was smaller and smaller.By polynomial curve fitting,we know thatwhen the light intensity reaches 556μmol·m-2·s-1,further increase of the light intensity won't raise the yield anymore.Meanwhile,when the light intensity increases,the light efficiency will decrease.So,at the premise that the demand for O2and food could be satisfied,selecting appropriate light intensity can raise the energy use efficiency.The yield per day,lightefficiency and nutrition quality of lettuce with a growth period of40 dayswere the best.Thus harvesting the lettuce at the 40th day is themost efficient.
CELSS;lettuce;light intensity;photosynthetic rate;light efficiency;growth period
V423.7;Q693
A
1674-5825(2014)03-0273-06
2013-12-23;
2014-04-27
中国航天医学工程预先研究项目(2010SY5404001)
沈韫赜(1989-),男,硕士,研究方向为载人深空探测生命保障技术。E-mail:feihu0714@126.com

