脂多糖应答基因对神经元细胞类缺血再灌注损伤的影响
巩固 袁利邦 殷亮 蔡琳 吴畏 胡玲
脂多糖应答基因对神经元细胞类缺血再灌注损伤的影响
巩固 袁利邦 殷亮 蔡琳 吴畏 胡玲
目的 研究神经元细胞中脂多糖应答基因(LRG)的表达对细胞类缺血再灌注损伤的影响。方法将小鼠神经元细胞分为对照组和处理组,处理组给予体外类缺血再灌注处理,采用定量PCR(qPCR)和Western blot的方法检测细胞中LRG基因的表达。将原代培养的神经元细胞分为空白组、空载质粒组、过表达组、非特异小干扰RNA(siRNA)组、沉默组,过表达组/沉默组转染LRG基因过表达质粒或siRNA,采用噻唑蓝(MTT)法检测细胞经类缺血再灌注后的生长状况,同时利用Western blot分析细胞中活化蛋白激酶B(p Akt)的表达。将原代培养的神经元细胞再分为阴性对照组、过表达组和抑制剂组,抑制剂组利用20μmol/L LY294002抑制细胞中磷脂酰肌醇-3激酶(PI3K)的正常功能,MTT法分析过表达LRG基因的细胞体外生长状况,同时利用Western blot方法分析细胞中活化的半胱氨酸天冬氨酸蛋白酶(caspase)3的表达。结果 与对照组相比,类缺血再灌注处理显著降低细胞中LRG基因的表达(<0.05)。过表达LRG基因可显著提高缺血再灌注损伤细胞在体外的存活(<0.05),而沉默LRG基因则降低细胞的存活(<0.05)。同时,过表达LRG基因上调细胞中p Akt的表达而沉默LRG基因则下调p Akt的表达(<0.05)。抑制神经元细胞中PI3K可降低缺血再灌注损伤后细胞的存活率(<0.05),并且提高细胞中活化caspase 3的表达(<0.05)。结论 在神经元细胞中过表达LRG能通过激活PI3K/Akt信号途径降低细胞在类缺血再灌注中的损伤。
神经元细胞;脂多糖应答基因;1-磷脂酰肌醇3-激酶;活化蛋白激酶B;再灌注损伤
脂多糖应答基因(lipopolysaccharide response gene,LRG)是最早由人牙髓细胞差异表达、基因文库中筛选出来的基因,在多个器官中均有表达[1-2]。研究发现LRG的表达与脑缺血耐受、神经元细胞保护有关[3]。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)是细胞中重要的信号传递分子,能够通过磷酸化下游的蛋白激酶B(protein kinase B,PKB/Akt)传递信号[4]。PI3K/Akt的激活能对神经元细胞产生保护作用[5-6]。本研究通过在神经元细胞中过表达LRG基因,探讨LRG对类缺血再灌注处理神经元细胞的保护作用以及与PI3K/Akt的作用关系,为阐明LRG在诱导脑缺血耐受中的作用机制提供依据。
1 材料和方法
1.1 材料 新生24 h内SPF级C57BL/6J小鼠雌雄各30只,购自上海斯莱克实验动物有限公司。
1.2 主要试剂 胎牛血清、细胞培养基、Dy NAmo SYBR Green qPCR试剂盒、脂质体(Lipofectamine 2000TM)均为美国Invitrogen公司产品,辣根过氧化物酶标记的羊抗兔二抗和胰蛋白酶购自美国Sigma公司,兔抗LRG抗体、兔抗p Akt抗体、兔抗cleavage caspase 3抗体、兔抗β-actin抗体均为美国Santa Cluz公司产品。
1.3 方法
1.3.1 神经元的原代培养:取新生24 h内的小鼠,经75%(体积分数)乙醇消毒后断头取脑,分离脑海马组织,用0.25%(质量浓度)的胰酶结合机械吹打的方法制备单细胞悬液,调节细胞水平至106/m L,种板,于37℃,5%(体积分数)CO2培养箱中培养。24~48 h后首次全量换液,培养到第3~4天。加入阿糖胞苷(终浓度为10μmol/L)抑制胶质细胞生长,纯化神经元。作用1~2 d后全量换液,以后每周换液2~3次,每次半量换液。
1.3.2 神经元类缺血再灌注处理:将原代培养的细胞分为对照组和处理组,类缺血再灌注按文献[7]方法操作:将培养的神经元细胞或基因沉默/过表达的神经元细胞移入37℃恒温密闭容器中,连续充以95%(体积分数)NO2+5%(体积分数) CO2混合气体,流速为20 m L/min,持续30 min,然后复氧24 h。
1.3.3 重组质粒的构建与转染:根据LRG基因序列,用含有HindⅢ和Bam HⅠ酶切位点的引物扩增LRG基因,将扩增产物克隆到p3XFlag-CMV过表达质粒中。
1.3.4 siRNA的合成:根据LRG基因序列分别合成siRNA,并设计非特异性siRNA为阴性对照,siRNA序列由Invitrogen合成。
1.3.5 细胞转染:为研究LRG基因表达变化对神经元细胞存活及相关基因活化的影响,将原代培养的神经元细胞分为空白组、空载质粒组、过表达组、非特异siRNA组和沉默组。转染组24孔培养板中接种1×106神经元细胞,去除旧培养基,加入500μL DMEM培养基。取5μL脂质体Lipofectamine 2000TM稀释到250μL减血清培养基(minimum essential media,MEM)中,轻轻混匀,室温孵育5 min;然后加入1.0μg重组质粒或30 pmol siRNA,室温孵育20 min。吸取50μL重组质粒-Lipofectamine或siRNA-Lipofectamine复合物加入到细胞培养孔中,轻轻摇动混匀,于37℃, 5%(体积分数)CO2恒温箱培养24 h。各组原代培养的神经元细胞转染后进行类缺血再灌注处理。为研究PI3 K的功能,研究将原代培养的神经元细胞分为阴性对照组、过表达组和抑制剂组,抑制剂组中细胞培养基中添加20μmol/L LY294002进行处理。各组细胞转染或加抑制剂处理24 h后进行类缺血再灌注处理。
1.3.6 细胞生长检测:采用噻唑蓝﹝3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT﹞法检测细胞生长。收集培养的神经元细胞,按每孔6×104个接种于96孔培养板,首先按步骤转染过表达质粒或siRNA,然后进行MTT实验。MTT实验检测分别在细胞培养24 h、48 h、72 h和96 h后进行。按实验分组每孔加入20μL MTT(5 mg/m L)后培养4 h。去掉上清,按照每孔150μL加入二甲基亚砜(dimethyl sulfoxide,DMSO)。混匀后用酶标仪(Bio-tek Instruments/USA)测定(测量波长为490 nm)。实验重复3次,取平均数作为实验结果。
1.3.7 q RT-PCR检测基因表达水平:利用RNASolve Reagent试剂盒提取神经元总RNA,合成cDNA。利用cDNA进行LRG基因片断扩增,引物按照Gen Bank登录号AF143740设计,P1:5′-CATGGCGACGCGGGTAGAGG-3′,P2:5′-CACATCAAGGAACCATCGTC-3′。内参β-actin引物为:P1:5′-ATGGATGACGTATCGCTG-3′, P2:5′-ATGAGGTAGTTGTCAGGT-3′。扩增结束后将PCR产物纯化、测序,采用DNAMAN分析软件进行序列分析。采用DNA Engine OpticonTM2荧光检测系统和Dy NAmo SYBR Green qPCR试剂盒进行基因表达的测定。基因表达定量分析采用相对标准曲线法,目的基因和β-actin基因的拷贝数分别根据产生的Ct值从各自的标准曲线获得。
1.3.8 Western blot检测蛋白表达:提取神经元细胞总蛋白,取30μg蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。电泳结束后,将凝胶上的蛋白转移到硝酸纤维素膜上,并用1%丽春红染色检测转移效果。将膜放在10 m L封闭液中(2%脱脂奶粉)1 h;加入一抗(兔抗鼠多克隆抗体,1∶1000),4℃过夜孵育;加入二抗(酶标羊抗兔单抗1∶10000)室温孵育2 h,化学发光(ECL),暗盒曝光。胶片拍照,用凝胶图像分析系统分析,比较LRG、p Akt或caspase 3与βactin条带的相对积分吸光度﹝(λ)﹞值。
1.4 统计学处理 采用SPSS 13.0统计软件和Excel软件对实验数据进行分析。数据以表示,两组均数间比较采用 检验,多组均数间的比较采用单因素方差分析和两两比较(LSD法),以<0.05为差异有统计学意义。
2 结果
2.1 类缺血再灌注抑制小鼠神经元细胞LRG基因的表达 小鼠神经元细胞复氧24 h后,与对照组相比,类缺血再灌注处理显著降低神经元细胞LRG mRNA(<0.05)和蛋白的表达水平(<0.05)(图1,表1)。
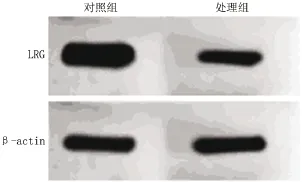
图1 小鼠海马类缺血再灌注神经元LRG基因的表达(Western blot)
表1 小鼠海马类缺血再灌注神经元LRG mRNA及蛋白相对表达水平分析 (±)
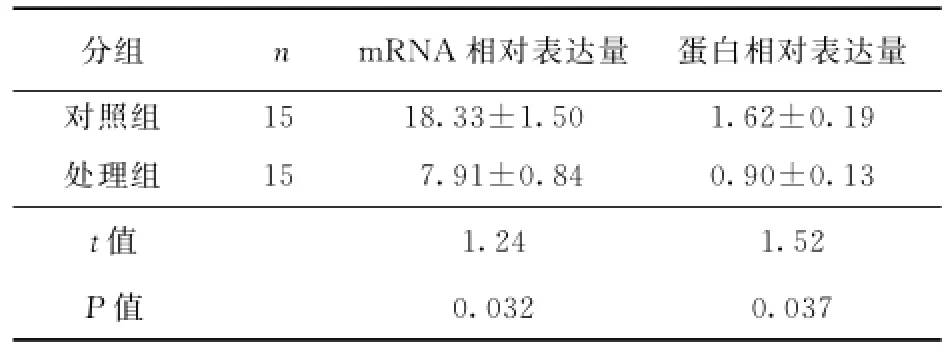
表1 小鼠海马类缺血再灌注神经元LRG mRNA及蛋白相对表达水平分析 (±)
分组mRNA相对表达量 蛋白相对表达量对照组 15 18.33±1.50 1.62±0.19处理组 15 7.91±0.84 0.90±0.13值1.24 1.52值0.032 0.037
2.2 过表达/沉默LRG基因对类缺血再灌注神经元细胞存活率的影响 过表达LRG基因可明显提高神经元细胞在类缺血再灌注处理后24 h、48 h、72 h和96 h中的存活率(=28.61,= 0.012;=18.27,=0.015;=23.48,= 0.013;=17.64,=0.015)(图2),而LRG基因沉默则降低细胞的存活(=32.87,=0.009;=30.13,=0.009;=22.86,=0.011;= 14.97,=0.013)(图3)。
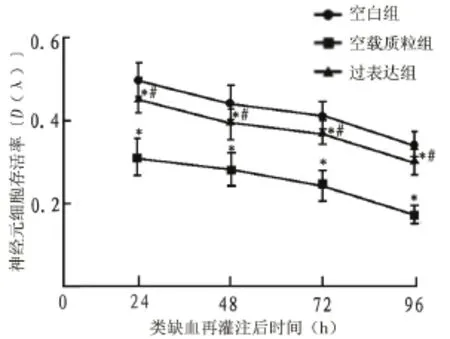
图2 过表达LRG基因对小鼠类缺血再灌注神经元细胞生长的影响(MTT试验)
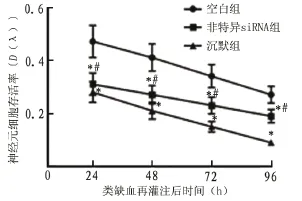
图3 沉默LRG基因对小鼠海马类缺血再灌注神经元细胞生长影响(MTT试验)
2.3 过表达/沉默LRG基因促进/抑制Akt蛋白活化 过表达组细胞p Akt及Akt相对表达量显著上调,而基因沉默组神经元细胞其表达则明显降低(图4、表2)。
2.4 抑制PI3 K的活化降低受损神经元细胞的存活率 与阴性对照组以及过表达LRG基因组相比,抑制PI3K显著降低细胞类缺血再灌注后24、48、72和96 h中的存活率(=27.83,=0.014;=31.21,=0.013;=28.91,=0.014;=13.46,=0.018)(图5)。

图4 小鼠脑海马过表达或沉默LRG基因对细胞p Akt蛋白的影响(Western blot)

表2 小鼠脑海马过表达或沉默LRG基因神经元中p Akt和Akt蛋白表达 (±)
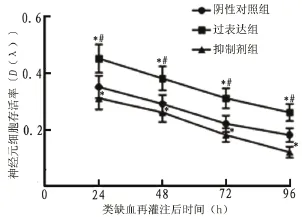
图5 抑制PI3K对小鼠海马类缺血再灌注神经元细胞生长的影响(MTT试验)
2.5 抑制PI3K提高受损神经元细胞中caspase 3的表达 进一步向细胞中添加PI3 K抑制物LY294002进行处理,同时过表达LRG基因,经类缺血再灌注处理24 h后检测活化的caspase 3基因的表达。结果显示,与阴性对照组及过表达组相比,抑制PI3 K显著上调神经元细胞中裂解caspase 3的表达(图6、表3)。

图6 抑制PI3K对小鼠海马类缺血再灌注神经元细胞中caspase 3基因表达(Western blot)
表3 抑制PI3K小鼠海马类缺血再灌注神经元细胞中caspase 3蛋白定量分析 )

表3 抑制PI3K小鼠海马类缺血再灌注神经元细胞中caspase 3蛋白定量分析 )
注:与阴性对照组比较,*<0.05;与过表达组比较,#<0.05
分组 Procaspase 3相对表达量 Cleavage caspase 3相对表达量阴性对照组 0.81±0.09 1.78±0.21过表达组 1.70±0.20* 0.75±0.09*抑制剂组 0.78±0.08# 1.82±0.23#值11.06 15.23值0.024 0.021
3 讨论
LRG是一种脂多糖(LPS)应答基因,在心、脑等多种组织中均有表达[2]。本研究结果显示类缺血再灌注处理可明显降低LRG基因在小鼠海马神经元细胞的表达,过表达LRG则明显提高细胞类缺血再灌注处理后的体外存活率,然而利用特异siRNA沉默细胞LRG后,则导致细胞类缺血再灌注处理后体外存活率显著降低,进一步表明过表达LRG对神经元细胞的保护作用,而沉默LRG基因则失去这种保护作用。
目前对于原代神经元细胞的脂质体转染效率没有统一定论。苗宏生等[8]认为,相比于电穿孔转染法,脂质体DOTAP和LipofectamineTM转染效率显著较低,却对细胞的损伤较小。Ohki等[9]利用脂质体LipofectamineTM、LipofectamineTMPlus和Lipofectamine 2000TM介导对原代皮层和海马神经元的转染发现Lipofectamine 2000TM显著提高转染效率且对细胞伤害较小。本研究采用Lipofectamine 2000TM介导重组质粒的转染,转染效率较为理想。
前期研究发现LPS预处理可诱导LRG在细胞中的表达,进而改善多种器官(心脏、脑)缺血再灌注损伤后的致炎-抑炎因子之间的失衡,抑制促炎症细胞因子的大量产生,诱导抗炎症因子的释放,减少缺血再灌注损伤[10]。然而,目前对于LRG基因对神经元保护的具体作用机制尚不清楚。本研究结果显示,LRG能够促进细胞中PI3K的活性,促进p Akt表达,而沉默LRG则导致p Akt表达减少。PI3 K/Akt信号通路是调节细胞中炎症因子表达的重要途径[11-12]。在单核细胞中, PI3K-Akt途径的活化能够抑制LPS诱导的炎症因子的释放,抑制PI3 K导致内毒素中毒小鼠存活率下降[13]。在神经元细胞中,PI3K/Akt抑制LPS诱导的诱导型一氧化氮合成酶活化以及NO的产生[14],并 提高 抗 凋 亡 作 用[15]。本 研 究 利 用LY294002抑制PI3K的功能,结果发现LRG基因失去对类缺血再灌注处理中神经元的保护作用,表明PI3K是LRG基因发挥保护作用所必需的。
细胞中caspase 3的活化是诱导细胞凋亡的关键步骤[16-17]。本研究结果发现类缺血再灌注处理后Cleavage caspase 3表达明显升高,表明抑制PI3K能够增加神经元在类缺血再灌注后的凋亡,同时也表明抑制PI3K使LRG失去对细胞的保护作用。
综上所述,类缺血再灌注能够诱导细胞损伤并降低神经元细胞中LRG基因的表达,而过表达LRG基因能诱导对神经元的保护作用,并且这种保护作用是通过激活PI3 K/Akt信号途径来进行的,抑制PI3 K的功能可阻碍LRG的作用并提高神经元凋亡水平。缺血耐受涉及到神经元细胞中各种基因以及信号分子间的相互作用[18-19],对于LRG基因是如何诱导对细胞的保护作用还需进一步实验研究。
[1]杜可军.人lrg真核表达载体的构建和初步分析[J].牙体牙髓牙周病学杂志,2004,14(4):179-184.
[2]巩固,熊利泽.内毒素诱导lrg表达对大鼠急性心肌缺血再灌注损伤的保护作用机制研究[J].心脏杂志,2010,22(3):357-360.
[3]宋庆贺,于欣平,陈苏民.人Lrp蛋白在细胞中的定位及LPS对其表达的影响[J].中国生物化学与分子生物学报,2006, 22(7):542-546.
[4]Schultze SM,Hemmings BA,Niessen M,et al.PI3K/AKT, MAPK and AMPK signalling:protein kinases in glucose homeostasis[J].Expert Rev Mol Med,2012,14:e1.
[5]Kitagishi Y,Matsuda S.Diets involved in PPAR and PI3K/ AKT/PTEN pathway may contribute to neuroprotection in a traumatic brain injury[J].Alzheimers Res Ther,2013,5(5):42.
[6]Zhang B,Ji X,Zhang S,et al.Heminmediated neuroglobin induction exerts neuroprotection following ischemic brain injury through PI3K/Akt signaling[J].Mol Med Rep,2013,8 (2):681-685.
[7]任宇虹,刘西南,周柏玉.芍药甙对大鼠海马神经元的保护作用[J].第四军医大学学报,2006,27(16):1480-1482.
[8]苗宏生,余路阳,林波,等.原代大鼠海马神经元的高效转染[J].细胞生物学杂志,2004,26(3):305-308.
[9]Ohki EC,Tilkins ML,Ciccarone VC,et al.Improving the transfection efficiency of post-mitotic neurons[J].J Neurosci Methods,2001,112(2):95-99.
[10]秦明哲,李树志,侯立朝.TNF-α对人lrg基因表达的调控[J].第四军医大学学报,2009,30(1):11-13.
[11]Zheng Y,Yang Y,Li Y,et al.Ephedrine hydrochloride inhibits PGN-induced inflammatory responses by promoting IL-10 production and decreasing proinflammatory cytokine secretion via the PI3K/Akt/GSK3beta pathway[J].Cell Mol Immunol,2013,10(4):330-337.
[12]Jin YJ,Lee JH,Kim YM,et al.Macrophage inhibitory cytokine-1 stimulates proliferation of human umbilical vein endothelial cells by up-regulating cyclins D1 and E through the PI3K/Akt-,ERK-,and JNK-dependent AP-1 and E2F activation signaling pathways[J].Cell Signal,2012,24(8):1485-1495.
[13]Schabbauer G,Tencati M,Pedersen B,et al.PI3K-Akt pathway suppresses coagulation and inflammation in endotoxemic mice[J].Arterioscler Thromb Vasc Biol,2004,24 (10):1963-1969.
[14]Xing B,Xin T,Hunter RL,et al.Pioglitazone inhibition of lipopolysaccharide-induced nitric oxide synthase is associated with altered activity of p38 MAP kinase and PI3K/Akt[J].J Neuroinflammation,2008,5:4.
[15]Wang X,Zhang X,Cheng Y,et al.Alpha-lipoic acid prevents bupivacaine-induced neuron injury in vitro through a PI3K/Akt-dependent mechanism[J].Neurotoxicology, 2010,31(1):101-112.
[16]Snigdha S,Smith ED,Prieto GA,et al.Caspase-3 activation as a bifurcation point between plasticity and cell death[J]. Neurosci Bull,2012,28(1):14-24.
[17]D’amelio M,Sheng M,Cecconi F.Caspase-3 in the central nervous system:beyond apoptosis[J].Trends Neurosci, 2012,35(11):700-709.
[18]Chouker A,Ohta A,Martignoni A,et al.In vivo hypoxic preconditioning protects from warm liver ischemia-reperfusion injury through the adenosine A2B receptor[J].Transplantation,2012,94(9):894-902.
[19]Van Winkle JA,Chen B,Lei IF,et al.Concurrent middle cerebral artery occlusion and intra-arterial drug infusion via ipsilateral common carotid artery catheter in the rat[J].J Neurosci Methods,2013,213(1):63-69.
GONG Gu,Email:gugongcd@163.com
Objective To investigate the effect of lipopolysaccharide respond gene(LRG)on neuron ischemia-reperfusion injury.Methods Cultured neurons were challenged with ischemia-reperfusion condition, and LRG expression were detected by qPCR and Western blot.LRG overexpression plasmid or specific siRNA were transferred into neurons prior to ischemia-reperfusion and cell survival was detected by 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)assay.Meanwhile,the expression of phosphated Akt was analyzed by Western blot.Furthermore,specific phosphatidylinositol-3-kinase(PI3 K) inhibitor(LY294002,20μmol/L)was added in LRG overexpressed neurons,and cell survival was determined with MTT assay.In addition,active caspase 3 was analyzed by Western blot.Results Ischemia-reperfusion conditioning significantly decreased LRG expression in neurons(<0.05).LRG overexpression promoted survival of neurons while knockdown of LRG led to a decreased survival(<0.05).Furthermore,LRG overexpression evidently up-regulated the expression of phosphated Akt(<0.05).Besides,inhibition of PI3K contributed to a lower survival(<0.05)and an augmented expression of active caspase 3 in neurons(<0.05).Conclusions Overexpression of LRG in neuron may attenuate ischemia-reperfusion injury through PI3K/ Akt pathway.
neuron;lipopolysaccharide respond gene;1-phosphatidylinostol 3-kinase;activated protein kinase;reperfusion injury
R741.02
:A
:1006-2963(2014)05-0335-05

2013-11-24)
(本文编辑:时秋宽)
10.3969/j.issn.1006-2963.2014.05.008
四川省卫生厅课题资助项目(110469)
610083成都军区总医院麻醉科
巩固,Email:gugongcd@163.com
——一道江苏高考题的奥秘解读和拓展

