EAE大鼠不同时间β-淀粉样前体蛋白与Nogo蛋白受体表达的相关性
杨洁 高聪 区腾飞 黄莉 陈梦宇 郑扬波 谢富华
EAE大鼠不同时间β-淀粉样前体蛋白与Nogo蛋白受体表达的相关性
杨洁 高聪 区腾飞 黄莉 陈梦宇 郑扬波 谢富华
目的 探讨β-淀粉样前体蛋白(β-APP)及Nogo蛋白受体(Ng R)在实验性自身免疫性脑脊髓炎(EAE)模型大鼠病程中的表达变化及相互关系。方法 建立EAE动物模型,于致敏第8天、致敏第21天、致敏第35天利用免疫组织化学方法观察脑组织中β-APP及NgR表达,并进行相关性分析。结果 EAE致敏第8天、第21天及第35天组及空白对照组脑组织中β-APP表达灰度值分别为67.94±7.23、29.86±4.02、74.94± 8.16和117.25±10.11,四组间比较差异有统计学意义(=76.1,<0.05),各实验组β-APP表达灰度值均低于对照组(均<0.05),致敏第21天组低于致敏第8天组(=0.008),致敏第35天组高于致敏第21天组(=0.005),与致敏第8天组差异无统计学意义(=0.379);相应时间点脑组织中Ng R表达灰度值分别为90.28 ±8.74、76.75±6.59、77.64±9.58及45.33±5.26,四组间比较差异有统计学意义(=11.56,<0.05),各实验组NgR表达灰度值均高于对照组(均<0.05),致敏第35天组低于致敏第8天组(=0.049),致敏第8天组、致敏第35天组与致敏第21天组比较差异均无统计学意义(=0.055,=0.975)。β-APP及NgR表达水平呈负相关(=-0.207,<0.05)。结论 轴索损伤可能在EAE早期即已出现,并呈动态变化。β-APP与NgR表达在EAE的病理进展过程中呈负相关。
β-淀粉样前体蛋白;Nogo蛋白受体;实验性自身免疫性脑脊髓炎;轴突生长抑制
轴索损害是多发性硬化(multiple sclerosis, MS)最早期及进展严重的表现,是MS永久残疾的重要病理因素[1]。β-淀粉样前体蛋白(β-APP)积聚在MS患者脱髓鞘斑形成的早期即可出现,被认为是轴索损害的一个特征性标志。轴索生长抑制因子受体Nogo蛋白受体(NgR)是介导神经轴索生长抑制的跨膜信号。既往研究表明NgR可能通过增加阿尔茨海默病动物模型中的β-APP表达而加重淀粉样斑的形成[2]。但二者在MS动物模型实验性自身免疫性脑脊髓炎(EAE)中是否有相似的变化,目前尚无研究证实。本研究拟通过观察β-APP及NgR在EAE模型大鼠中的表达及两者的关系,为探索轴索损伤及轴索生长抑制在EAE不同病理过程中的机制奠定基础。
1 材料和方法
1.1 实验动物与分组 雌性Lewis大鼠(SPF级)96只,体质量180~230 g,由北京维通利华实验动物中心提供﹝许可编号SCXK(京)2007-0001﹞;豚鼠(清洁级)18只,雌雄不限,体质量250~300 g,由广东省实验动物中心提供。
1.2 主要药品与试剂 不完全福氏佐剂(IFA) (北京鼎国生物技术有限公司);吸附无细胞白百破联合疫苗(武汉生物制品研究所);卡介苗(上海生物制品研究所);兔抗β-APP及NgR一抗(英国Abcam公司);UltraSensitiveTMS-P试剂盒和DAB(二氨基联苯胺)显色液(福州迈新生物技术开发公司)。诱导乳剂的制备:豚鼠经麻醉后处死,行心脏灌注术。迅速在冰上取脑和脊髓,剪取白质。按1 g白质加1 m L磷酸盐缓冲液(PBS)的比例,在冰盒中制成牛乳样匀浆,与等体积完全福氏佐剂(CFA)充分混匀制成。CFA由IFA与100 mg/m L卡介苗按体积比3∶1比例混匀而成。
1.3 EAE模型建立 将大鼠分为EAE致敏8天组、致敏21天组、致敏35天组及空白对照组(对照组)4组,每组24只。参照文献[3]的方法建立大鼠EAE模型。按体质量0.35 g/kg予10%(质量分数)水合氯醛腹腔注射麻醉大鼠。按体质量0.12 m L/100 g比例于EAE致敏8天组、致敏21天组、致敏35天组每只实验动物双后足垫皮下注射诱导乳剂,并在实验动物后足垫背面真皮内注射0.2 m L吸附无细胞白百破联合疫苗。致敏当天记为第0天。每天称体质量,观察动物反应是否灵敏,进食水情况,大小便情况,尾部与肢体力量等,并参考Knono等标准[4],进行神经功能缺损评分,将病情严重程度分为5级(1~5分)。Ⅰ级:动物尾部无力;Ⅱ级:尾部无力+肢体无力;Ⅲ级:肢体轻度麻痹;Ⅳ级:肢体严重麻痹,被动翻身后不能复原;Ⅴ级:濒死状态。神经功能缺损评分Ⅱ级及其以上为建模成功,其中评分Ⅲ级及以上为发病高峰期。对照组大鼠仅于致敏当天双后足垫皮下注射CFA。
各模型组按建模标准随机选取8只大鼠处死取脑组织,对照组在各模型组取材时间点分别选取8只大鼠取脑组织。余实验动物均在致敏后第70天过量麻醉处死。
1.4 免疫组织化学染色 各模型组分别于相应时间点取大鼠各8只,对照组在各模型组取材时间点分别选取8只,处死取脑组织,以甲醛固定,置-20℃恒温冷切片机连续冠状切片,片厚约20 μm,采用漂浮染色法进行免疫组化染色。所需一抗为兔抗β-APP(1∶400)和Ng R(1∶400)。冷冻切片入漂洗盒,PBS反复换洗,加入过氧化物酶阻断剂室温下振荡孵育30 min;PBS反复换洗5次后加入健康人非特异性血清室温下振荡孵育60 min;同组实验动物标本分为2组,分别加入上述一抗,室温下振荡60 min后,放入4℃冰箱中孵育过夜;从4℃冰箱中取出置室温60 min;PBS反复换洗后加入生物素标记的羊抗兔IgG(二抗)在室温下振荡孵育45 min;PBS反复换洗后加入链霉素抗生物素-过氧化物酶溶液室温下振荡孵育30 min;DAB液显色,贴片,脱水,透明,中性树脂封片镜检。随机选取每组切片各12张,置200倍显微镜下随机选取5个不相重复的视野,采用Adobe Photoshop CS3 10.0图像处理软件进行灰度转换,用ImageJ 1.37V图像分析软件计算β-APP及NgR阳性细胞灰度值作为β-APP及NgR相对表达水平,计算平均值,并分析两者的相关性。β-APP及NgR阳性细胞胞浆呈棕褐色,其灰度值越高,相应β-APP及Ng R表达水平越高。
1.5 统计学处理 采用SPSS16.0统计软件进行分析。神经功能评分、β-APP及NgR相对表达水平(即APP和NgR蛋白阳性细胞灰度值)以均数±标准差表示。β-APP及NgR相对表达多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用SNK-检验;β-APP及NgR表达的相关性分析采用Spearman秩相关检验。检验水准α=0.05,双侧检验。
2 结果
2.1 神经功能缺损评分 大鼠致敏后出现精神萎靡、食欲减退、皮毛不光滑、体重下降,致敏大鼠最早于致敏后第16天发病,最晚于致敏后第20天出现尾部张力减低、尾部无力。致敏第21天组动物的临床症状达到高峰期,多数动物均出现双后肢及尾部无力,尿便失禁,功能缺损评分为(4.16±0.54)。之后,动物临床症状逐渐缓解,约于致敏后第35天恢复完全,无一因病情危重而死亡,呈明显的单向病程。对照组动物无一发病。
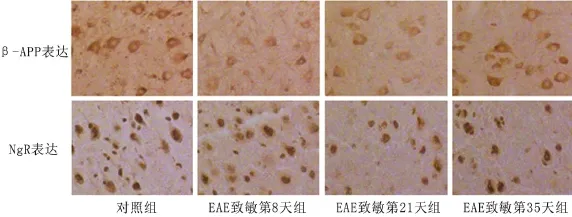
图1 各组大鼠脑组织皮层β-APP及NgR表达(免疫组化×200)
2.2 β-APP表达 对照组大鼠皮层阳性细胞染色较深(图1)。其中致敏第21天组脑组织中阳性细胞水肿明显,细胞轮廓模糊,阳性细胞淡染,致敏第8天组、致敏第35天组两组细胞形态正常。各实验组β-APP表达灰度值与空白对照组四组间比较差异有统计学意义(=76.1,<0.05);各实验组β-APP表达灰度值均低于对照组(均<0.05),致敏21天组低于致敏8天组(=0.008);致敏35天组高于致敏21天组(=0.005),而与致敏8天组差异无统计学意义(=0.379)(表1)。
表1 各组大鼠β-APP及Ng R表达灰度值比较 ()

表1 各组大鼠β-APP及Ng R表达灰度值比较 ()
注:与对照组比较,*<0.05;与致敏8天组比较,△<0.05;与致敏21天组比较,#<0.05
组别 β-APP NgR EAE致敏第35天组 74.94±8.16*#77.64±9.58*△EAE致敏第21天组 29.86±4.02*△ 76.75±6.59*△EAE致敏第8天组 67.94±7.23* 90.28±8.74*对照组 117.25±10.11 45.33±5.26
2.3 NgR表达 对照组大鼠脑组织皮层阳性细胞染色较浅,分布呈弥漫性(图1)。EAE各模型组中脑组织皮层阳性细胞染色均较深,其中致敏第8天组与致敏第21天组两组差别较小,致敏第35天组明显深染。脑组织中Ng R表达灰度值各组间比较差异有统计学意义(=11.56,<0.05);各实验组Ng R表达灰度值均高于对照组(均<0.05),致敏第35天组低于致敏第8天组(= 0.049),致敏第8天组、致敏第35天组与致敏第21天组比较差异无统计学意义(=0.055,= 0.975)(表1)。
3 讨论
本研究中根据EAE病程,选择EAE致敏第8、21及35天对应EAE病程的炎性反应初期、高峰期及恢复期的β-APP和NgR表达变化进行观察。
3.1 β-APP在EAE不同病理过程中的表达Tomimoto等[5]对沙土鼠脑中β-APP进行超微定位,显示增多的β-APP免疫活性局限于肿胀的轴索、营养不良的神经元轴索和神经元核周体中。Murakami等[6]研究显示β-APP不仅在损伤灶及其周围表达,亦可在远离损伤灶的海马表达,并可导致部分神经元死亡。上述研究均提示β-APP在其他神经损伤模型中与轴索损伤有关,但既往的研究对β-APP在EAE不同发病时程中的表达尚未完全明确。既往EAE模型的病理学研究发现在炎性反应初期即出现片状轴索脱失区域[7]。本实验中EAE第8天组β-APP在脑组织中的表达最高,也提示EAE急性期即出现轴索损伤。本研究表明EAE第21天组β-APP表达最低,提示此期轴索损伤较轻微,但既往银染却在此期显示更多的轴索脱失和损伤区域[7]。出现这种矛盾结果的可能原因为:EAE模型组脑组织由于弥漫性炎性反应,细胞变性水肿导致了胞内多种蛋白质的合成和分泌障碍而致使β-APP表达下降。进入恢复期后,即EAE第35天组,APP的表达又有所升高,但仍低于正常水平,这可能是由于炎性反应消退,蛋白合成和分泌功能有所恢复,而影响因素尚未未彻底消除,因此APP表达并未恢复正常。
综上,MS发病初期可能即有轴索损伤,若在MS发病早期能及时给与保护轴索的治疗,有可能阻止或延缓功能缺失进展,从而减少永久性功能缺损,这具有非常重要的意义,需进一步研究。
3.2 NgR在EAE动物模型中表达及其与β-APP的关系 目前已确认的中枢神经髓鞘来源的抑制因子均为NgR的配体。当髓鞘源性的抑制因子与NgR结合后,激活下游抑制通路,最终导致轴索再生障碍[8]。使用NgR阻滞剂可以局限EAE模型动物的轴索损伤程度[9]。作为轴索急性损伤的标记蛋白β-APP和轴索再生抑制的标记物NgR,两者在EAE模型中共表达及相关性分析可用于评价轴索再生抑制与轴索损伤可能的相互关系,但此前尚未有关于两者的关系研究报道。
本研究结果显示,NgR灰度值在EAE致敏第8天组(90.28±8.74)较对照组(45.33±5.26)升高,在EAE致敏第21天组(76.75±6.59)较EAE致敏第8天降低但未达统计学差异,而后在致敏第35天组(77.64±9.58)没有明显变化。对于恢复期的NgR持续高表达,其结果与既往的研究相似。如Satoh等[10]在慢性MS患者的活动病灶中发现,NgR mRNA及NgR在反应性星形胶质细胞中的表达均有上调。这提示即使在MS的慢性恢复期,轴索损伤抑制通路的信号仍然能够被持续激活并下传,从而导致神经功能损伤症状持续存在。
同时,本研究还显示β-APP与NgR表达在EAE的病理进展过程中呈负相关(=-0.207,<0.05)。轴索损伤早在EAE炎性反应初始阶段就已出现,可能使得轴索再生抑制因子暴露并结合NgR,使NgR表达上调。在EAE发病高峰期,轴索再生抑制因子本应释放增加,但本实验中NgR表达水平仍低于EAE炎性反应初期,可能由于发病高峰期细胞变性水肿,影响了内部物质的加工、合成和分泌。同时也提示在EAE的发病过程中,急性轴索损伤可能并不是激活轴索再生抑制通路的关键。本文作者既往的研究结果也表明,髓鞘相关糖蛋白(MAG)与NgR的表达在EAE模型中呈正相关,也表明神经轴突生长抑制通路在EAE模型中可能由髓鞘损伤引起,而非由轴索损伤引起[11]。这也提示髓鞘保护治疗应该尽早进行,以阻止其对轴索再生抑制通路的激活。
综上可见,在EAE发病过程中轴索损伤可能在早期即出现,并呈动态变化,且β-APP与NgR表达在EAE的病理进展过程中呈负相关,提示在EAE中急性轴索损伤可能并不是激活轴索再生抑制通路的关键,轴索损伤与轴索再生抑制通路的激活之间关系尚需进一步研究明确。
[1]Onuki M,Ayers M M,Bernard CC,et al.Axonal degeneration is an early pathological feature in autoimmune-mediated demyelination in mice[J].Microsc Res Tech,2001,52(6):731-739.
[2]Park J H,Strittmatter S M.Nogo receptor interacts with brain APP and Abeta to reduce pathologic changes in Alzheimer transgenic mice[J].Curr Alzheimer Res,2007,4 (5):568-570.
[3]Dong M,Liu R,Guo L,et al.Pathological findings in rats with experimental allergic encephalomyelitis[J].APMIS, 2008,116(11):972-984.
[4]Knono DH,Urban JL,Horvath SJ,et al.Two minor determinants of myelin basic protein induce experimental allergic encephalomyelitis in SJL/J mice[J].J Exp Med,1988,168 (1):213-227.
[5]Tomimoto H,Akiguchi I,Wakita H,et al.Ultrastructural localization of amyloid protein precursor in the normal and postischemic gerbil brain[J].Brain Res,1995,672(1-2):187-195.
[6]Murakami N,Yamaki T,Iwamoto Y,et al.Experimental brain injury induces expression of amyloid precursor protein, which may be related to neuronal loss in the hippocampus[J]. J Neurotrauma,1998,15(11):993-1003.
[7]Wang Y,Lv T,Liu X,et al.Pathological findings of axonal injury in a rat model of experimental allergic encephalomyelitis[J].Nan Fang Yi Ke Da Xue Xue Bao,2012,32(4):482-486.
[8]Liu BP,Fournier A,Grandpre T,et al.Myelin-associated glycoprotein as a functional ligand for the Nogo-66 receptor[J].Science,2002,297(5584):1190-1193.
[9]Petratos S,Ozturk E,Azari MF,et al.Limiting multiple sclerosis related axonopathy by blocking Nogo receptor and CRMP-2 phosphorylation[J].Brain,2012,135(Pt 6):1794-1818.
[10]Satoh J,Onoue H,Arima K,et al.Nogo-A and nogo receptor expression in demyelinating lesions of multiple sclerosis[J].J Neuropathol Exp Neurol,2005,64(2):129-138.
[11]杨洁,谢富华,区腾飞,等.MAG与Ng R在Lewis大鼠EAE动物模型中表达的相关分析[J].广东医学,2009,suppl(30):16-18.
GAO Cong,Email:smilegaocong@126.com
Objective To explore the mechanism of axonal injury and axonal regeneration inhibition pathways on experimental allergic encephalomyelitis(EAE)model by investigating the express ofβ-amyloid precursor protein(β-APP)and Nogo receptor(Ng R).Methods We established EAE model and then investigated the expression ofβ-APP and NgR in their brain with immunohistochemistry method at D8,D21 and D35 of EAE,respectively,to evaluate the association betweenβ-APP and NgR.Results The expression ofβ-APP was 67.94±7.23,29.86±4.02,74.94±8.16 and 117.25 at D8,D21,D35 and control group, respectively.And the P-values between each time are 0.008(D8.D21),0.005(D21.D35).The expression of Ng R was 90.28±8.74,76.75±6.59,77.64±9.58 and 45.33±5.26 at D8,D21,D35 and control group, respectively.And the-values between each time are 0.055(D8.D21)and 0.049(D8.D35).The rectilinear correlation analysis showed that the expression ofβ-APP and Ng R were negatively correlated in the whole EAE phase(=-0.207,<0.05).Conclusions Axonal injury happened at the early stage of EAE. The expression ofβ-APP and NgR changed during the phases of EAE.
β-APP;NgR;EAE;axonal regeneration inhibition
R744.5
:A
:1006-2963(2014)05-0328-04

2013-04-25)
(本文编辑:邹晨双)
10.3969/j.issn.1006-2963.2014.05.006
广东省自然基金项目(S2013010016262);广东省科技计划项目(2012B031800240)
510260广州医科大学附属第二医院神经内科(杨洁、高聪、黄莉、陈梦宇、郑扬波);528000佛山市第二人民医院神经内科(区腾飞);510260广州医科大学附属第二医院重症医学科(谢富华)
高聪,Email:smilegaocong@126.com

