整合素连接激酶对脐带间充质干细胞向神经干细胞样细胞分化的作用
周剑云,孙炜,张新,王建军,曹泽
·基础研究·
整合素连接激酶对脐带间充质干细胞向神经干细胞样细胞分化的作用
周剑云,孙炜,张新,王建军,曹泽
目的研究整合素连接激酶(ILK)对脐带间充质干细胞向神经干细胞样细胞分化的影响。方法分离人脐带间充质干细胞,用表达对照绿色荧光蛋白(GFP)和GFP融合野生型ILK、突变型ILK的质粒转染后,用含碱性成纤维细胞生长因子、表皮生长因子、B27的无血清培养基培养。检测间充质干细胞的增殖速度及向神经干细胞样细胞分化的效率。结果转染ILK的间充质干细胞中,ILK稳定表达,增殖速度加快,神经干细胞样细胞分化的效率提高;野生型ILK优于突变型ILK。结论ILK促进间充质干细胞向神经干细胞样细胞分化。其作用机制与激酶活性有关。
整合素连接激酶;间充质干细胞;增殖;神经干细胞样细胞
[本文著录格式]周剑云,孙炜,张新,等.整合素连接激酶对脐带间充质干细胞向神经干细胞样细胞分化的作用[J].中国康复理论与实践,2014,20(11):1022-1027.
人脐带间充质干细胞(mesenchymal stem cells, MSCs)是一种具有自我更新能力和多种分化潜能的前体细胞,不仅能分化成内、外胚层细胞,也能够分化成中胚层的多种衍生细胞系[1]。中枢神经系统损伤及退行性病变的修复与再生一直是神经科学研究的热点,MSCs应用于临床治疗神经退行性疾病及中枢神经系统损伤是一种较好的策略,因为脐带来源的MSCs容易收集,且细胞数量较多[2-6]。
体外培养的MSCs根据培养液及添加的诱导因子不同,分化成不同种类的前体细胞及成熟细胞。目前已发现在人脐带MSCs向神经干细胞样细胞、神经细胞分化过程中,细胞骨架重新排列,整合素连接激酶(integrin-linked kinase,ILK)表达上调[7]。推测MSCs诱导分化过程中ILK被激活,在贴壁依赖的MSCs转变为悬浮生长的神经干细胞样细胞的过程中起关键作用。本实验应用基因转染技术,对人脐带MSCs转染ILK,观察转染后细胞是否更容易向神经干细胞样细胞分化。
1 材料和方法
1.1 主要试剂与仪器
DMEM细胞培养液(改良培养基):HYCLONE公司。胎牛血清、小鼠抗GAPDH单克隆抗体:SIGMA公司。蛋白酶抑制剂、ECL Western显色试剂、小鼠抗绿色荧光蛋白(green fluorescent protein,GFP)单克隆抗体:ROCHE公司。硝酸纤维素膜:PALL公司。Lipofectamine 2000:INVITROGEN公司。羊抗兔二抗、高保真DNA聚合酶Pfx、pEGFP-C2质粒载体、EcoRI内切酶、XhoI内切酶、T4 DNA连接酶、HEK 293细胞株、U2OS细胞株、Top10感受态细胞、质粒抽提试剂盒:OMEGA公司。B27添加剂:Invitrogen公司。5×SYBR Green PCR Master Mix:AB Applied Biosystems公司。RNA提取试剂盒、逆转录PCR试剂盒、ECL化学发光试剂盒、重组人碱性成纤维细胞生长因子(fibroblast grow factor-basic,bFGF)、重组人表皮生长因子(epidermal growth factor,EGF)、兔抗巢蛋白多克隆抗体(nestin)、兔抗多克隆CD133、HRP标记的羊抗兔IgG、G418:MERCK公司。胰蛋白酶:GIBCO公司。CO2细胞培养箱:德国KENTRO公司。DK-8D电热恒温水槽、LE-80K型低温超速离心机、JTT-1300型超净工作台、CK30倒置荧光显微镜:OLYMPUS公司。Power PAC 300电泳仪、Trans blot SD转膜仪、实时定量PCR仪、凝胶成像系统:美国Bio-Rad公司。紫外可见分光光度:日本HITACHI公司。
1.2 ILK基因质粒载体的构建
根据GenBank ILK基因编码区设计相应引物LIK-F和LIK-R(见表1),根据载体质粒要求在引物中引入EcoRI和XhoI酶切位点,采用高保真DNA聚合酶Pfx,以HEK 293 cDNA作为模板进行PCR扩增,得到ILK基因片段,琼脂糖凝胶电泳鉴定。将该目的片段用EcoRI和XhoI消化;利用T4 DNA连接酶将含黏端的目的片段与酶切处理过的pEGFP-C2载体连接。将连接产物转化到大肠杆菌Top10感受态细胞中,挑取单克隆进行培养,利用酶切鉴定pEGFP-C2-ILK构建,命名为pEGFP-ILKWT。
利用PCR诱导点突变的方法,设计引物ILK-mut-F和ILK-mut-R(见表1),结合引物LIK-F和LIK-R,获得突变ILK-mutant目的片段。方法如下。用pEGFP-C2-ILK做模板,先分别用引物组ILK-F/ ILK-mut-R和ILK-mut-F/ILK-R进行扩增,分别回收扩增产物;然后取两种产物各10 ng混合,用引物ILK-F和ILK-R进行扩增,得到突变ILK-mutant。用EcoRI和XhoI酶切ILK-mutant和pEGFP-C2,回收酶切产物,T4 DNA连接酶连接,转化大肠杆菌Top10,挑取单克隆进行培养,利用酶切鉴定pEGFP-C2-ILKmutant构建,命名为pEGFP-ILKMT。突变将ILK第362位Glu突变为Lys。
1.3 U2OS细胞转染及测定
分别由脂质体介导转染pEGFP-ILKWT、pEGFP-ILKMT及pEGFP-C2质粒。转染前24 h观察细胞状态,在培养基500 μl中接种1.0×105细胞,待贴壁生长良好,细胞融合达70%~80%开始转染。细胞转染前4 h更换为无血清培养基。
将质粒1 μg与Lipofectamine 2000脂质体6 μl分别稀释于无血清DMEM 100 μl,室温放置5 min,然后将两者混合,室温放置15 min。加入细胞培养皿中,置于5%CO2培养箱37℃培养48 h。
细胞4%多聚甲醛固定,DAPI染色,荧光显微镜观察细胞形态。
取上述转染收获细胞,RAPI裂解液裂解,取蛋白20 μg行SDS-PAGE电泳,硝酸纤维素膜转膜,分别用GFP抗体、GAPDH抗体检测目的条带。
1.4 MSCs转染及测定
脐带取自北京大学人民医院足月新生儿剖宫产脐带,均经父母授权同意。MSCs分离和培养方法见前期研究[8]。
新鲜分离的原代MSCs培养至细胞贴壁生长密度接近80%~90%时进行细胞转染。转染前1天用胰酶消化MSCs细胞,调整细胞密度至1×105/ml,每孔2 ml接种6孔板。5%CO237℃培养细胞密度达80%左右。取pEGFP-ILKWT、pEGFP-ILKMT各4 μg加入DMEM培养基100 ml中制成A液和B液;取两管Lipofetamine 2000各6 ml加入DMEM培养基100 ml中制成C液。均室温静置5 min。将A液和B液分别与C液混匀,室温静置20 min后,分别滴加于上述6孔板中,轻轻晃动细胞培养板,混和均匀。5%CO237℃培养48 h后筛选。
经G418对MSCs最小致死量测定,得到最小致死量600 μg/ml。将上述培养48 h后的MSCs经600 μg/ ml G418压力筛选15 d后获得单个细胞克隆。挑取单个细胞克隆,经扩大培养获得抗性细胞。抗性细胞的生长速度及形态与正常MSCs无差异。
转染48 h后,MSCs转移到新的培养皿。用含bFGF、EGF、B27的无血清培养基培养,每天观察细胞形态,且每2天更换培养基。共培养15 d。
将GAPDH、CD133及Nestin定量模板分别进行10倍梯度稀释得到101-1010浓度的标准模板,同时进行PCR。反应体系加入毛细管后使用荧光定量PCR仪进行扩增。将检测的临界点设定在PCR扩增过程中荧光信号由本底进入指数增长阶段的拐点所对应的循环数(threshold cycle,Ct)值处,将不同浓度模板的对数和相应Ct值作图做标准曲线。将所扩增的PCR产物同时进行2.5%琼脂糖凝胶电泳及熔解曲线分析。每一标本以所测的CD133及Nestin拷贝数和GAPDH拷贝数的比值代表CD133及Nestin mRNA表达水平。为进一步确认PCR反应的特异性,将GAPDH、CD133及Nestin扩增产物在2.5%琼脂糖凝胶中进行电泳。
提取总蛋白,取80 μg总蛋白行聚丙烯酰胺凝胶电泳,按湿转法将电泳产物转移到硝酸纤维素膜,5%脱脂奶粉4℃封闭2 h,滴加一抗(1∶l000),4℃过夜,PBS洗膜10 min,共4次;滴加二抗(1∶1000),37℃孵育2 h,PBS洗膜10 min,共4次。按ECL化学发光试剂盒说明进行显色,凝胶成像仪采集图像。Quantity-one 4.31软件分析CD133及Nestin灰度值与GAPDH灰度值的比值代表CD133及Nestin蛋白表达水平。

表1 引物序列
1.5 细胞增殖测定
取对指数生长期转染的U2OS细胞,常规消化传代,制成细胞悬液,反复吹打,使细胞充分分散,单个细胞百分率95%以上。细胞记数,用培养基调节细胞浓度。将细胞悬液倍比稀释。按照每皿100个细胞分别接种5 ml细胞悬液到培养皿(直径60 mm)中,轻轻晃动培养皿,使细胞分散均匀。培养皿置5%CO2培养箱37℃培养2~3周,当培养皿中出现肉眼可见克隆时,终止培养,弃去培养液。PBS液浸洗2次,空气干燥。甲醇固定15 min,弃甲醇后空气干燥。Giemsa染液染色10 min,流水缓慢洗去染液,空气干燥。数码相机拍照,计数肉眼可见的克隆数。
2 结果
2.1 GFP-ILK在U2OS细胞表达和定位
U2OS细胞表达GFP-ILKWT、GFP-ILKMT融合蛋白(79 kDa)。见图1。
荧光显微镜观察,GFP-ILKWT与GFP-ILKMT均定位于细胞质中,同时在细胞膜上有少量分布,两者定位无明显差异(图2)。
2.2 MSCs向神经干细胞样细胞分化
MSCs在培养24 h内可见细胞聚集成堆,细胞逐渐回缩,最后形成悬浮细胞球,并可不断增殖扩大,约10 d后出现神经干细胞样形态的细胞球悬浮生长。将细胞球机械吹打为单细胞悬液,单个细胞能继续悬浮生长,并逐渐扩增形成小的细胞球,小的细胞球直径逐渐增大。培养15 d后转染pEGFP-ILKWT的MSC比转染pEGFP-ILKMT的MSC产生更多的神经干细胞样细胞(图3)。
转染pEGFP-ILKWT、pEGFP-ILKMT的MSC,培养后qPCR检测Nestin和CD133基因比转染pEGFP-C2高4~8倍(图4)。将具有GFP荧光信号的细胞挑选出来,Western blotting检测显示,Nestin和CD133表达由高到低依次为转染pEGFP-ILKWT、转染pEGFP-ILKMT和转染pEGFP-C2(图5)。
2.3 细胞增殖
U2OS细胞克隆形成数高到低依次为转染pEGFP-ILKWT、转染pEGFP-ILKMT和转染pEGFP-C2(图6)。

图1 U2OS细胞表达GFP-ILKWT、GFP-ILKMT
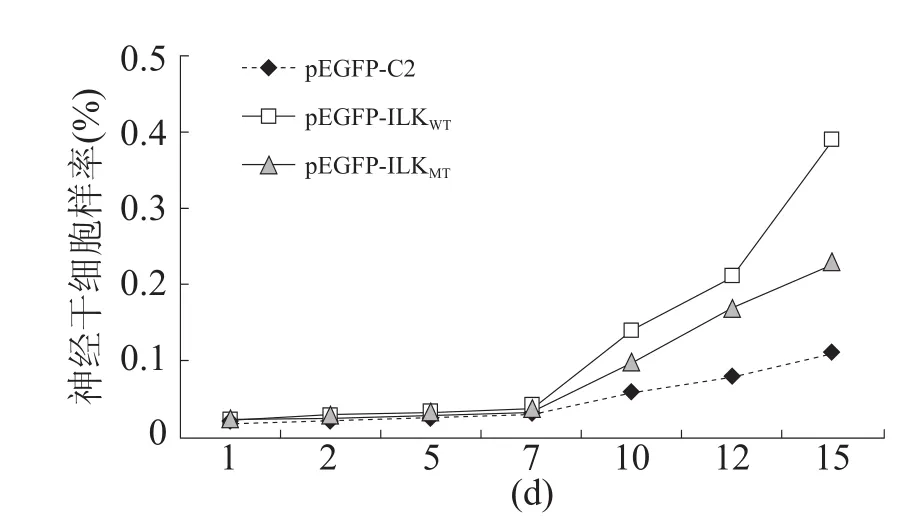
图3 不同转染的MSCs神经干细胞样细胞比例

图2 U2OS细胞表达GFP-ILKWT、GFP-ILKMT(荧光显微镜,10×100)
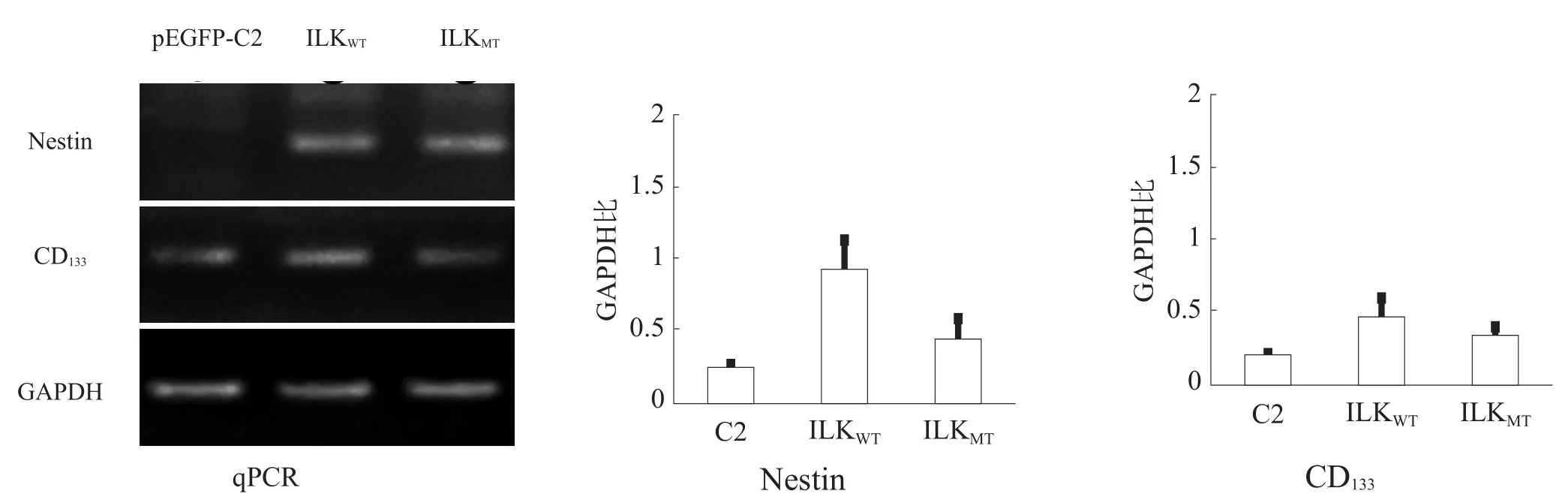
图4 qPCR测定Nestin和CD133表达
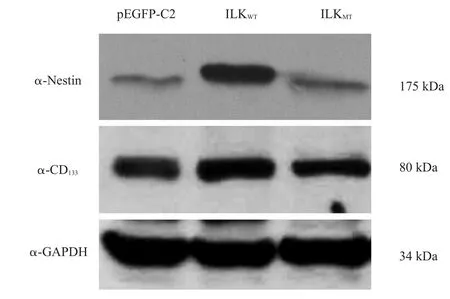
图5 Western blotting测定Nestin和CD133表达
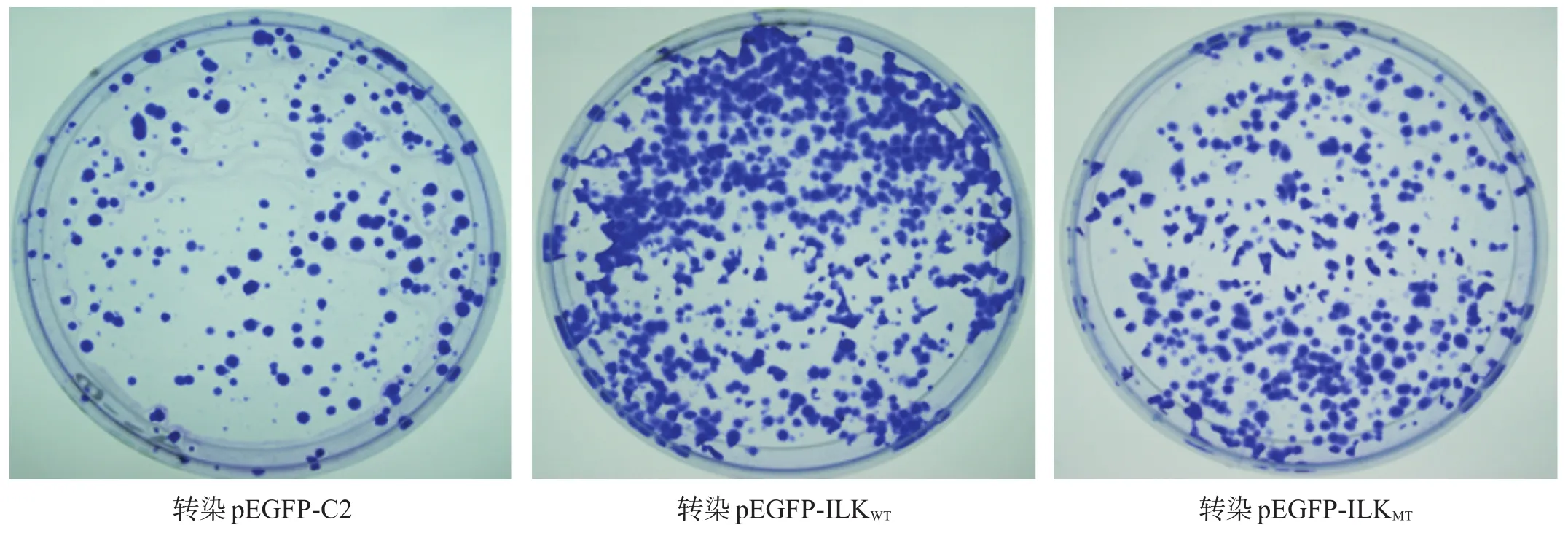
图6 U2OS细胞克隆形成
3 讨论
ILK是一个分子量59 kDa、具有Ser/Thr蛋白激酶活性的细胞内信号蛋白分子。1996年,Hannigan等在研究整合素β1结合蛋白的过程中,利用酵母双杂交的方法发现了ILK[9]。ILK具有调整细胞骨架蛋白重组、细胞增殖、有丝分裂、侵袭的作用,对于调节细胞生理机能至关重要[10]。研究显示,ILK在诸多肿瘤中表达水平及活性增强[11]。
神经干细胞及神经前体细胞的增殖对哺乳动物的神经发生起着重要作用,其中ILK在调节神经干细胞及神经前体细胞起着重要作用[12]。神经干细胞样细胞是具有类似于神经干细胞样生长、增殖、向神经细胞分化特征的一类细胞,有望像神经干细胞一样在神经修复和再生方面起一定作用。目前ILK在神经干细胞及神经干细胞样细胞向神经细胞分化中的机制未见报道。本文通过质粒转染,在MSCs中高表达ILKWT和 ILKMT,然后将细胞在添加bFGF、EGF和B27三种因子的无血清培养基中,诱导其向神经干细胞样细胞的分化。结果发现,MSCs高表达ILK后,向神经干细胞样细胞分化的数目明显提高,神经干细胞样细胞分子标志物Nestin和CD133的表达量明显增多。
对ILK的激酶活性突变体ILKMT的研究发现,MSC经过pEGFP-ILKWT、pEGFP-ILKMT转染,诱导15 d后,转染pEGFP-ILKWT的MSC比转染pEGFP-ILKMT的MSC更多分化为神经干细胞样细胞。表明ILK促进MSC的分化依赖于其激酶活性。克隆形成实验表明,ILK促进细胞增殖也同样依赖于其激酶活性。然而,Porcheri等研究发现,敲除ILK基因增加了成年鼠脑中神经干细胞及神经前体细胞的增殖[13]。还有文献报道,ILK在细胞增殖方面有时表现不同,甚至有相反的作用,可能与细胞所处的环境或分化的阶段有关[14]。具体作用机制仍有待进一步研究。
Porcheri等利用病毒基因重组技术,使RSU-1 (Ras suppressor unit-1)表达缺失,增强了ILK下游信号分子PINCH1/2依赖性JNK(c-Jun N-terminal protein kinase)的活性,引起一系列反应,导致神经干细胞及神经前体细胞的增殖[13]。Duxbury等的研究证实,ILK能磷酸化Akt的Ser473位点,这种磷酸化修饰对于Akt的完全激活是必须的;活化的Akt使糖原合成酶激酶(glycogen synthase kinase,GSK)磷酸化,从而调节胰腺癌细胞增殖[15]。Naves等研究证实,ILK与Wnt信号通路相互作用,通过影响Wnt通路下游的P-cadherin和Akt,导致细胞间黏附丧失,以及细胞同细胞外基质间相互作用减弱,促进形成局灶性肾小球硬化[16]。
MSC中高表达ILK之后导致更多神经干细胞样细胞出现的原因,可能涉及上述某一途径。有待进一步深入研究。
[1]Lee OK,Kuo TK,Chen WM,et al.Isolation of multipotent mesenchymal stem cells from umbilical cord blood[J].Blood, 2004,103(5):1669-1675.
[2]Torrente Y,Polli E.Mesenchymal stem cell transplantation for neurodegenerative diseases[J].Cell Transplant,2008,17 (10-11):1103-1113.
[3]Huang F,Wang J,Chen A.Effects of co-grafts mesenchymal stem cells and nerve growth factor suspension in the repair of spinal cord injury[J].Huazhong Univ Sci Technolog Med Sci, 2006,26(2):206-210.
[4]Maltman DJ,Hardy SA,Przyborski SA.Role of mesenchymal stem cells in neurogenesis and nervous system repair[J].Neurochem Int,2011,59(3):347-356.
[5]Joyce N,Annett G,Wirthlin L,et al.Mesenchymal stem cells for the treatment of neurodegenerative disease[J].Regen Med, 2010,5(6):933-946.
[6]王革生,张庆俊,韩忠朝.人脐带间充质干细胞移植对大鼠脊髓损伤神经功能恢复的评价[J].中华神经外科杂志,2006,22 (1):18-21.
[7]周剑云.ILK在人脐带间充质干细胞向神经细胞分化中的表达变化及意义[D].石家庄:河北医科大学,2008.
[8]周剑云,孙炜,张新,等.人脐带源神经干细胞的培养和分化[J].中国康复理论与实践,2012,18(7):615-618.
[9]Hannigan GE,Leung-Hagesteijn C,Fitz-Gibbon L,et al.Regulation of cell adhesion and anchorage-dependent growth by a new beta 1-integrin-linked protein kinase[J].Nature,1996,379 (6560):91-96.
[10]Fielding AB,Dedhar S.The mitotic functions of integrin-linked kinase[J].Cancer Metastasis Rev,2009,28(1-2): 99-111.
[11]Cabodi S,Del PCM,Di Stefano P,et al.Integrin signalling adaptors:not only figurants in the cancer story[J].Nat Rev Cancer,2010,10(12):858-870.
[12]Guo W,Jiang H,Gray V,et al.Role of the integrin-linked kinase(ILK)in determining neuronal polarity[J].Dev Biol, 2007,306(2):457-468.
[13]Porcheri C,Suter U,Jessberger S.Dissecting integrin-dependent regulation of neural stem cell proliferation in the adult brain[J].J Neurosci,2014,34(15):5222-5232.
[14]Qin J,Wu C.ILK:a pseudokinase in the center stage of cell-matrix adhesion and signaling[J].Curr Opin Cell Biol, 2012,24(5):607-613.
[15]Duxbury MS,Ito H,Benoit E,et al.RNA interference demonstrates a novel role for integrin-linked kinase as a determinant of pancreatic adenocarcinoma cell gemcitabine chemoresistance[J].Clin Cancer Res,2005,11(9):3433-3438.
[16]Naves MA,Requiao-Moura LR,Soares MF,et al.Podocyte Wnt/β-catenin pathway is activated by integrin-linked kinase in clinical and experimental focal segmental glomerulosclerosis[J].J Nephrol,2012,25(3):401-409.
Effect of Integrin-linked Kinase on Derivation of Neural Stem-like Cells from Mesenchymal Stem Cells
ZHOU Jian-yun,SUN Wei, ZHANG Xin,WANG Jian-jun,CAO Ze.Capital Medical University School of Rehabilitation Medicine,Department of Surgery,Beijing Bo'ai Hospital,China Rehabilitation Research Centre,Beijing 100068,China
ObjectiveTo investigate the effect of integrin-linked kinase(ILK)on inducing mesenchymal stem cells(MSCs)to neuron stem-like cell in vitro.MethodsMSCs isolated from umbilical cord were transfected with plasmid DNA encoding green fluorescent protein (GFP)and GFP-fusion ILK,wild and mutant,respectively;and cultured in serum-free media with basic fibroblast growth factor,epidermal growth factor and B27.It was assessed with the proliferative activity and the efficiency of differentiation into neural stem-like cell.ResultsMSCs transfected with GFP-fusion wild ILK expressed ILK and kinase-dead mutant ILK stably.The activity of proliferation increased and more of them differentiated into neural stem-like cell,which express CD133and Nestin validated by PCR and Western blotting,and more of wild than of mutant.ConclusionIntegrin-linked kinase may play a positive role in MSC differentiation into neural stem-like cell,which may associate with the activity of kinase.
integrin-linked kinase;mesenchymal stem cells;proliferation;neural stem cell-like cell
10.3969/j.issn.1006-9771.2014.11.007
R318.5
A
1006-9771(2014)11-1022-06
2013-08-15
2014-09-03)
中国康复研究中心基金项目(No.2011-31)。
1.首都医科大学康复医学院,北京市100068;2.中国康复研究中心北京博爱医院外科,北京市100068。作者简介:周剑云(1970-),男,北京市人,博士,副主任医师,主要研究方向:颅脑外伤、脑血管病、神经康复医学。

