远志皂苷元对新生大鼠海马神经干细胞分化的影响
陈玉静,黄小波,陈文强,王宁群
远志皂苷元对新生大鼠海马神经干细胞分化的影响
陈玉静,黄小波,陈文强,王宁群
目的观察远志皂苷元对体外培养的胎鼠海马神经干细胞(NSCs)增殖分化的影响。方法利用无血清DMEM/F12体外培养技术从新生Wistar大鼠大脑海马中培养NSCs,添加不同浓度(0、1、2、4 μg/ml)远志皂苷元。应用免疫荧光技术对NSCs及其分化后的细胞进行鉴定。结果培养的NSCs能够表达Nestin,并具有分化为神经元、星形胶质细胞及少突胶质细胞的能力。在同一接种密度条件下,远志皂苷元干预组的Nestin阳性细胞数较对照组减少(P<0.05),神经元特异性烯醇化酶(NSE)和胶质纤维酸性蛋白(GFAP)阳性细胞数较对照组增加(P<0.05)。结论远志皂苷元能促进新生大鼠大脑海马NSCs的分化。
远志皂苷元;神经干细胞;细胞培养;细胞分化;大鼠
[本文著录格式]陈玉静,黄小波,陈文强,等.远志皂苷元对新生大鼠海马神经干细胞分化的影响[J].中国康复理论与实践, 2014,20(11):1028-1030.
在哺乳动物中枢神经系统存在神经干细胞(neural stem cells,NSCs),主要分布在海马、纹状体、脑室下区、嗅球以及发育过程中的大脑皮质和脊髓[1]。NSCs是一类具有多向分化和自我更新能力的细胞[2-3],位于海马部位的NSCs经增殖分化产生的神经发生与学习记忆密切相关[4]。本实验从新生大鼠大脑海马中分离、培养成细胞悬浮球,经鉴定呈Nestin阳性,表明为NSCs。观察中药提取物远志皂苷元对其增殖分化的影响,以研究远志皂苷元的神经元保护作用。
1 材料与方法
1.1 实验材料
新生Wistar大鼠:中国医学科学院实验动物中心提供。
鼠抗Nestin、鼠抗神经元特异性烯醇化酶(neuron specific enolase,NSE)、兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体:SIGMA公司。免疫荧光二抗FITC羊抗兔、抗鼠IgG以及4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)试剂:CHEMICON公司;神经干细胞基础培养液(DMEM/F12加B27)、添加20 ng/ml碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和20 ng/ ml表皮生长因子(epidermal growth factor,EGF):GIBCO公司。远志皂苷元:中国药品生物制品检定所。
1.2方法
1.2.1 原代培养
新生当天Wistar大鼠,乙醇消毒后断头取脑,取双侧大脑皮质置D-Hanks液中;剥离脑膜及血管,用眼科剪剪碎成糊状,加DMEM/F12培养液(Hyclone);细口吸管机械吹打,200目金属滤网过滤,获得单细胞悬液并计数。以5×105/ml细胞浓度接种到培养瓶中,加入2%B27、终浓度20 ng/ml EGF和bFGF,置5%CO2恒温孵箱中37℃培养。3~4 d半量补液。培养7~9 d后,机械分离神经球进行传代。
1.2.2 传代培养
将原代培养7~9 d形成的神经球(50~200细胞/球)悬液移至离心管,1200 r/min离心5 min,共3次,吸弃上清液。机械吹打制成单细胞悬液,以5×105/ml细胞浓度接种培养。6~8 d传代1次。
1.2.3 神经干细胞的分化及远志皂苷元的诱导作用
收集培养的第2代神经球,以2×105/ml细胞浓度接种于24孔培养板各孔中。孔底放置预先用100 mg/L多聚赖氨酸处理过的盖玻片。每板分对照组,远志皂苷元低(1 μg/ml)、中(2 μg/ml)和高(4 μg/ml)剂量组,每组6孔。对照组培养液为原培养液去除bFGF及EGF,另加10%胎牛血清(FBS)配制。远志皂苷元组培养液在对照组培养液的基础上加入不同剂量远志皂苷元。培养板置饱和湿度、37℃、5%CO2孵箱中培养。
1.2.4 细胞鉴定
增殖期测定NSC标志物Nestin。各组分化培养7 d时,测定Nestin以及神经细胞标志物NSE和星形胶质细胞标志物GFAP。
取出各孔盖玻片,4%多聚甲醛固定,PBST漂洗5 min,共3次。用含0.3%Triton X-100的PBST破膜30 min,山羊血清37℃封闭30 min;一抗分别为单克隆鼠抗Nestin(1∶100)、鼠抗NSE(1∶500)和多克隆兔抗GFAP(1∶50);滴加相应的FITC标记的荧光二抗(1∶500),37℃避光孵育1 h;PBST漂洗5 min,共3次。使用50 μg/ml DAPI复染核,室温孵育20 min;PBST漂洗5 min,共3次。Olympus倒置相差荧光显微镜及普通光学显微镜下观察并拍照。采用Kodak图像分析系统及Image-Proplus软件测量突起长度。
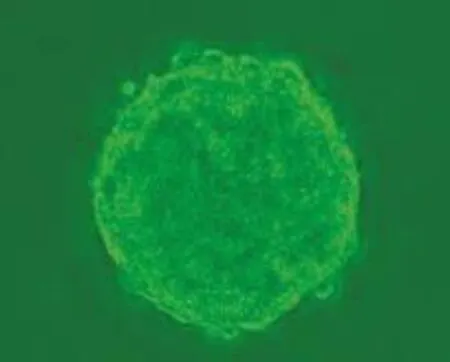
图1 神经球(第8天,400×)
1.3 统计学分析
使用SPSS 11.0统计软件进行分析。实验数据采用(±s)表示,组间比较采用单因素方差分析,显著性水平α=0.05。
2 结果
2.1 NSCs生长状态
培养第1天细胞呈圆形亮点;第2~3天可见有数个细胞形成的哑铃样结构;第4~5天可见几十个细胞形成的神经球(neurosphere);第6天可见神经球明显增大,直径100~150 μm;第8~10天,大的神经球直径已达到150~200 μm(图1)。原代及多次传代培养形成克隆球的细胞圆润饱满,界清晰,活力状态佳。Nestin表达阳性(图2)。
2.2 细胞分化
在去除bFGF及EGF,加10%胎牛血清的培养基培养7 d后,NSCs部分分化为NSE阳性的神经元(图3)和GFAP阳性的星形胶质细胞(图4)。NSE阳性神经元的胞体呈圆形,有较长轴突。GFAP阳性星形胶质细胞的胞体稍小,胞突长而直,分支较少。
添加远志皂苷元培养7 d后,Nestin阳性细胞数较对照组减少(P<0.05),NSE和GFAP阳性细胞数较对照组增多(P<0.05)。随远志皂苷元浓度增加,NSE阳性细胞数逐渐增多(P<0.05),GFAP阳性细胞数无显著性差异(P>0.05)。见表1。

表1 各组细胞分化情况(CD)

图2 Nestin染色(400×)

图3 NSE染色(400×)
3 讨论
阿尔茨海默病(Alzheimer's disease,AD)是一种神经退行性疾病,其特征性病理变化为淀粉样蛋白沉积、神经元纤维缠结、基底前脑和海马区的神经元减少。AD中医辨证多属“肾精亏损,髓海空虚”。《黄帝内经》中提出“肾生髓”理论,现代研究证实,“肾生髓”理论与AD明显相关[5],临床上治疗AD多从补肾论治。补肾填髓中药能促进神经元代谢,激活内源性神经营养因子,促进神经元存活与再生。
AD脑的神经再生过程受到严重损害,这可能是导致认知功能进行性减退的重要病理机制之一。成年海马的神经发生与空间认知功能有关[6-7];如能促进成年神经发生可以增强空间记忆功能,而抑制神经发生可出现空间记忆功能的下降[8]。
1992年,Reynolds等首先从成年鼠纹状体中分离出NSCs。NSCs是一类较原始的神经细胞,存在于胚胎和成年哺乳动物中枢神经系统的广泛区域,具有自我更新和增殖的能力,可表达特殊标志蛋白Nestin[9]。NSCs具有分化为神经元、星形胶质细胞、少突胶质细胞的能力。探索NSCs的定向分化已经成为备受关注的焦点。
研究表明,中药不仅可以保护神经细胞,提高神经元抵抗损伤的能力,而且能促进NSCs的增殖,并诱导其定向分化为功能性神经元。
中药远志具有宁心安神、祛痰开窍的作用,近年来在抗衰老、益智、抗氧化等方面的研究较多[10],能够抗氧化、清除自由基[11-12]。
远志皂苷元是远志的主要活性成分之一。研究发现,远志皂苷元可以通过抑制氧化应激反应,改善AD模型小鼠的学习记忆能力[13]。本课题组前期研究发现,远志皂苷元能够抑制tau蛋白磷酸化,能够对抗甲基乙二醛引起的细胞毒性,具有保护海马神经元的作用[14-16]。

图4 GFAP染色(400×)
本研究结果提示,远志皂苷元可促进NSCs向神经元方向分化。综合以前的研究结果,远志皂苷元对神经元的保护作用机制可能是多方面的。促进海马中NSCs向神经元分化的神经再生机制可能是其中之一。
[1]Terskikh A,Bryant P,Schwartz P.Mammalian Stem Cells[J].Pediatr Res,2006,59(4):13R-20R.
[2]Anderson DJ,Michelsohn A.Role of glucocorticoids in the chromaffin neuron developmental decision[J].Int J Dev Neurosci,1989,7(5): 475-487.
[3]Gritti A,Bonfanti L,Doetsch F,et al.Multipotent neural stem cells reside into the rostral extension and olfactory bulb of adult rodents[J]. Neuroscience,2002,22(2):437-445.
[4]Zhang W,Wang GM,Wang PJ,et al.Effects of neural stem cells on synaptic proteins and memory in a mouse model of Alzheimer's disease[J]. J Neurosci Res,2014,92(2):185-194.
[5]陈薇,付于,毕海.基于“肾生髓”理论浅述肾精与脑认知功能的关系[J].天津中医药大学学报,2012,31(1):54-56.
[6]Decimo I,Bifari F,Krampera M,et al.Neural stem cell niches in health and diseases[J].Curr Pharm Des,2012,18(13):1755-1783.
[7]Gonzalez-Castaneda RE,Galvez-Contreras AY,Luquín S,et al.Neurogenesis in Alzheimer´s disease:a realistic alternative to neuronal degeneration?[J].Curr Signal Transduct Ther,2011,6(3):314-319.
[8]Winocur G,Wojtowicz JM,Sekeres M,et al.Inhibition of neurogenesis interferes with hippocampus-dependent memory function[J].Hippocampus,2006,16(3):296-304.
[9]Mckay R.Stem cell in the central nervous system[J].Science,1997, 276(5309):66-71.
[10]姜勇,屠鹏飞.远志研究进展[J].中草药,2001,32(8):759-761.
[11]Cai ZL,Wang CY,Gu XY,et al.Tenuigenin ameliorates learning and memory impairments induced by ovariectomy[J].Physiol Behav,2013, 118:112-117.
[12]Huang JN,Wang CY,Wang XL,et al.Tenuigenin treatment improves behavioral Y-maze learning by enhancing synaptic plasticity in mice[J].Behav Brain Res,2013,246:111-115.
[13]蒋辉,徐运,姜亚军.远志皂苷元对AD模型小鼠学习记忆能力的影响及其机制研究[J].现代中西医结合杂志,2013,22(11):1153-1155.
[14]Chen Y,Huang X,Li L,et al.Tenuigenin protects cultured hippocampal neurons against methylglyoxal-induced neurotoxicity[J].Eur J Pharmacol,2010,645(1-3):1-8.
[15]陈玉静,黄小波,陈文强,等.远志皂苷元调控tau蛋白磷酸化的实验研究[J].中国中医药信息杂志,2012,19(9):45-47.
[16]陈玉静,黄小波,陈文强,等.远志皂苷元对PC12细胞tau蛋白磷酸化和O-GlcNAc糖基化的影响[J].天津中医药,2013,30(1):40-42.
Effect of Tenuigenin on Differentiation of Neural Stem Cells from Hippocampus of Newborn Rats
CHEN Yu-jing,HUANG Xiao-bo, CHEN Wen-qiang,WANG Ning-qun.Xuanwu Hospital,Capital Medical University,Beijing 100053,China
ObjectiveTo observe the effect of tenuigenin on differentiation of hippocampal neural stem cells(NSCs).MethodsNSCs isolated from newborn(within 24 h)Wistar rats hippocampus were cultivated in vitro with serum free and clone culturing technology.Tenuigenin of different doses(0,1,2,4 μg/ml)were added in the medium,and the proliferation and differentiation of the cells were identified with immunofluorescence staining.ResultsThe neural spheres obtained from the hippocampi of newborn rats were positive for Nestin expression,with the potential for further cloning and differentiation into neurons or glial cells.The incidence of neuron specific enolase and glial fibrillary acidic protein positive cells increased in all the tenuigenin groups compared to the control(P<0.05),while the Nestin positive cells decreased(P<0.05).ConclusionTenuigenin may promote the differentiation of neural stem cell into nerve cell.
tenuigenin;neural stem cells;cell culturing;cell differentiation;rats
10.3969/j.issn.1006-9771.2014.11.008
R742
A
1006-9771(2014)11-1028-03
2014-01-13
2014-02-08)
国家自然科学基金项目(No.81102624)。
首都医科大学宣武医院中医科,北京市100053。作者简介:陈玉静(1979-),女,汉族,吉林吉林市人,博士,主治医师,主要研究方向:脑病的中医药防治研究。

