STAT3小分子抑制剂FLLL31对卵白蛋白致敏小鼠气道炎症治疗活性的初步研究
袁绍鹏,白金叶,玄玲玲,侯琦
中国医学科学院北京协和医学院 药物研究所,新药作用机制研究与药效评价北京市重点实验室,北京 100050
哮喘是一种以气道慢性炎症为病理基础的呼吸系统疾病,目前全世界约有3亿人患有哮喘[1]。既往研究证明,T淋巴细胞、嗜酸性粒细胞、肥大细胞等炎症细胞释放炎症因子、趋化因子、细胞因子和多种蛋白酶是哮喘发病的主要原因[2]。近年来,中性粒细胞在哮喘气道炎症发生过程中的作用日益受到关注。中性粒细胞具有趋化、吞噬、产生氧自由基及释放作用等功能。哮喘患者病情加重时,气道中性粒细胞数目明显增多,不仅可导致急性哮喘的恶化,还可引起感染部位的炎症,使炎症反应进一步加重,引起病理性损害[3-4]。因此,通过抑制中性粒细胞在气道炎症微环境中的过度表达,对治疗哮喘,特别是严重性哮喘,将发挥重要的功能。
白细胞介素6(IL-6)是重要的中性粒细胞调控因子,在中性粒细胞分化发育中发挥重要作用。研究表明,哮喘患者肺内IL-6的表达增加并促进肺内中性粒细胞活化和募集[5-6]。IL-6主要通过活化细胞内JAK-STAT3信号通路调控细胞增殖、分化、凋亡等功能。STAT3是STAT家族的重要成员,广泛表达于多种类型的细胞及组织中,其最早作为IL-6信号转递中的急性反应因子而被发现。此外,多种细胞因子和生长因子如干扰素、IL-11等也通过活化调控炎症反应[7-9]。目前,国内外少见关于STAT3抑制剂改善和治疗小鼠气道炎症的研究报道。FLLL31是在传统中药姜黄素单体基础上,通过结构优化设计并合成的新结构化合物,能特异抑制STAT3磷酸化及活化,其生物学活性已在前期肿瘤研究中获得证实[10]。但是,迄今国内外未见有关FLLL31参与免疫调节,特别是气道炎症相关疾病治疗的报道。在本研究中,我们拟研究STAT3小分子抑制剂类新结构化合物FLLL31参与调控气道炎症的活性,探索其对小鼠气道炎症的改善活性,对气道内炎症细胞浸润及趋化,相关炎症因子如IL-6及炎症细胞生物标志物如淋巴细胞抗原6G(lymphocyte antigen 6G,Ly6G)等表达的影响。
1 材料与方法
1.1 材料
雄性BALB/c小鼠,18~20 g,SPF级,由中国医学科学院实验动物研究所提供(合格证:SCXK-(京)2009-0007)。卵白蛋白(ovalbumin,OVA,Sigma公司);FLLL31(纯度≥98%,Sigma公司);地塞米松(Sigma公司分装);Ly6G/Gr-1抗体(R&D公司);小鼠IL-6 ELISA检测试剂盒(BioLegend公司)。
1.2 动物模型的建立
雄性BALB/c小鼠随机分为4组,每组10只,包括正常对照组(Control组)、模型对照组(OVA组)、地塞米松组(Dex组,1 mg/kg,腹腔注射)和FLLL31组(15 mg/kg,口服灌胃)。小鼠分别于第0 d和第14 d致敏,每只鼠腹腔注射20 μg OVA和2.25 mg Al(OH)3凝胶,FLLL31自致敏第24 d开始给药,给药周期为7 d。于第28、29、30 d以气管滴入OVA方式进行攻击,攻击前1 h给予受试化合物FLLL31及阳性药地塞米松。
1.3 检测指标
1.3.1 支气管肺泡灌洗液炎症细胞及炎症因子检测 末次激发后24 h,切开小鼠颈部皮肤暴露气管,插入灌流针,用1 mL预冷的PBS行肺部灌洗3次,吸出气道灌流液,4℃、1000 r/min离心5 min,细胞沉淀用PBS缓冲液重悬,用全自动血球分析仪进行细胞分类计数,离心上清以ELISA方法分析其中的IL-6含量。
1.3.2 小鼠肺部病理分析 取出小鼠完整的左侧肺组织,用4%甲醛固定,石蜡包埋切片后进行苏木素-伊红(HE)染色,光学显微镜下观察对比各组小鼠肺组织病理形态学改变。
1.3.3 小鼠肺部过碘酸雪夫染色(periodic acid-Schiff stain,PAS染色)分析 取出小鼠完整的左侧肺组织,用4%甲醛固定,石蜡包埋切片后进行PAS染色,光学显微镜下观察小鼠肺组织黏液物质的分泌情况。
1.3.4 小鼠肺部免疫组化分析 取各组小鼠肺组织进行免疫组化检测,分析其中IL-6受体(IL-6R)、中性粒细胞生物标志物Ly6G的表达水平变化。
1.4 统计学处理
数据以x±s表示,组间比较采用t检验。
2 结果
2.1 小鼠肺组织病理分析结果
小鼠肺部病理分析结果见图1。与正常对照组相比,模型组小鼠肺间质大量淋巴细胞及中性粒细胞浸润;与模型组相比,给予FLLL31治疗后,小鼠肺间质散在少量中性粒细胞、淋巴细胞浸润,提示FLLL31可有效抑制小鼠气道炎症细胞浸润及侵袭。
2.2 支气管肺泡灌洗液白细胞、淋巴细胞及中性粒细胞计数
如图2所示,与正常对照组相比,模型组小鼠灌洗液中炎症相关白细胞、淋巴细胞及中性粒细胞明显升高(P<0.05);与模型组比较,FLLL31连续给药7 d可明显抑制小鼠气道炎症细胞的增加(P<0.05)及淋巴细胞、中性粒细胞的升高(P<0.05)。此外,气道中的单核巨噬细胞的增加也被FLLL31明显抑制(P<0.05)。
2.3 小鼠肺组织PAS染色分析结果
小鼠肺组织PAS染色结果(图3)显示,与对照组相比,OVA致敏后,明显增加小鼠肺组织内黏液物质的分泌;与模型组相比,给予FLLL31治疗后,小鼠肺组织黏液物质的分泌得到抑制和改善。
2.4 支气管肺泡灌洗液炎症因子表达量分析
我们进一步检测了小鼠肺部灌流液中IL-6的表达含量。如图4所示,与正常对照组相比,模型组小鼠肺灌流液中炎症因子IL-6的含量显著升高(P<0.01);与模型组相比,FLLL31治疗组明显抑制了小鼠气道炎症因子IL-6的表达(P<0.05)。
2.5 免疫组化分析小鼠肺组织中IL-6R的表达
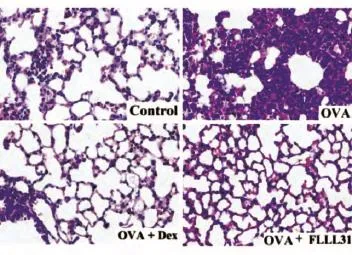
图1 小鼠肺部病理检测结果(100×)Control:正常组;OVA:模型组;Dex:地塞米松治疗组;FLLL31:FLLL31治疗组
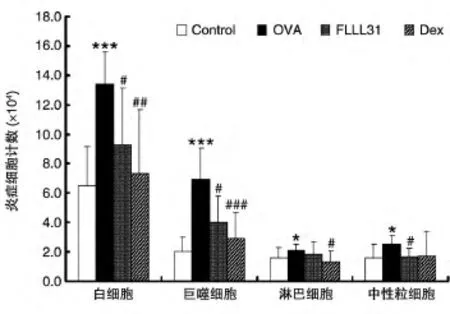
图2 小鼠肺部灌洗液中主要炎症细胞分类计数

图3 小鼠肺部PAS染色结果(100×)Control:正常组;OVA:模型组;Dex:地塞米松治疗组;FLLL31:FLLL31治疗组
小鼠肺部免疫组化分析结果(图5)表明,与正常对照组相比,模型对照组小鼠肺部炎症因子受体IL-6R的表达明显升高;与模型组相比,FLLL31治疗后,IL-6R的表达被显著抑制,提示FLLL31能有效抑制小鼠气道炎症因子受体蛋白的表达。
2.6 免疫组化分析小鼠肺组织中Ly6G的表达
进一步分析了小鼠肺组织中性粒细胞生物标志物Ly6G的表达。免疫组化分析结果(图6)表明,与正常对照组相比,模型对照组小鼠肺部Ly6G的表达明显升高;与模型组相比,FLLL31治疗后,Ly6G的表达被显著抑制,提示FLLL31能有效抑制小鼠气道中性粒细胞的招募和浸润。

图4 小鼠肺部灌洗液中炎症因子IL-6含量检测
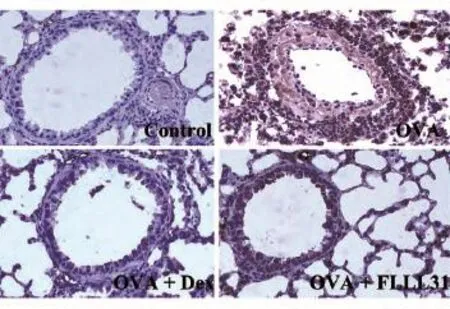
图5 免疫组化检测分析小鼠肺部炎症因子受体IL-6R表达(100×)Control:正常组;OVA:模型组;Dex:地塞米松治疗组;FLLL31:FLLL31治疗组FLLL31治疗组

图6 免疫组化检测分析小鼠肺部Ly6G的表达(100×)Control:正常组;OVA:模型组;Dex:地塞米松治疗组;FLLL31:FLLL31治疗组
3 讨论
既往认为Th2型淋巴细胞及嗜酸性粒细胞的增加是哮喘发病的重要原因,但IL-5等单克隆抗体药物在哮喘患者临床治疗中未取得预期治疗效果等结果,提示其他炎症因子及炎症细胞在哮喘发病过程中也可能发挥重要的作用[11]。近年来的研究证明,中性粒细胞在哮喘发生过程中,特别是严重性哮喘的发病中发挥重要作用。除了重要的防御作用外,中性粒细胞可以引起感染部位的炎症,使炎症反应进一步加重,引起病理性损害。因此,通过抑制中性粒细胞在气道炎症微环境中的过度表达,对治疗哮喘,特别是严重性哮喘,将发挥重要的功能[12-13]。
国际上已有STAT3小分子抑制剂治疗哮喘的相关研究报道[14],但还未见FLLL31用于免疫抑制,特别是气道炎症相关疾病治疗的报道。我们在既往研究中证实,FLLL31能特异抑制炎症细胞STAT3通路活化,阻断TNF-α、IL-1β、IL-6等多种炎症因子的表达分泌,并且在体内免疫调节动物模型中表现出较好的免疫抑制活性。在本研究中,我们进一步证明FLLL31可以有效抑制OVA致小鼠气道炎症发生,对于缓解气道炎症细胞浸润、炎症因子表达具有较好的免疫调节活性。
IL-6是重要的炎症因子,在哮喘气道炎症树突状细胞、巨噬细胞、中性粒细胞等分化发育中发挥重要作用,STAT3是IL-6在细胞内主要的信号调控通路之一[8]。哮喘患者肺内IL-6的表达增加促进肺内炎症细胞,如中性粒细胞的活化和募集。 我们既往研究证明FLLL31能够抑制炎症细胞IL-6的表达和分泌。本研究中,我们证明FLLL31能够抑制小鼠气道灌流液IL-6及其受体IL-6R的表达,进一步证明了IL-6在小鼠气道炎症发病过程中的重要作用。
此外,STAT3对于Th17淋巴细胞的分化具有关键的调控功能,能够促进炎症因子IL-17的分泌和表达[15-16],而IL-17通过调控气道微环境中的结构细胞及炎症细胞,促进中性粒细胞趋化及调控因子的表达和分泌,从而促进中性粒细胞的招募、黏附及浸润[17-18]。因此,FLLL31可能通过抑制小鼠气道炎症微环境中Th17等炎症细胞分化和IL-17等炎症因子的表达,发挥对小鼠气道炎症的抑制活性。
综上所述,我们初步证明FLLL31能抑制小鼠肺部炎症细胞与炎症因子的表达,改善小鼠气道炎症发生,有较显著的抗炎免疫调节活性。这一发现对于研发哮喘治疗药物具有重要的理论和市场价值。
[1] Holt P G,Macaubas C,Stumbles P A,et al.The role of al⁃lergy in the development of asthma[J].Nature,1999,402:B12-17.
[2] Wenzel S E.Asthma phenotypes:the evolution from clinical to molecular approaches[J].Nat Med,2012,18:716-725.
[3] Mantovani A,Cassatella M A,Costantini C,et al.Neutrophils in the activation and regulation of innate and adaptive immu⁃nity[J].Nat Rev,2011,11:519-531.
[4] Linden A,Laan M,Anderson G P.Neutrophils,interleukin-17A and lung disease[J].Eur Respir J,2005,25:159-172.
[5] Finkelman F D,Hogan S P,Hershey G K,et al.Importance ofcytokinesin murine allergic airway disease and human asthma[J].J Immunol,2010,184:1663-1674.
[6] Finotto S,Eigenbrod T,Karwot R,et al.Local blockade of IL-6R signaling induces lung CD4+T cell apoptosis in a mu⁃rine model of asthma via regulatory T cells[J].Int Immunol,2007,19:685-693.
[7] Paul B,Mishra V,Chaudhury B,et al.Status of Stat3 in an ovalbumin-induced mouse model of asthma:analysis of the role of Socs3 and IL-6[J].Int Arch Allergy Immunol,2009,148:99-108.
[8] Gao H,Ward P A.STAT3 and suppressor of cytokine signal⁃ing 3:potential targets in lung inflammatory responses[J].Exp Opin Ther Targets,2007,11:869-880.
[9] Simeone-Penney M C,Severgnini M,Tu P,et al.Airway epi⁃thelial STAT3 is required for allergic inflammation in a mu⁃rine model of asthma[J].J Immunol,2007,178:6191-6199.
[10]Lin L,Hutzen B,Zuo M,et al.Novel STAT3 phosphorylation inhibitors exhibit potent growth-suppressive activity in pancre⁃atic and breast cancer cells[J].Cancer Res,2010,70:2445-2454.
[11]Pavord I D.Non-eosinophilic asthma and the innate immune response[J].Thorax,2007,62:193-194.
[12]Lajoie S,Lewkowich I P,Suzuki Y,et al.Complement-medi⁃ated regulation of the IL-17A axis is a central genetic deter⁃minant of the severity of experimental allergic asthma[J].Nat Immunol,2010,11:928-935.
[13]Goplen N,Karim M Z,Liang Q,et al.Combined sensitiza⁃tion of mice to extracts of dust mite,ragweed,and Aspergil⁃lus species breaks through tolerance and establishes chronic features of asthma[J].J Allergy Clin Immunol,2009,123:925-932.
[14]Matsunaga Y,Inoue H,Fukuyama S,et al.Effects of a Ja⁃nus kinase inhibitor,pyridone 6,on airway responses in a murine model of asthma[J].Biochem Biophys Res Commun,2011,404:261-267.
[15]Tundwal K,Alam R.JAK and Src tyrosine kinase signaling in asthma[J].Front Biosci,2012,17:2107-2121.
[16]Yang X O,Panopoulos A D,Nurieva R,et al.STAT3 regu⁃lates cytokine-mediated generation of inflammatory helper T cells[J].J Biol Chem,2007,282:9358-9363.
[17]Park S J,Lee Y C.Interleukin-17 regulation:an attractive therapeutic approach for asthma[J].Resp Res,2010,11:78.
[18]Chang S H,Dong C.Signaling of interleukin-17 family cyto⁃kines in immunity and inflammation[J].Cell Signalling,2011,23:1069-1075.

