几丁糖电纺膜封堵脑脊液漏即刻效果的实验研究
郭兴锋侯春林*窦源东林晔雷德桥
论著·实验研究
几丁糖电纺膜封堵脑脊液漏即刻效果的实验研究
郭兴锋1侯春林1*窦源东1林晔2雷德桥1
目的研究自行研制的几丁糖电纺膜防脑脊液漏的即刻效果。方法健康成年的新西兰家兔5只,取头部正中切口在双侧颅顶部对称开直径约1.2cm大小的圆形骨窗;剪去0.8mm×0.8mm大小的硬脑膜组织,并将合适大小的几丁糖膜置入实验侧硬膜缺损区;对照侧仅行硬脑膜切除而不行硬脑膜修补以作对照;再于颅骨中线处钻一小孔,透明导管通过小孔置入硬膜膜下,见脑脊液从导管中反流,缓慢推入美蓝溶液,共重复5次实验。结果 几丁糖电纺膜与创面粘附良好,能有效地密封创面,注射美蓝后,实验侧无美蓝渗出,即使膜的下方聚集大量美蓝也未见从粘贴边缘漏出,而对照侧美蓝一直处于渗出状态。结论 几丁糖电纺膜组明显优于空白对照组,有明确的封堵脑脊液效果。
几丁糖电纺膜;脑脊液漏
硬脑膜缺损是神经外科临床上经常面临的问题,开放性颅脑损伤、肿瘤侵犯脑膜、过分电灼脑膜等因素均可导致术中硬膜无法关闭,形成缺损。而对于大面积硬膜缺损的修补较为困难,往往需要采用人工硬膜替代材料。在神经外科或脊柱外科手术中,用替代材料修补缺损的硬膜对于维持解剖学的完整和保护脑组织是十分必要的。目前临床上使用的人工硬膜几乎都是合成材料,生产工艺复杂,成本高,如强生硬脑膜补片[1],虽然能有效封堵脑脊液漏,但价格高昂。几丁糖[2]已证实是一种组织相容性良好的天然高分子材料,具有止血、抑菌、促进上皮细胞生长、抑制成纤维细胞生长[3]等功能,传统工艺生产的几丁糖膜脆性大,与组织黏附性差,缝合强度不足,本实验新西兰家兔使用的材料,是以单一几丁糖为原料、通过电纺技术制成几丁糖电纺膜(chitosan electrospun membrane,CEM),强度大、厚度薄、柔韧性好,体外生物力学实验证实其物理性能适合作为防止脑脊液漏及防粘连的材料,本实验拟通过动物实验,研究该敷料防脑脊液漏即刻效果,术后防止脑脊液流出,为临床应用提供依据。
1 材料与方法
1.1 实验动物及主要试剂、仪器
几丁糖电纺膜(本课题组自行研制);美兰及导管(第二军医大学附属长征医院手术室提供);新西兰兔、异戊巴比妥钠粉剂及实验器械耗材等其他物品(由第二军医大学动物实验中心提供)。
1.2 几丁糖电纺膜的制备方法和基本性能特征。
将0.13g几丁糖溶解于10ml六氟异丙醇和乙酸的混合溶液 (乙酸体积分数为2%)中,在室温下搅拌一晚形成均一稳定的溶液。之后将几丁糖溶液转移到注射器中,注射器针头处连接高压电源。溶液供给流量通过微流泵控制在5ml/ h,施加的电压为15kv,高压端同接地端的距离为15cm,所使用滚筒的旋转速度为100rpm。通过此过程,可收集到几丁糖纳米纤维膜,其纤维丝直径为 300nm左右、厚度在0.13mm左右。将收集得到的几丁糖纳米纤维膜在室温下放置一晚后,继续在37℃真空烘箱内干燥一晚,之后根据需要裁剪成具有特定形状和尺寸的几丁糖硬脑膜修补材料。

图1 几丁糖电纺膜
1.3 动物模型制备及分组
取健康成年的新西兰家兔5只,19月,体重2.3~3.1kg,雌雄不限。用3%戊巴比妥钠按30mg/kg行兔耳缘静脉注射麻醉,将头部固定于动物手术头架上。备皮消毒后,取头部正中切口纵行切开头皮,分离颞肌及颅骨骨膜,用微型磨钻在双侧颅顶部对称开直径约1.2cm大小的圆形骨窗;再于手术显微镜下剪去0.8 mm×0.8cm大小的硬膜组织,并将适当大小几丁糖膜置入左侧硬膜缺损区,过硬脑膜腔边缘 5 mm,直接贴敷,覆盖硬脑膜缺损区域。用Prolene缝线(5-0缝线),在定点缝合固定,防止移动[4]。右侧仅行硬脑膜切除而不行硬脑膜修补以作对照。再于颅骨中线处钻一小孔,透明导管通过小孔置入蛛网膜下腔,见脑脊液从导管中反流,缓慢不间断注射美蓝溶液设定恒压注射器 (输液泵)注射压力为800mm水柱,远远大于正常成人脑脊液压力(80~200mm水柱),每只家兔观察时间为30秒。共重复了5次实验,结果一致。(彩图见插页)
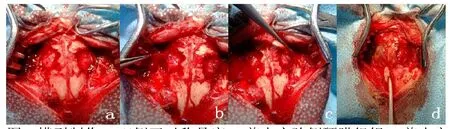
图2 模型制作:a双侧开对称骨窗;b剪去实验侧硬膜组织;c剪去空白对照侧硬膜组织;d颅中线处置入透明导管于硬膜下
1.4 检测指标
通过向硬脑膜内缓慢注射美蓝溶液,观察美蓝溶液漏出情况以评价几丁糖电纺膜在术中封堵脑脊液漏的即刻效果。
2 结果
注射美蓝过程中,实验侧一直未见美蓝从几丁糖电纺膜修复的硬膜缺损处周围流出,而对照侧美蓝从硬脑膜缺损处大量流出,详见实验照片。(彩图见插页)
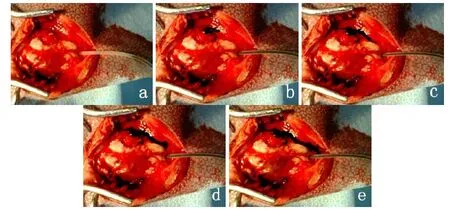
图3 推入美蓝效果观察:a贴膜缝合固定后推入美蓝溶液(导管中见美蓝;b推入后第1秒(见美蓝从对照侧流出);c第2秒(对照侧美蓝增多);d第3秒(对照侧美蓝大量增加,实验侧未见);e第4秒(见右侧大量美蓝,实验侧仍然未见美蓝露出,敷贴效果好)
3 讨论
在施行脊柱、头颅手术后,普遍存在脑脊液漏。发生脑脊液漏后,目前常用的处理方法包括伤口加压包扎、术区持续引流,经皮蛛网膜下腔引流等[1],但效果均不够理想,可导致一系列并发症,如颅内感染、切口迁延不愈、癫痫发作[2]。Lee,L[3]经过回顾十年的病例资料研究表明术后癫痫发作 (14.81%)、感染 (9.05%),出血 (1.65%)和其他 (0.82%)被确定的并发症。因此防止脑脊液漏是一个亟待解决的问题,对于小的缺损,可以采用自体组织如肌筋膜等进行修复,但文献报道在软脑膜损伤的情况下,但容易因为粘连导致癫痫发生的隐患,其综合效果不理想;而对于大面积硬膜缺损的修补较为困难,往往需要采用人工硬膜替代材料。Matsumoto,Y[4]等成功应用人工硬膜硬脑膜替代硬脑膜,封闭硬脑膜下腔,恢复正常解剖结构,观察14年后没有观察到明显的变化。人工硬膜的应用在预防和治疗脑脊液漏方面有此独到之处,有利于降低癫痫等术后并发症的发生率,没有引起颅内感染的增加。目前研究者们已发明很多种类的生物材料,如丝素蛋白膜、羊膜、生物胶原、高分子聚合材料及壳聚糖 (几丁糖)为材料人工硬膜等[5,6],以上材料都存在各自的不足之处,如丝素蛋白膜在制作工艺上有不少缺陷,仍有待进一步改进;羊膜在取材方法难以控制,而且与交联剂的选择方面值得进一步探索和研究;生物胶原空间网状结构不明显,不利于自身成纤维细胞支撑与附着;高分子聚合材料因为具有生物学毒性,而且理化性能也有待进一步实验确证。几丁糖具备良好的组织相容性,可以被机体降解吸收,而且在体内几乎不引起任何免疫排斥反应,具有良好的成膜性,把几丁糖制成具有一定超微的结构的装置,我们将它制作成膜的形式,放置在手术部位,如肌腱、神经以及可能发生相互粘连的损伤组织之间作为一种隔膜,起到阻隔的作用,因为创伤组织修复愈合需要2~3周,这种隔膜有效的将新生组织相互间隔,由于几丁糖可以被机体慢慢吸收,一般在数月内可以吸收完毕,这时创伤组织已完全愈合,而且几丁糖膜周围可以形成一层自体组织膜从而起到封堵脑脊液及防粘连作用[7];同时,壳聚糖止血效果好,可有效的防止纤纤维蛋白丝聚集。几丁糖作为膜制品,目前有些报道[8,9],但这些膜制品几乎都没有应用到临床,因为这些膜制品还有很多缺陷和不足之处,与我们理想的人工硬膜制品还有相当程度的差距,主要有:几丁糖膜与人体自身组织贴服性不佳;脆性较大,手术操作时难以对其进行包裹固定,缝合的强度明显不足;由于复合了其他原料,植入前期出现不明原因的轻度炎症反应和异物反应。理想的硬膜修补材料必须具有:①应在物理性能上与人硬膜相似,具有一定的弹性、韧性,并经得起缝合,能有效的恢复硬膜下腔的完整性;②具有良好的生物相容性;③能为硬膜的自体修复提供支架,以利于成纤维细胞生长和移动,从而促使硬膜再生,新硬膜形成后,移植物能被逐渐吸收,以防长期存在于体内的异物给身心带来不良影响;④不增加术后感染率和颅内血肿发生率;⑤对周围神经组织无损害,不传播疾病;⑥易于消毒储存,经济易得,使用方便。本课题经过多年探索,研制了新型几丁糖膜,我们称之为几丁糖电纺膜,通过电纺技术以单一几丁糖为原料制备而成。几丁糖电纺膜与脑膜敷贴性优异,固定牢靠,与创面粘附良好,能有效地密封创面。生物相容性良好,从即刻效果看,几丁糖电纺膜质地柔软,与创面粘附良好,能有效地密封创面从而封堵脑脊液漏,对脑组织无损伤;实验过程中,我们观察发现,几丁糖电纺膜与硬膜接触后,能快速从干燥状态变为湿润状态粘于硬膜外与破损处,膜的缝合强度大,即使用角针也不易使膜破裂,湿润后缝合效果更佳,缝线目的是防止手术及术后几丁糖电纺膜位置移动,与封堵硬膜破损无关。注射美蓝后,实验侧无美蓝渗出,而对照侧美蓝一直处于渗出状态。但该材料用于修复硬脑膜缺损的远期转归,组织相容性如何,能否完全降解吸收,吸收后原缺损处能否形成膜样组织等,后续实验我们将通过组织学(HE染色,masson染色),免疫组化,电镜等方法进一步评价其远期疗效。期望其下方能新生一层类似硬脑膜的新生纤维组织膜,具备硬膜重建功能,同时具备一定程度抗感染、促进创面愈合功能,远期防脑脊液漏效果明确。当新生纤维膜组织修补完成缺损区域之后,几丁糖电纺膜逐步被自体组织降解、吸收、当完全吸收,新生纤维组织膜完全替代硬脑膜,达到了具有实际意义的硬脑膜重建。由于几丁糖电纺膜具备以下优点:以单一几丁糖为原料,大大降低了生产成本;通过静电纺丝技术制成,强度大、厚度薄、柔韧性好,术中能较好包裹及缝合固定。其物理性能非常适合作为术中防止脑脊液漏的材料;由于其原料丰富,价格低廉,容易取得,具有非常广阔的临床应用前景。
[1] Hughes SA,Ozgur BM,German M,et a1.Prolonged Jackson-Pratt drainage in the management of lumbar cerebrospinal fluid leaks. Surg Neurol,2006,65(4):410-415.
[2] 漆松涛,邱炳辉,欧阳辉,等.创伤性癫痫的临床特征及外科治疗[J].第一军医大学学报,2004,24(4):472-474.
[3] Lee,L,et al.A retrospective analysis and review of an institution's experience with the complications of cranioplasty.Br J Neurosurg, 2013,27(5):629-35.
[4] Matsumoto,Y,et al,Histological examination of expanded polytetrafluoroethylene artificial dura mater at 14 years after craniotomy:case report.Neurol Med Chir(Tokyo),2013,53(1):43-6.
[5] Hurt AP,Getti G,Coleman NJ.Bioactivity and biocompatibility of a chitosan-tobermorite composite membrane for guided tissue regeneration.International journal of biological macromolecules. 2014,3,64:11-6.PubMed PMID:24296410.
[6] Kievit FM,Cooper A,Jana S,Leung MC,Wang K,Edmondson D, et al.Aligned chitosan-polycaprolactone polyblend nanofibers promote the migration of glioblastoma cells.Advanced healthcare materials.2013,2(12):1651-9.PubMed PMID:23776187.Pubmed Central PMCID:3859701.
[7] Pogorielov M,Kalinkevich O,Gortinskaya E,Moskalenko R, Tkachenko Y.[The experimental application of chitosan membrane for treating chemical burns of the skin].Georgian medical news,2014,1(226):65-70.PubMed PMID:24523336.
[8]何继银,,劳杰,顾玉东,等.激活态雪旺细胞在胶元几丁糖膜上生长规律的实验研究.生物骨科材料与临床研究,2004,1(4): 11-13.
[9] Xu C,Lei C,Meng L,Wang C,Song Y.Chitosan as a barrier membrane material in periodontal tissue regeneration.Journal of biomedical materials research Part B,Applied biomaterials,2012, 100(5):1435-43.PubMed PMID:22287502.
Experimental study of immediate effect of chitosan electrospun membrane plugging cerebrospinal fluid leakage
Guo Xingfeng1,Hou Chunlin1,Dou Yuandong1,et al.1 Department of Orthopetic Surgery,Changzheng Hospital of the Second Military Medical University,Shanghai,200003;2 Institute of Nephrology,Changzheng Hospital,Shanghai, 200003,China
Objective To study the immediate prevention effect of cerebrospinal fluid leakage by using self-developed chitosan electrospun membrane.Methods Took 5 healthy adult New Zealand rabbits,via midline incision of head,made circular bone window,about 1.2cm in diameter,in the bilateral parietal skull symmetrically.Cut 0.8 mm×0.8mm cerebral dura mater,put suitably sized Chitosan membrane into the experimental side of dural defect area;simultaneously,on the other side,only cut and not repaired cerebral dura mater as control group.Drill a small hole in the midline of skull,put a transparent tube through the hole into the subdural,saw cerebrospinal fluid reflux from the tube,and injected methylene blue solution slowly.Repeat for 5 times.Results Chitosan electrospun membrane adheres well to the wound and sealed the wounds effectively.After injecting methylene blue solution,no effusion happened on the experimental side,even there gathered a large number of methylene blue under the membrane,no solution exposed from the edge of film,while on the other side,the control group had methylene blue oozed all the time.Conclusion Chitosan membrane group was superior to the controls,the plugging effect on cerebrospinal fluid leakage can be determined.
Chitosan electrospun membrane;Cerebrospinal fluid leakage
R318.08;Q813.1
A
10.3969/j.issn.1672-5972.2014.04.001
swgk2013-12-0269
郭兴锋(1980-)男,博士在读,主治医师,研究方向:创伤骨科与修复重建外科,生物材料。
*[通讯作者]侯春林(1945-)男,教授,博士导师,研究方向:创伤骨科与修复重建,生物材料。
2013-12-09)
1第二军医大学附属长征医院骨科医院,上海 200003;2第二军医大学肾病研究所,上海 200003

