CS/HACC/GP温敏水凝胶复合 MSCs的实验研究*
李广峰吴献民杨国庆张友忠曹中华尹志峰何国云王静成杨建东*
论著·实验研究
CS/HACC/GP温敏水凝胶复合 MSCs的实验研究*
李广峰1吴献民1杨国庆1张友忠1曹中华1尹志峰1何国云1王静成2杨建东2*
目的 制备壳聚糖 (CS)/壳聚糖季铵盐 (HACC)/甘油磷酸钠 (GP)温敏性水凝胶,检测其成胶时间、超微结构、渗透压、生物安全性等性质,将其和骨髓间充质干细胞(MSCs)复合培养,观察MSCs的生长情况。方法 制备壳聚糖季铵盐,将壳聚糖/壳聚糖季铵盐/甘油磷酸钠按一定配比制备温敏性水凝胶,观察其成胶情况、内部超微结构,测量孔隙率、孔径大小,评估其降解情况,进行生物安全性检测。将 MSCs与支架复合培养,倒置显微镜观察凝胶表面细胞生长情况,扫描电镜观察凝胶内部细胞的生长、增殖情况。结果 成功制备 HACC,水凝胶37℃时10分钟可成胶,生物安全性好,渗透压为290~310 mmol/kg,水凝胶无细胞毒性,其浸提液对小鼠体重增加无影响。扫描电镜见内部结构多空疏松的三维网状结构,孔径50~100um,孔隙率≥85%,降解时间约12周。MSCs在水凝胶中能正常生长、增殖。结论 本实验证明CS/HACC/GP温敏水凝胶孔隙率、孔径大小合适,无细胞毒性,适合MSCs生长、增殖,具有较大的潜力成为神经组织工程中的细胞支架。
壳聚糖季铵盐;温敏水凝胶;生物安全性;骨髓间充质干细胞
前言
脊髓神经损伤后,脑脊膜的开放易造成细胞弥散流失,不利于细胞粘附于受损部位的组织进行分化和增殖,断端神经胶质及结缔组织增生形成的斑痕组织阻碍了再生神经纤维向前生长,加之营养缺乏、代谢障碍等原因,细胞和组织容易杂乱生长使其达不到原位而失去功能。近年来脊髓组织工程技术的兴起为脊髓损伤后神经功能的修复带来了新的希望,该技术将具有生物活性的细胞、支架等复合物植入于脊髓损伤部位后可构成细胞迁移和轴突生长的模板,提供神经再生的微环境,诱导轴突粘附、分枝向靶目标生长,随着再生的轴突迁移并包裹神经纤维,桥接修复损伤的组织,减少中枢神经胶质瘢痕形成,引导细胞的正常的生长、增殖、分化、迁移、表型以及凋亡,引导轴突再生到灰质和白质内,促进脊髓神经的再生[1-3],恢复其解剖学的结构和功能[4]。温度敏感水凝胶属于复合支架材料,被广泛应用于组织工程、药物释放系统等的研究。骨髓间充质干细胞[5-7]作为脊髓组织工程的种子细胞之一,易于分离和培养扩增,在体内、体外均有分化为神经细胞和胶质细胞的潜能,可从骨髓穿刺获取,操作容易,损伤少,安全性好,可实现自体移植,具有免疫原性弱,有广阔的应用前景[8,9]。
1 实验材料和仪器
壳聚糖,氢氧化钠,异丙醇,冰醋酸, ,-甘油磷酸钠 (,-GP),氯化缩水甘油三甲基铵 (环氧值 84.57%),DMEM,胎牛血清,骨髓间充质干细胞 (MSCs,本实验室自备),MilliQ plus超纯水系统,Tensor27傅立叶变换红外光谱仪,AVANCE600核磁共振波谱仪,S648-恒温水浴箱,电子天平,Labconco系列冷冻干燥机,循环水式真空抽滤泵,超净工作台,WFJ72系列可见分光光度计,Zetasizer HS3000检测仪,磁力搅拌器,pH-3BC精密数显酸度计,XL-30ESEM环境扫描电子显微镜,倒置荧光显微镜,CO2细胞培养箱,细胞培养板等。
2 实验方法
2.1 壳聚糖季铵盐的制备及物理性能检测
复凝聚法制备季铵盐壳聚糖(HACC),取少量样品送扬州大学检测中心进行傅立叶变换红外光及1H-NMR测试。配制HACC过饱和溶液,测量其溶解度。
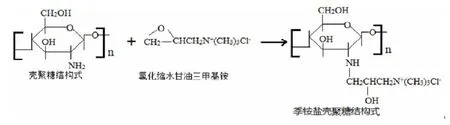
图1 壳聚糖与氯化缩水甘油三甲基铵反应生成壳聚糖季铵盐示意图
2.2 壳聚糖/壳聚糖季铵盐/甘油磷酸钠(CS/HACC/GP)温敏水凝胶的制备
配制50%的 ,-GP溶液、0.1mmol/L的乙酸,0.22um滤器过滤除菌。将0.16gCS与0.02gHACC的混合物及0.18g CS分别溶解于7ml的0.1M乙酸中,搅拌,各加入2ml的H2O(2%W/V),高压蒸汽灭菌备用。冰浴搅拌中分别将 , -GP逐滴加入壳聚糖、季铵盐壳聚糖醋酸溶液 (体积比为1∶4)。继续搅拌20分钟得CS/HACC/GP及CS/GP温敏水凝胶。将共混液于37℃水浴30分钟,成胶,液氮中快速冷冻、干燥48小时,扫描电镜检测凝胶表面结构。试管倒置法观察水凝胶37℃的溶胶-凝胶转变。以试管倒置30秒样品不流动为凝胶状态。
2.3 水凝胶物理性质测定
将液态水凝胶种于96孔板中37℃孵箱培养过夜,渗透压计测量渗透压。t时刻水凝胶平衡溶胀率ESR=(Ws-Wd)/ Wd。Wt、Ws、Wd分别是水凝胶在时间t时刻、达到最大溶胀后和干燥状况下的质量。乙醇替代法测量孔隙率,孔隙率=(V0-V2)/(V1-V2)×100%。测5次取平均值。将材料剪成规则的条状 (W0),浸在10mL的37.0℃PBS(pH=7.4)中,每周换液,定期取样,冲洗后干燥称重,第n次重量为Wn。重量损失L=(W0-Wn)/W0×100%。每周测降解液pH值。每4周进行电镜扫描检测。
2.4 水凝胶生物安全性检测
参照浸提液细胞毒性实验标准,制备水凝胶37℃细胞培养液24小时浸提液,稀释成原液浓度的75%、50%、25%、12.5%、6.25%。配制MMT液,选择生长良好的4代MSCs,用培养液 (不含血清)配成单细胞悬液,每孔2.5×104个细胞接种到96孔板,每孔体积200ul。37℃5%CO2培养箱中培养24小时,每孔加不同稀释比例的材料浸提液,继续孵育24小时。每孔加MTT20ul,孵育4小时,终止培养,吸弃上清,每孔加150ulDMSO,振荡10分钟,使结晶物充分融解。选择490nm波长,在酶联免疫监测仪上测定各孔光吸收值 (A值),细胞相对增殖率 (RGR)=(实验组A均值/阴性对照组值)×100%,根据计算值进行细胞毒性分级 (0-5级)。

表1 细胞相对增殖率及细胞毒性的分级关系
急性全身毒性实验:取15只小鼠,17~23g,雌雄不限,随机分三组,每组5只。按25ml/Kg将24小时水凝胶生理盐水浸提液通过尾静脉注射,阴性对照为同批号无菌生理盐水,阳性对照为0.25%的除菌苯酚溶液,观察注射后及24、48、72小时小鼠的一般状态、毒性表现及死亡情况,并称量体重,观察体重变化。

表2 材料毒性程度评价
溶血实验:新鲜兔血10ml,再加2%草酸钾0.5ml抗凝,三个EP管中分别加入浸提液、蒸馏水 (阳性对照)、生理盐水 (阴性对照)10ml。再加兔血0.2ml,混匀,37℃水浴60分钟,750g离心5分钟取上清,分光光度计测545nm的A值。测定兔红细胞溶解度和血红蛋白游离程度。公式:(试样A-阴性)/(阳性A-阴性A)×100%;阴性管A<0.03,阳性管A为 (0.8±0.30)有效,溶血率≤5%,符合要求。
2.5 MSCs在水凝胶表面的形态观察
1.7ml无菌的壳聚糖水凝胶加入6孔细胞培养板中,铺匀,置37℃细胞培养箱中3小时,使之转变成凝胶状。每孔接种生长良好的第4代骨髓间充质干细胞悬液(1×106cells/ ml)0.5ml,倒置显微镜下观察MSCs形态及生长情况。
2.6 MSCs在温敏水凝胶中培养
超净台中,冰溶中将1体积GP溶液逐滴加入4体积2% CS/HACC醋酸溶液充分搅拌混匀。按所需细胞接种浓度 (1× 106cells/ml)将制备好的水凝胶溶液与消化收集的MSCs快速充分混悬,(每孔0.5ml混悬液)接种于24孔培养板,37℃培养箱内静置10分钟。各孔滴加lml含血清DMEM继续培养,两天换液一次。倒置显微镜观察细胞在凝胶内粘附、生长和增殖等情况。在细胞接种后选择不同时间取出复合材料,戊二醛固定后送扬州的大学检测中心做扫描电镜(SEM)观察。
3 统计学分析
4 结果
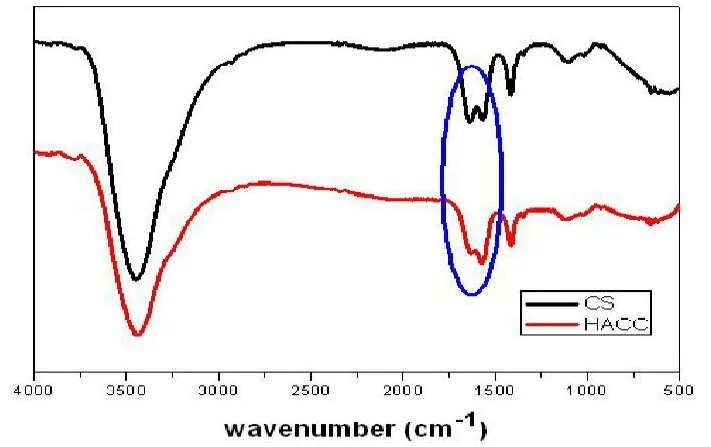
图2 壳聚糖(CS)及壳聚糖季铵盐(HACC)的傅里叶红外光谱图(FTIR)
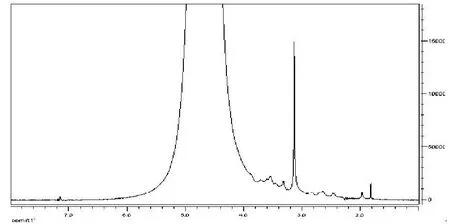
图3 壳聚糖季铵盐 (HACC)1HNMR谱图
4.1 壳聚糖季铵盐的物理性能检测
由图2、3见:红外光谱图的HACC波长1599.0cm-1处的吸收峰消失,表明壳聚糖分子中亲核中心-NH2上的H已被-CH2CH(OH)CH2N+(CH3)Cl-取代生成了2-羟丙基三甲基氯化铵壳聚糖(HACC)。在3400.0cm-1处HACC的吸收峰变宽,说明-OH的吸收变强,阳离子醚化剂与壳聚糖的氨基上发生取代,基本不与苯环上的羟基反应。核磁分析见壳聚糖季铵盐的1HNMR谱图在 =3附近出现很明显的强峰,代表季铵基团-N+(CH3)3最大吸收峰,说明在所选择的反应条件下季铵基壳聚糖衍生物确实已形成。(图2彩图见插页)
4.2 水凝胶成胶过程及物理性能

图4 壳聚糖/季铵盐壳聚糖/温敏水凝胶在37℃下由溶胶态到凝胶态凝胶的转变过程,1-6代表时间的先后顺序

图5 CS/HACC/GP水凝胶修剪成形后外观

图6 CS/HACC/GP水凝胶经冷冻干燥后的外观
温敏水凝胶在温度低于体温时保持液体流动状态,高于体温时则转变成凝胶状态。温敏性水凝胶在37°C水浴中10分钟成胶。成胶前为透明、流动性液体,成胶后为固态、乳白色凝胶成胶前溶液可用注射针头注射。成胶后则不可注射具有一定粘性,不沾手,具有一定弹性,硬度与脊髓组织相似,可任意塑型。在低糖培养液中的渗透压为290~310mmol/ kg。溶胀实验中,水凝胶在PBS中1小时达到平衡,平衡溶胀率为250%。

图7 水凝胶的扫描电镜图。图A1(×5000)、B1(×2500)、C1(×1000)、D1(×500)为CS/HACC/GP扫描电镜图,A2(×5000)、B2(×2000)、C2 (×1000)、D2(×500)为CS/GP扫描电镜图
由上图可见:水凝胶内部结构均为相互连接贯通的三维多孔网状结构,HACC为水溶性盐类,它的加入可使整个CS/HACC/GP水凝胶体系中分散的较单纯CS/GP水凝胶更加均匀,内部结构更加规则,内部网络连接更多。CS/HACC/ GP水凝胶在冷冻干燥过程中,失水迅速,分枝结构增多,因此孔径会较CS/GP水凝胶增大。CS/HACC/GP水凝胶表面略显粗糙,更利于MSCs的细胞粘附,其孔径大小约50~100um,该支架具有丰富的孔隙率,孔隙率在85%以上,较单纯CS/GP水凝胶更为适合MSCs生长、增殖、分化及物质交换的需要。本实验中乙醇替代法测定孔隙率在85%以上,与扫面电镜观察到的结果一致。

图8 壳聚糖/壳聚糖季铵盐/甘油磷酸钠水凝胶扫描电镜图,将固体水凝胶浸入PBS(37℃,pH=7.4)中,于设定的时间取出行扫描电镜检测,A、B、C、D分别为材料降解0、4、8、12周后的扫描电镜图,放大倍数分别为:A1(×500)、A2(×100)、B1(×700)、B2(×5000)、C1(×1000)、C2 (×5000)、D1(×5000)、B2(×10000)
由上图可见材料内部具有孔隙率较高的网状连接的三维立体结构,最初孔径约50~100um,随着时间的推移,支架的空隙会逐渐增多,孔径逐渐增大,在8周以后降解更加明显,第12周时几乎完全失去材料的正常形态,呈碎片状,这样就能及时为细胞生长提供足够的空间,不至于妨碍正常细胞组织的生成。
降解情况:降解率随着时间的迁移,逐渐增加。前8周支架降解缓慢,在第8以后降解速度增加,第12周时降解率近86%,可及时为种植于其中的细胞生长、组织生成腾出适当空间。降解液pH值在12周内基本平稳,在7.20左右,体内pH值很接近。
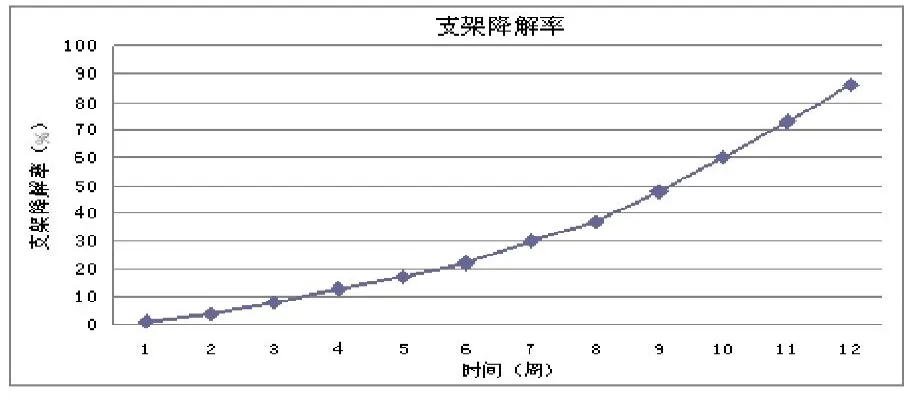
图9 在不同时间测定材料的质量损失率代表材料的降解率
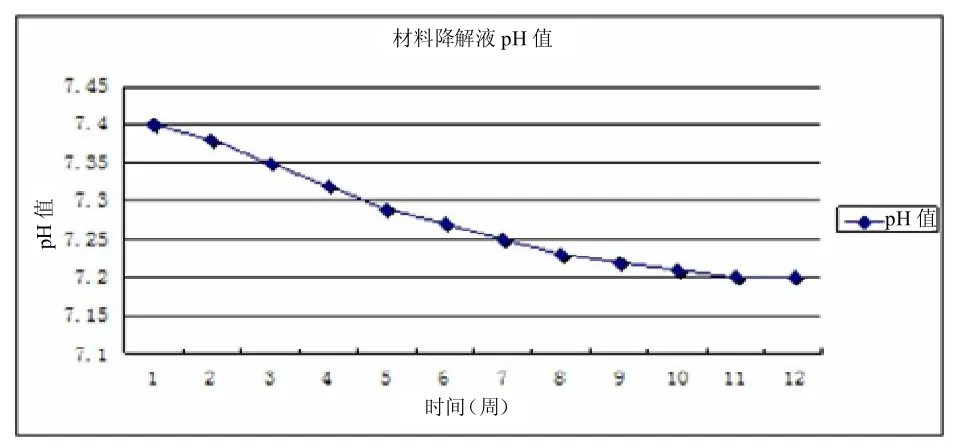
图10 每周将材料从PBS(pH=7.4)中取出,测定材料的降解液pH值
4.3 细胞毒性
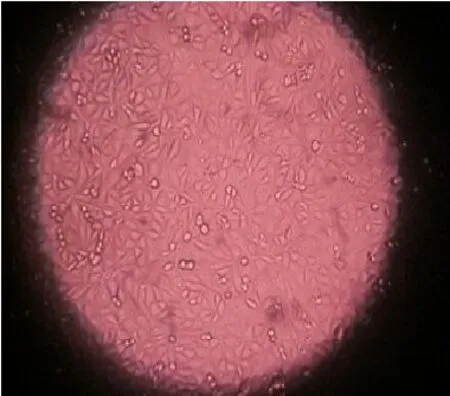
图11 MSCs细胞在浸提液中培养24小时镜下图片(×40)
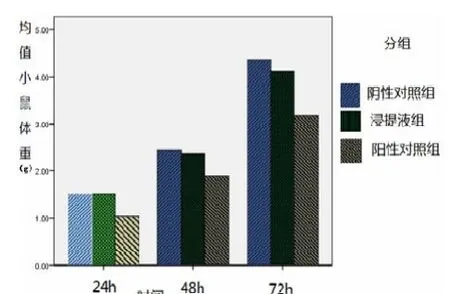
图12 小鼠尾静脉注射生理盐水、浸提液、苯酚溶液后不同时间体重变化
由图11可见细胞在浸提液中培养24小时后,绝大部分贴壁,细胞伸展生长良好,细胞呈梭形、多边形或不规则形,无明显的细胞结构损伤,细胞在支架浸提液中培养未见明显毒性反应。(图11、12彩图见插页)
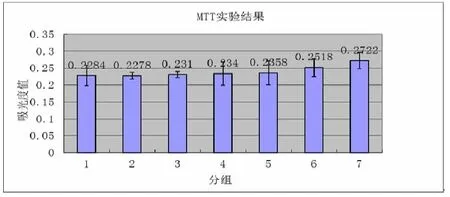
图13 MSCs培养24小时后,不同浓度的材料浸提液吸光度值,1原液,2 75%浸提液,3 50%浸提液,4 25%浸提液,5 12.5%浸提液,6 6.25%浸提液,7对照组(细胞培养液)
MTT细胞毒性结果示各浓度浸提液与对照组吸光度值相比均无明显差异(P>0.05),组间亦无明显差异(P>0.05)。表明材料浸提液对细胞无毒性,MSCs在水凝胶浸提液浸提液中相对增殖率高于80%,细胞增殖力毒性评级为0-1级,说明壳聚糖水凝胶具有良好的细胞相容性,壳聚糖水凝胶可作为细胞培养的支架材料。
急性全身毒性实验:材料浸提液组、生理盐水组注射后小鼠全身一般状态良好,未见毒性反应及死亡,24、48、72小时体重均明显增加。苯酚组注射后出现寒战,发抖,眼睛略有水汪汪表现,十几分钟后逐渐好转,一般状态尚好,无动物死亡,24、48、72小时体重增加前两组较少。浸提液组小鼠体重增加与生理盐水组 (阴性对照组)比较无统计学意义(P>0.05)。苯酚组 (阳性对照组)与生理盐水组 (阴性对照组)比较有统计学意义 (P<0.05)。说明浸提液对小鼠无急性全身毒性反应。
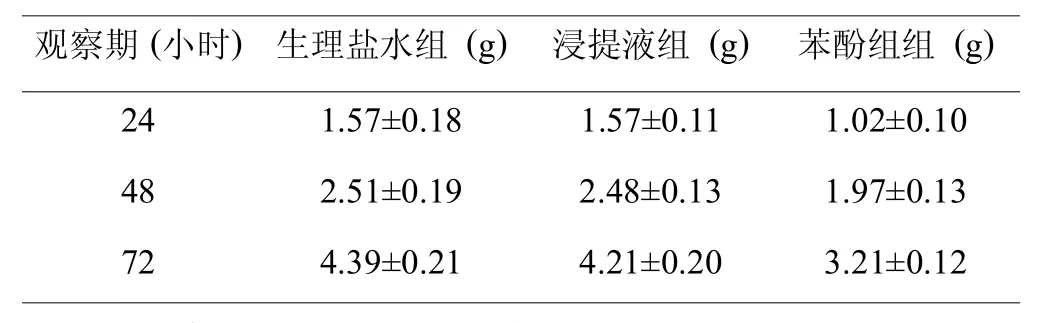
表3 全身急性毒性实验动物体重变化情况
溶血实验:浸提液组、生理盐水组肉眼观未见溶血反应,液体分层,上层为清凉无色液体,下层为暗红色红细胞沉淀物。图片镜检未见红细胞形态破裂或凝聚。蒸馏水组外观为均匀一体的红色,镜下见红细胞绝大部分破碎,凝聚,细胞形态消失。阴性管A<0.03,阳性管吸光度为(0.8±0.20),符合标准。浸提液的溶血率≤5%,体外实验不引起溶血反应,满足医用生物材料的要求。
4.4 MSCs的培养及传代
图14 倒置显微镜下第4代第7天的骨髓间充质干细胞形态(左,×40);倒置显微镜下第4代第7天的骨髓间充质干细胞形态(右,×100)
图为倒置显微镜镜下原代培养的第3代培养第6天的骨髓间充质干细胞生长状态,镜下细胞的形态呈长梭形,见其生长良好。(彩图见插页)
材料表面细胞形态观察:
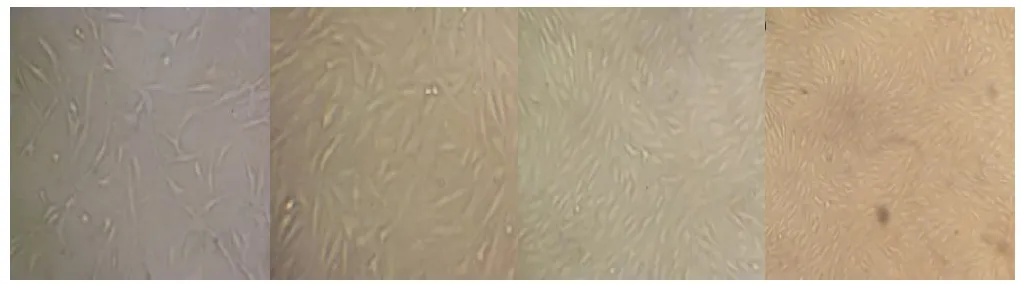
图15 分别为在材料表面培养的MSCs第1、3、5、7天倒置显微镜下图像
细胞能在支架材料上良好附着、生长和增殖,伸展良好,呈梭形、多边形或不规则形,见细胞圆缩及悬浮细胞。细胞接种2小时见其在支架材料表面均匀分布,部分细胞贴附在膜表面上,形态与成纤维样细胞形态类似,为梭形。6~8小时细胞大部分粘附,形态开始变为梭形,3天后首次换液,大部分细胞完成伸展变形,形态为梭形,呈网状排列,极少部分细胞仍呈圆形。以后2~3天换液1次。随培养时间的延长,支架表面上的细胞数量逐渐增加,但慢于培养瓶中培养的细胞增殖速度,增殖细胞聚集呈鱼群状生长。(彩图见插页)
髓间充质干细胞在壳聚糖凝胶中体外培养观察:

图16 水凝胶中培养5天的MSCs细胞扫描电镜图(A,×2000);水凝胶中培养5天的MSCs细胞扫描电镜图(B,×5000);图19-C水凝胶中培养15天的MSCs细胞扫描电镜图(C,×1000);水凝胶中培养15天的MSCs细胞扫描电镜图(D,×10000)
支架内部结构为三维疏松网状结构,空隙大于细胞直径,满足细胞正常生长、增殖及物质交换的需要。骨髓间充质干细胞与支架材料复合培养5天时,细胞牢固茹附于支架材料内表面,呈铺展式生长。15天时,多数骨髓间充质干细胞在支架上呈多角形生长,并生出多条小突起,支架材料及材料多通道内表面基本被细胞覆盖。表明细胞在支架中可以正常吸附贴壁、生长、增殖,细胞与支架具有良好的生物相容性,为CS/ HACC/GP支架联合MSCs移植治疗脊髓损伤提供了依据。
5 讨论
应用于脊髓工程中的温敏水凝胶制备条件温和,在室温或低于室温下可较长时间保持液态,而温度升高到体温后发生胶凝,相变温度与人体体温接近甚至低于人的体温,没有引入化学交联剂等可能产生细胞毒性的物质,具有良好的生物相容性和生物可降解性,在组织工程和药物缓释载体等方面具有极大的应潜力。
在甘油磷酸盐温度敏感水凝胶的研究中,Chenite[10]等以甘油磷酸盐调控壳聚糖及水分子间相互作用,制备壳聚糖/甘油磷酸盐水溶性复合物,以注射方式植入体内,原位凝胶化,展示了良好的生物相容性[11]。Zhou和 Wu等[12,13]分别研究了两种甘油磷酸盐 (-GP和 ,-GP混合物)对于成胶性能的影响,表明 ,-较 -具有更快的成胶速度。因为 ,-中的 -为线性分子结构,其形成的空间位阻较 -的要小,体系中的CS分子间的疏水相互作用更易于形成。在其它条件保持不变时,甘油磷酸钠浓度越高,CS/HACC/GP共混液的成胶时间越短。另外, ,-GP呈弱碱性,能与酸中和,起到缓冲电解质的作用。但甘油磷酸钠浓度越高,相应的副作用会增加。本实验选用56%的 ,-GP溶液,成胶时间较合适。
壳聚糖结构类似于动物体内的糖胺聚糖,具有抗菌性、生物可降解性、安全无毒、生物相容性、细胞黏附性等独特优良性能[14]。在人体内壳聚糖可被溶菌酶等降解,可通过选择不同的壳聚糖或通过化学修饰,按照组织工程的不同要求来控制其在体内的降解速度。壳聚糖分子表面带有亲水的功能基团,为细胞提供了一定密度的正电荷,通过静电作用对细胞膜上带有负电荷的细胞更有亲和力,使其便于细胞黏附。Cheng等[15]的实验提示粘连蛋白-壳聚糖神经导管有阻止神经胶质瘢痕的形成,促进神经再生的作用。Lin等[10]研究了用不同比率型胶原/透明质酸/壳聚糖制造的复合多孔支架的特性,证明在该共聚物支架中培养的成纤维细胞的分化很好,型胶原、透明质酸、壳聚糖按9∶1∶1的比率制作的复合支架各种理化性质相对最优。
壳聚糖季铵盐水溶性较壳聚糖大为增加。据文献[16]介绍,制备水凝胶时,在壳聚糖链上引入强亲水性的季铵基团,增强了与磷酸基团之间的静电引力,使得成胶速度明显缩短。壳聚糖与聚阴离子形成交联复合物溶胀出现皱褶,这种粗糙的表面更利于细胞贴壁。在一定条件下,随聚阴离子浓度的增加,出现的皱褶更多,引起贴壁率的增加。研究发现,HACC溶液与GP溶液共混后的体系(HACC/GP)亦有温敏特性,与CS/GP水凝胶相比,HACC/GP水凝胶呈透明态,对环境pH值更敏感。本实验用廉价的2,3-环氧丙基三甲基氯化铵为季铵化试剂,成功制备了水溶性更好的壳聚糖季铵盐衍生物,通过红外、核磁谱图分析所合成产物结构,确定生成了壳聚糖季铵盐。实验中经过对壳聚糖/壳聚糖季铵盐不同配比成胶效果的对比,发现壳聚糖与壳聚糖季铵盐比例为8∶1比较合适,成胶时间较短,约10分钟,继续增加HACC的含量,CS/HACC/GP体系无法成胶。
利于成胶的因素包括低的酸浓度和高的壳聚糖浓度,为了既能保证壳聚糖及其衍生物的溶解,又能保证低的酸浓度,本研究选用酸浓度0.1mol/L,壳聚糖浓度为2%,制备出的水凝支架硬度与脊髓组织相似,不黏手,孔隙率在85%以上,具有生物降解性,降解液基本呈中性,因此该水凝胶可为神经干细胞的生长及营养物质交换提供足够的空间。如果将水凝胶在普通条件下干燥,水凝胶干燥后的体积变化会很大,这样就使水凝胶的孔洞结构因水分的失去而塌陷,本研究采用液氮淬冷后冷冻干燥的方法,可以使水凝胶的孔洞结构得到较好的保持。
本实验根据ISO10993.1和GB/T16886.1系列标准[17]中规定,进行支架材料的生物安全性评价,发现材料浸提液有良好的血液相容性,体外实验无明显溶血反应,满足医用材料要求。该研究采用原代培养的MSCs作为种子细胞,并将MSCs与凝胶复合培养,并通过冷冻复合物后由电镜观察到细胞生长状态良好,进一步说明了MSCs可在水凝胶中正常生长。
该研究为CS/HACC/GP温敏水凝胶联合MSCs治疗脊髓损伤提供一定的理论基础,但目前研究制备的壳聚糖温敏水凝胶性能方面,还有待进一步发展,如低温条件下凝胶-溶胶转变速度慢甚至不具有可逆性等。制备具有良好的生物力学性能、可逆性及快速响应性的壳聚糖基温敏水凝胶以满足不同需求,最终应用到临床治疗中,是今后研究的主要方向。总之,该壳聚糖季铵盐/壳聚糖/甘油磷酸钠凝胶有良好的生物安全性,可作为脊髓组织工程的载体材料中细胞的良好载体,为脊髓损伤的修复带来了新的希望。
[1] Zhang N,Yan H,Wen X.Tissue-engineering approaches for axonal guidance.Brain Res Brain Res Rev,2005,49:48-64.
[2] Vacanti MP,Leonard JL,Dore B,et al.Tissue-engineered spinal cord.Transplant Proc.2001,33(1-2):592-598.
[3] Takezuwa T.A strategy for the development of tissue engineering scaffolds that regulate cell behavior.Biomaterials,2003,24:2267-2275.
[4] 唐佩弦.造血干细胞与基因治疗.中国实验血液学杂志,1999,7:1-3. [5] 雷俊霞,李浩威,黄春浓等.长期传代的大鼠骨髓间质干细胞的生物学特性分析[J].中国病理生理杂志,2003,19(10):1325.
[6] Lu D,Mahmood A,Wang L,et al.Adult bone marrow stromal cells administered intravenously to rats after traumatic brain injury migrate into brain and improve neurological outcome[J].Neuroreport,2001,12(3):559.
[7] Guo X,Wang C,Zhang Y,et al.Repair of large articular cartilage defects with implants of autologous mesenchymal stem cells seeded into betatrical-cium phosphate in a sheep model[J].Tissue Eng, 2004,10(11-12):1819-1829.
[8] 李忠,杨柳.骨组织工程学间充质干细胞研究进展[J].中华创伤杂志,2003,19(12):766-768.
[9] Azizi SA,Strokes D,Augelli BJ,et al.Engraftment and migration of human bone marrow stromal cells implanted in the brain of albinorat similarities to astrocyte gafts[J].ProxNatlAcadSci USA, 1998,95(7):3908
[10]Lin YC,Tan FJ,Marra KG,et al.Synthesis and characterization of collagen/hyaluronan/chitosan composite sponges for potential biomedical applications.ActaBiomaterialia,2009,5:2591-2600.
[11]CheniteA,ChaputC,Wang D,et al.Novel injectable neutral solutions of chitosan form biodegradable gels in situ[J].Biomaterials, 2000,21(21):2155-2161.
[12]Zhou HY,et al.Effec to fmolecularweight and degree of chitosan deacetylation on the preparation and characteristics of chitosan thermosensitive hydrogel as a delivery system.Car-bohydrPolym, 2008,73:265-273.
[13]Wu J,Su ZG,Ma GH.A thermo-and pH-sensitive hydrogelcomposed of quaternized chitosan/glycerophosphate.IntJPharm,2006, 315:1-11.
[14]Freier T,Montenegro R,Koh HS,et al.Chitin-based tubes for tissue engineering in the nervous system.Biomaterials,2005.
[15]Cheng H,Huang YC,Chang PT,et al.Laminin-incorporated nerve conduits made by plasma treatment for repairing spinal cord injury.Biochemical and Biophysical Research Communications, 2007,357:938-944.
[16]BumgardnerJD,WiserR,GerardPD,et al.Chitosan:potential use as a bioactive coating for orthopaedic and craniofacial/dental implants. J Biomater Sci Polym Ed,2003,14(5):423-438.
[17]生物材料和制品的生物学评价标准.1994.
Experimental research on CS/HACC/GP temperature-sensitive hydrogel loaded with MSCs
Li Guangfeng1,Wu Xianmin1,Yang Guoqing1,et al.1Department of Orthopaedics,China Metallurgical Hospital, Shanghai,225001;2 Department of Orthopaedics,Clinical College of Yangzhou Clinical,Yangzhou Jiangsu,225001,China
Objective To fabricate a temperature-sensitive hydrogel and identify its characteristics such as porosity,degradation rate,microscopic structure and biocompatibility of the cell scaffold.To observe growth and proliferation of BMSCs in the scaffold.Methods In this experimental,we modified Cs to obtain a new derivative of Cs,HACC.The hydrogel was fabricated by proper riato of CS/HACC/GP mixed solution prompted by temperature.The gelation time was decided.The cross-section morphology andporosity of the scaffolds was examined.The weight loss was calculated and the change of its aspect and shape was measured at set time.The biological safety of the hydrogel was evaluated.Then MSCs were seeded into the hydrogel.Cell adhesion and morphology of MSCs were analysed by SEM.Results HACC andCS/HACC/GP Temperature-sensitive Hydrogel wassuccessfully synthesized.The osmolality of the hydrogel was range of 290-310 mmol/kg.Gelation time of CS/HACC/GP hydrogel was around 10 minutes.Macroporous internal morphology with pore size ranging from50 to 100um was observed in CS/HACC/GP scaffold.It had a high macro porosity of greater than 85 percent.The time of CS/HACC/GP scaffold degradation completely was 12 weeks in vitro.From the SEM observation,the proliferation and metabolism of MSCs cultured on the three-dimensional hydrogel cell culture grew well.Conclusion The hydrogel with high porosity and a moderate degradation rate,without cytotoxicity,was suited for MSCs to grow and multiply.The hydrogel have the huge potential to be used as an optional carrier of transplanted cells for nerve tissue engineering.
HACC;Temperature-sensitive hydrogel;Biological safety;MSCs
R318.08
A
10.3969/j.issn.1672-5972.2014.04.002
swgk2014-01-0013
李广峰(1983-)男,医学硕士,医师。研究方向:脊柱外科。
*[通讯作者]杨建东(1969-)男,医学博士,主任医师,副教授。研究方向:脊柱外科。
2014-01-26)
国家自然科学基金资助项目(81071466)
1上海中冶医院骨科,上海200941;2江苏省苏北人民医院骨科,江苏扬州225001

