HIV/HCV合并感染的相互影响及抗病毒治疗研究进展
冯理智,蔡卫平,胡凤玉
HIV/HCV合并感染的相互影响及抗病毒治疗研究进展
冯理智,蔡卫平,胡凤玉
HIV和HCV具有相似的传播途径,主要为输血/血制品、性接触、母婴垂直及静脉注射吸毒等,因此HIV/HCV合并感染率高。HIV和HCV在体内有复杂的相互作用,使合并感染者的病程变化多样,治疗难度加大。现将HIV/HCV合并感染后病毒间相互作用机制及临床抗病毒治疗的研究进展综述如下。
HIV;丙型肝炎病毒;治疗学
2013年底,据WHO和联合国规划统计,全球有3500万人感染HIV,超过1.5亿人感染HCV[1]。HIV和HCV具有类似的传播途径,HIV感染者中约有1/3合并HCV感染[2]。HIV/HCV合并感染已成为全球性的重要公共卫生问题。高效抗反转录病毒治疗(highly active antiretroviral therapy,HAART)和抗HCV治疗已经被证实可延缓合并感染者肝纤维化的进展以及减少终末期肝病的并发症,聚乙二醇干扰素(pegylated interferon,Peg-IFN)和利巴韦林(RBV)(PR)联合治疗HCV,合并感染者获得持续病毒学应答(sustained virological response,SVR)率明显低于HCV单独感染。肝病仍是目前HIV感染者非AIDS相关性死亡的一个主要原因[3]。
1 HIV感染对HCV感染疾病进展的影响及其作用机制
目前普遍认为,合并HIV感染对HCV感染自然病程造成诸多方面的影响,主要为以下几点。
1.1 HIV对HCV载量和自发清除率的影响早在1993年,有报道称HIV/HCV合并感染的血友病患者HCVRNA水平高于HCV单独感染者[4]。对于HCV单一感染,急性感染后HCV自发清除率达20%,而合并HIV感染者只有5%~10%,尤其当患者处于较低的CD4+T淋巴细胞水平时[5]。HCV通过特异的CD4+T淋巴细胞的体液免疫清除,当合并HIV感染时,HIV主要感染并破坏CD4+T淋巴细胞,导致免疫细胞数量的下降和功能的抑制,降低了机体清除HCV的能力,导致HCV高病毒血症状态的持续存在,增加急性感染慢性化的几率。Rider和Liu[6]发现HIV感染和HCV复制之间存在潜在的因果关系,HIV反式转录激活因子已被证实可升高人趋化因子(interferon-inducible protein,IP)-10(即CXCL10)的mRNA和蛋白表达水平,从而使HCV复制增加,而多项研究已证实IP-10水平的升高可作为HCV感染和HIV/HCV合并感染预后不良的指标[7]。此外IP-10水平升高与IFN/RBV抗HCV治疗反应不佳密切相关[8]。因此,HIV合并感染导致的HCV自发清除率下降的机制是多方面的,包括通过破坏机体免疫细胞和HIV蛋白对机体固有免疫的影响。
1.2 HIV对肝组织的影响研究表明HIV/HCV合并感染者即使在完整抗反转录病毒治疗的控制下,丙型肝炎(丙肝)肝纤维化的进程仍会加速,合并HIV的丙肝发展为肝硬化、肝衰竭和原发性肝癌的速度加快[9]。泰国一项研究发现,66.7%的HIV/HCV合并感染者已发生大面积肝纤维化(肝脏硬度值>7.5kPa),而HCV单一感染者只有41.0%[10]。Chen等[11]认为HIV感染机体后造成细胞免疫障碍,与HIV对胃肠道和肝脏的直接影响共同导致患者肝脏炎症和纤维化程度增加。Mastroianni等[12]认为肝纤维化是通过HIV病毒蛋白和趋化因子受体5的相互作用诱导对肝星状细胞和肝细胞的直接影响;另一方面,可以通过HIV的免疫激活、免疫功能低下及缺陷、微生物移位或抗反转录病毒药物的毒性作用等一些间接的机制加速肝纤维化。研究显示,HIV感染肝星状细胞和肝细胞后,产生活性氧,并导致单核细胞趋化蛋白-1、基质金属蛋白酶组织抑制因子-1和1型胶原蛋白等的增加,为肝纤维化提供细胞外基质的成分,并且增加转化生长因子-β1的产生,可促进纤维化和增加HCV复制[13]。因此,HIV加速丙肝肝纤维化是通过多种机制协作的,至于哪种机制占优势目前尚不明确。
2 HCV感染对HIV自然病程的影响及其作用机制
HCV对HIV自然病程的影响目前尚有争论,多数研究表明丙肝不加速HIV感染疾病进展。Rockstroh等[14]研究表明HCV对HIV疾病进展无影响,仅发现合并感染者的肝病相关死亡风险比HIV单纯感染者增加了9倍。肖寒等[15]研究未发现HIV/ AIDS组和HIV/HCV合并感染组CD4+T淋巴细胞绝对计数的明显差异,也提示合并HCV感染对HIV疾病进程可能无明显影响。其他研究认为HCV的某些病毒蛋白可能对HIV的复制存在抑制作用。然而,最近研究表明合并HCV感染可能影响HIV感染过程,加速AIDS病程,并造成肝功能和免疫系统损伤,降低HAART疗效,增加HAART相关肝毒性发生的几率[16-18]。孙洪清等[17]研究发现,HIV/HCV组CD4+T淋巴计数明显低于HIV组(P<0.01),HIV RNA明显高于HIV组(P<0.01),显示合并感染加速HIV疾病自然进程。在伊朗南部进行的大型队列研究有1338例HIV感染者参与,平均随访43.48个月,HIV/HCV合并感染组和HIV单纯感染组的平均生存时间分别是163.8和194.8个月(P<0.039),同时发现HCV阳性比HCV阴性患者的死亡率增加2.3倍,同样提示HCV感染增加了AIDS相关死亡[18]。对HAART后免疫功能恢复能力进行回顾,来自8项不同试验,涉及6216例的荟萃分析清楚地表明,HIV/HCV合并感染的免疫重建幅度比HIV单纯感染慢[16]。HCV感染恶化AIDS患者的病情、增加AIDS并发症与AIDS相关死亡的机制不明确,可能的机制包括:①HCV激活CD4+T和CD8+T淋巴细胞,增强HIV复制,加速T细胞凋亡导致免疫系统的严重缺陷[19];②HCV降低HAART后的CD4+T淋巴细胞恢复能力[20]。另外,Ramirez等[21]研究发现已行HAART的HIV感染者血清IP-10升高,同时也证实了IP-10能抑制T细胞功能,持续暴露IP-10会导致CD4+T和CD8+T淋巴细胞分泌IFNγ,减少其他细胞因子,更重要的是T细胞的增殖减少。而一些研究证实IP-10和HCV密切相关,由此不排除HCV通过调节IP-10等细胞因子产生加速HIV感染的临床过程,影响HAART疗程[7,22]。
3 HIV/HCV合并感染的抗病毒治疗
虽然HIV/HCV合并感染加剧HAART中相关肝毒性的风险,但研究表明接受HAART的患者纤维化进展较慢,获益远远大于风险[23]。HAART通过减少肝脏坏死性炎症、抑制肝脏HIV复制或减少促炎因子以减缓肝脏疾病进展。Operskalski和Kovaes[3]报道HIV/HCV合并感染者不管抗HIV或抗HCV治疗都可降低发病率和病死率。因此对于合并感染者来说,HAART和抗HCV治疗重要且有效。
3.1 抗病毒治疗时机对于HIV/HCV治疗顺序的选择国内外尚有争论,但是一般不建议同时进行,大多数学者认为应根据CD4+T淋巴细胞计数决定先HAART还是抗HCV治疗。一项国内研究认为CD4+T淋巴细胞计数>200个/mm3是HIV/HCV合并感染者抗HCV治疗的最佳时机,其疗效和单纯丙肝患者相近[24]。国家卫生计生委2014年修订的AIDS患者免费抗病毒治疗标准为:急性感染期时,无论CD4+T淋巴细胞计数多少均推荐治疗;无论处于WHO规定的任何分期,当CD4+T淋巴细胞≤500个/mm3时,建议治疗(CD4+T淋巴细胞≤350个/mm3者优先治疗,患者有治疗意愿可保证良好的依从性)[25]。欧洲AIDS临床学会(European AIDS Clinical Society,EACS)2014年建议,合并HCV/HIV感染者当CD4+T淋巴细胞计数≤500个/mm3均应开始治疗;CD4+T淋巴细胞计数>500个/mm3须考虑治疗;当HCV感染发现于HIV感染早期(在HAART开始前),则建议进行抗HCV治疗[26]。2014年5月美国卫生与公众服务部最新的治疗指南推荐:无论CD4+T淋巴细胞计数多少,一般首先启动HAART来延缓肝脏疾病进展以及增加CD4+T淋巴细胞计数;而对于未行HAART且CD4+T细胞计数>500个/mm3的患者,建议推迟治疗,直到抗HCV治疗完成;同样指出HIV和HCV同时治疗是可行的,但应考虑到大量的药物负担、药物相互作用和叠加药物毒性使治疗复杂化,抗HCV治疗应该在评估慢性丙肝疾病阶段的基础上考虑可行性,对于无或轻度肝纤维化的患者,可以选择推迟抗HCV治疗[27]。从各大指南推荐及基于较多证据,证实未治疗的HIV感染和未控制的病毒血症与负性事件风险的增加(包括病死率、进展至AIDS的风险及非AIDS相关性疾病风险的升高等)有关,均建议CD4+T淋巴细胞计数高时即开始HAART,同时结合患者的临床情况进行个体化治疗。
3.2 抗病毒治疗方案
3.2.1 需抗HIV治疗的合并感染者对于伴慢性丙肝的HIV感染者,最常推荐的骨干抗病毒药物是恩曲他滨和替诺福韦酯,第3种药物建议依非韦伦、拉替拉韦或低剂量利托那韦激动后剂型的蛋白酶抑制剂(protease inhibitors,PIs)。当同时PR进行抗HCV治疗时,应加强随访和肝功能监测。其他三线药物推荐奈韦拉平和马拉韦罗,仅在特殊情况下使用,肝病患者须特别注意。肝硬化患者应根据Child-Pugh分级评估肝功能失代偿的状态,因为B和C级患者可能要调整或避免使用经肝代谢的抗反转录病毒药物,如与肝脂肪变性相关的核苷类反转录酶抑制剂(nucleoside reverse transcriptase inhibitors,NRTIs),如司他夫定(d4T)、去羟肌苷(dd I)或齐多夫定(AZT)[28],与非肝硬化门静脉高压症相关的ddI,与肝毒性相关的克力芝等[29]。Loko等[30]发现抗反转录病毒药物可能通过累积的肝脏毒性加速合并感染者肝纤维化进展。EACS 2014年指南提示:HIV/HCV合并感染者中断HAART将使AIDS相关或非相关事件的发生风险升高,尤其是非AIDS相关事件[26]。因此,对于合并感染者,当HAART时应尽量避免肝毒性药物的使用,降低终末期肝病的发病率以及因肝损伤而中断HAART的风险。
3.2.2 需抗HCV治疗的合并感染者在过去10年中,抗HCV的标准治疗是PR联合方案。目前疗效最佳的治疗方案是PR┼直接抗病毒药物(directacting antiviralagents,DAAs)的三联疗法,特别在初治基因1型和既往标准治疗失败(部分应答及复发,不包括无应答)患者。EACS推荐:Peg-IFN 2a(180μg)每周1次皮下注射或Peg-IFN 2b(1.5μg/ kg)每周1次皮下注射,联合RBV 1000mg(体重≤75 kg)或1200mg(体重>75 kg)。常规检测血常规和肝功能(每2~4周1次)、HCV RNA(4、12、24、48、72及结束后24周)、甲状腺功能(每12周1次)和免疫状态CD4+T淋巴细胞计数(每12周1次)。疗程取决于治疗前病毒载量、基因型及早期病毒学应答等[26](图1)。
考虑是否行抗HCV治疗首先要对其益处和风险进行评估,除CD4+T淋巴细胞计数外,预测SVR率也是一个重要参考指标。抗HCV治疗应答的预测因素有HCV基因型、基线血清HCV RNA、肝纤维化分期、快速病毒学应答、早期病毒学应答和IL-28基因多态性等。在这些因素中HCV基因型是已知预测SVR率最强的,对决定治疗持续时间发挥了相当大的影响。全基因组关联分析确定HCV基因1型患者的IL-28B基因(编码IFNλ3)附近的单核苷酸多态性与HCV自发和治疗诱导清除紧密联系[31]。基于4项基线变量普罗米修斯指数(HCV RNA、HCV基因型、用弹性测定法确定肝纤维化程度和IL-28B基因型)可作为PR治疗HIV/HCV合并感染后是否能获得SVR的特异性预测因子,其他如胰岛素抵抗也可作为获得SVR的阴性预测因子[26]。
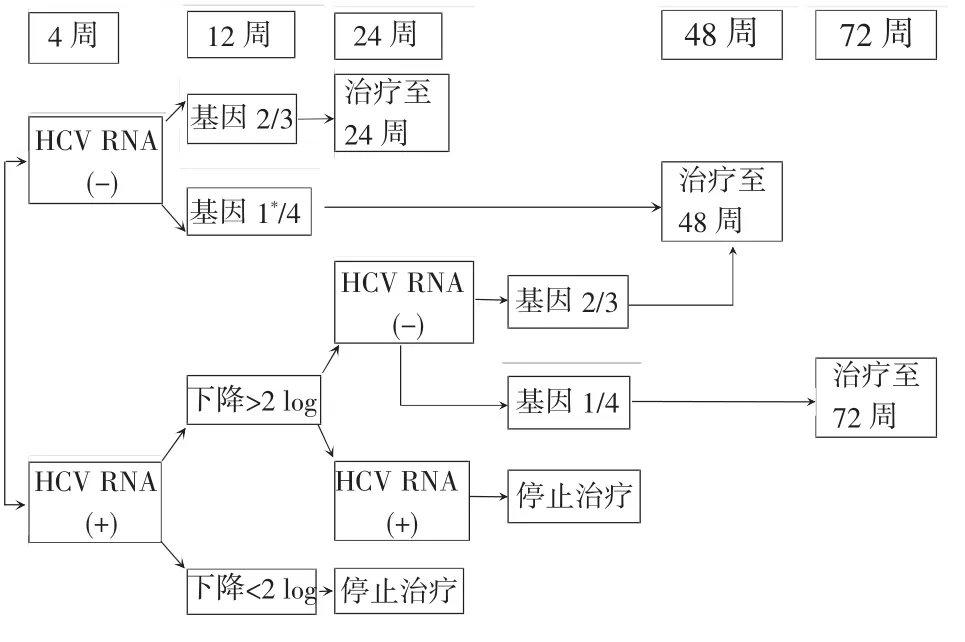
图1 抗HCV疗程Figure 1 Duration of HCV treatment
3.2.3 需抗HCV和抗HIV治疗的合并感染者当抗HIV和抗HCV联合治疗时,抗反转录病毒治疗方案的选择应以抗HCV方案为指导,考虑潜在的药物相互作用及药物重叠毒性,应注意RBV与NRTIs(如AZT和d4T等)的相互作用和不良反应。RBV是一种嘌呤核苷类似物,可降低DNA合成并改变阴离子间隙。多个临床数据显示,同时使用NRTIs和RBV发生线粒体毒性的风险较高,尤其是dd I、d4T和AZT[28-29]。AZT和RBV联合应用时,会出现终止治疗和贫血相关性RBV减量,导致SVR率低,故该组合应尽量避免;如果PR联合1种HCV第一代非结构蛋白3/4A(nonstructured serine-protease 3/4A,NS3/4A)PIs,贫血风险会迸一步增大,在该组合中AZT必须避免应用。阿巴卡韦的使用一直存在争议,它曾经被认为与RBV存在竞争性抑制作用,其在某些情况下与降低HCV对PR的应答率有关,但后来的研究发现并无此关联[32]。
4 DAAs
对于HCV基因1型患者,PR治疗获得SVR率为40%~50%,而合并HIV感染者仅为14%~29%,且不良反应明显,新药的研究和开发上市需求迫切[33]。自从2011年第一代PIs的上市,近几年源源不断DAAs新药临床研究结果的公布以及DAAs新药的陆续上市,开启了丙肝治疗的新时代[34]。
DAAs主要分为NS3/4A PIs、NS5B多聚酶抑制剂及NS5A抑制剂等。2011年,第一代DAAs靶向作用于HCV NS3/4A的2种PIs(telaprevir和boceprevir)获准联合PR用于基因1型HCV感染的优化治疗。这2种药物可使初治患者的SVR率增加30%[35-36]。在经治患者中获益更大,在复发、部分反应、无应答患者中SVR率分别增加了50%~60%、40%~45%、25%[37-38]。初治或经治复发、部分应答和无应答患者中均能观察到三联治疗优于双联治疗。
Sofosbuvir(SOF)是HCV特异性NS5B聚合酶的核苷抑制剂,于2013年12月获美国食品药物监督管理局新药批准,用于成人HCV感染的治疗。SOF对全基因型HCV感染均有效,SVR率高,迎来抗HCV治疗“无干扰素”时代。2014年4月,欧洲肝脏研究学会(European Association for the Study of the Liver,EASL)指南推荐:①基因1、4型,SOF(400mg/d)联合PR治疗12周或联合RBV(针对不耐受或不适合IFN治疗的患者)治疗24周;②基因2、3型,建议采用SOF┼RBV治疗12周,肝硬化和(或)经治患者也可加用IFN,疗程延长至16周或20周;③基因3型患者还可应用SOF┼daclatasvir初治12周,经治24周[39]。2013年底,新一代的NS3/4A蛋白酶抑制剂simeprevir(SMV)在北美批准上市,联合PR用于基因1型HCV感染成人患者代偿性肝脏疾病(包括肝硬化)的治疗。EASL推荐:SMV┼PR治疗12周,对于初治和复发(包括肝硬化)患者应追加PR治疗12周(总疗程为24周);对于之前部分应答及无应答(包括肝硬化)患者,则应追加PR治疗36周(总疗程为48周)[39]。Daclatasvir是一种强效的泛基因型NS5A复制复合体抑制剂,2014年8月27日获欧盟批准,联合其他药物用于所有基因1~4型慢性丙肝成人患者的治疗。
随着近年来的一系列研究表明,DAAs具有特异性强、疗程短、不良反应小及可口服等优点,初治患者的SVR率几乎达到了93%~100%,可得到临床彻底治愈。在不远的将来,还会有许多抗HCV的新药进入临床试验,为治疗丙肝提供更有效、更安全的手段。
5 总结与展望
HIV/HCV合并感染对疾病的不良影响体现在诸多方面,HIV感染不仅会降低HCV的自然清除率、增加HCV复制,而且加快HCV感染者的疾病进程,使进展到肝硬化及肝癌等肝脏相关疾病的时间缩短等。但HCV对HIV自然进展是否有影响仍有争议,初步证据显示HIV/HCV合并感染可加快HIV的自然病程。合并感染对疾病进展相互影响的致病机制十分复杂,进一步研究这2种病毒之间的相互作用对新治疗策略的制定至关重要。抗HCV标准治疗方案对HIV/HCV合并感染者的SVR率低,庆幸的是近年来对DAAs的研究发展迅速,处于临床试验阶段的DAAs有50多种,使“无干扰素”抗HCV治疗逐渐成为可能,有望实现丙肝的可治愈目标。
[1]WHO.Global summary of the HIV/AIDSepidemic,December 2013[EB/OL].[2014-09-05].http://www.who.int/hiv/data/epi_core_dec20 14.png?ua=1.
[2]Limketkai BN,Mehta SH,Sutcliffe CG,et al.Relationship of liver disease stage and antiviral therapy with liver-related events and death in adults coinfected with HIV/HCV[J].JAMA,2012,308(4): 370-378.
[3]Operskalski EA,Kovacs A.HIV/HCV co-infection:pathogenesis, clinical complications,treatment,and new therapeutic technologies[J].Curr HIV/AIDSRep,2011,8(1):12-22.
[4]Eyster ME,Diamondstone LS,Lien JM,et al.Natural history of hepatitis C virus infection in multitransfused hemophiliacs:effect of coinfection with human immunodeficiency virus.Themulticenter hemophilia cohort study[J].JAcquir ImmuneDefic Syndr,1993, 6(6):602-610.
[5]Thomas DL,Astemborski J,Rai RM,et al.The natural history of hepatitis C virus infection:host,viral,and environmental factors[J].JAMA,2000,284(4):450-456.
[6]Rider PJ,Liu F.Crosstalk between HIV and hepatitis C virus during co-infection[J].BMCMed,2012,10:32.
[7]Berenguer J,Fernandez-Rodríguez A,Jimenez-Sousa MA,et al. High plasma CXCL10 levels are associated with HCV-genotype 1, and higher insulin resistance,fibrosis,and HIV viral load in HIV/ HCV coinfected patients[J].Cytokine,2012,57(1):25-29.
[8]Zekri AR,Bahnassy AA,Mohamed WS,et al.Namic interplay between CXCL levels in chronic hepatitis C patients treated by interferon[J].Virol J,2013,10:218.
[9]Hernandez MD,Sherman KE.HIV/hepatitis C coinfection natural historyand disease progression[J].CurrOpin HIVAIDS,2011,6(6): 478-482.
[10]Luetkemeyer AF,Havlir DV,Currier JS.CROI 2013:complications of HIV disease,viral hepatitis,and antiretroviral therapy[J].Top AntivirMed,2013,21(2):62-74.
[11]Chen JY,Feeney ER,Chung RT.HCV and HIV co-infection:mechanismsandmanagement[J].NatRevGastroenterolHepatol,2014,11 (6):362-371.
[12]MastroianniCM,LichtnerM,Mascia C,etal.Molecularmechanisms of liver fibrosis in HIV/HCV coinfection[J].Int JMol Sci,2014,15 (6):9184-9208.
[13]LinW,Wu G,LiS,etal.HIV and HCV cooperatively promotehepatic fibrogenesisvia induction of reactiveoxygen speciesand NFkappaB[J].JBiolChem,2011,286(4):2665-2674.
[14]Rockstroh JK,Peters L,Grint D,et al.Does hepatitis C viremia or genotype predict the risk ofmortality in individuals co-infected with HIV?[J].JHepatol,2013,59(2):213-220.
[15]肖寒,高敬敬,张利霞,等.HIV/AIDS合并HCV患者血红蛋白、肝功能与CD4+T细胞计数关系探讨[J].青海医药杂志,2012,42(7):6-9.
[16]Gupta P.HepatitisCVirusand HIV Type 1Co-Infection[J].Infect DisRep,2013,5(Suppl1):S7-S8.
[17]孙洪清,肖宏,杨菲,等.HCVRNA水平对HCV/HIV合并感染自然进程的影响[J].医学研究杂志,2014(4):91-95.
[18]Rezaianzadeh A,Hasanzadeh J,Alipour A,etal.Impactof hepatitis C on survival of HIV-infected individuals in Shiraz;South of Iran[J].HepatMon,2012,12(2):106-111.
[19]Karim R,Mack WJ,Stiller T,etal.Association of HIV clinical disease progression with profiles of early immune activation:results from a clusteranalysisapproach[J].AIDS,2013,27(9):1473-1481.
[20]Potter M,Odueyungbo A,Yang H,etal.Impact of hepatitis C viral replication on CD4+T-lymphocyte progression in HIV-HCV coinfection beforeand afterantiretroviral therapy[J].AIDS,2010,24(12): 1857-1865.
[21]Ramirez LA,Arango TA,Thompson E,etal.High IP-10 levels decrease T cell function in HIV-1-infected individuals on ART[EB/ OL].[2014-09-05].http://www.ncbi.nlm.nih.gov/pubmed/?term= High+IP-10+levels+decrease+T+cell+function+in+HIV-1-infected+individuals+on+ART.
[22]Brownell J,Wagoner J,Lovelace ES,et al.Independent,parallel pathways to CXCL10 induction in HCV-infected hepatocytes[J].J Hepatol,2013,59(4):701-708.
[23]Lutz P,Wasmuth JC,Nischalke HD,etal.Progression of liver fibrosis in HIV/HCV genotype 1 co-infected patients is related to the T allele of the rs12979860 polymorphism of the IL28B gene[J].Eur J Med Res,2011,16(8):335-341.
[24]蒋忠胜,温小凤,李敏基,等.HIV/HCV双重感染者抗HCV治疗时机的探讨[J].中国全科医学,2012,15(11):1276-1277.
[25]国家卫生计生委.卫计委发布修订后艾滋病患者免费抗病毒治疗标准[J].中国全科医学,2014,17(16):1844.
[26]European AIDSClinical Society.EACSGuidelines for treatment of HIV-infected adultsin Europe[EB/OL].[2014-09-05].http://www. eacsociety.org/Guidelines.aspx,2014.
[27]DepartmentofHealth and Human Services.Guidelines for the useof antiretroviralagents in HIV-1-infected adultsand adolescents[EB/ OL].[2014-09-05].http://aidsinfo.nih.gov/contentfiles/lvguidelines/ adultandadolescentgl.pdf.
[28]GuaraldiG,Stentarelli C,Orlando G,etal.Nonalcoholic fatty liver disease in HIV-infected persons:epidemiology and the role of nucleoside reverse transcriptase inhibitors[J].JAcquir Immune Defic Syndr,2010,53(2):278-281.
[29]Schiano TD,Uriel A,Dieterich DT,etal.The developmentofhepatoportal sclerosis and portal hypertension due to didanosine use in HIV[J].VirchowsArch,2011,458(2):231-235.
[30]LokoMA,Bani-Sadr F,Winnock M,etal.Impactof HAART exposureand associated lipodystrophy on advanced liver fibrosis in HIV/ HCV-coinfected patients[J].JViralHepat,2011,18(7):307-314.
[31]孙亚朦,尤红.IL-28B基因多态性与丙型肝炎关系的研究进展[J].传染病信息,2012,25(2):68-70.
[32]Solas C,Pambrun E,Winnock M,etal.Ribavirin and abacavir drug interaction in HIV-HCV coinfected patients:fact or fiction?[J]. AIDS,2012,26(17):2193-2199.
[33]NúñezM,Miralles C,Berdún MA,etal.Role ofweight-based ribavirin dosingand extended duration of therapy in chronic hepatitisC in HIV-infected patients:the PRESCO trial[J].AIDSResHum Retroviruses,2007,23(8):972-982.
[34]罗生强.慢性丙型肝炎治疗进展与展望[J].传染病信息,2014,27 (4):193-197.
[35]Poordad F,McCone JJr,Bacon BR,et al.Boceprevir for untreated chronic HCV genotype1 infection[J].NEngl JMed,2011,364(13): 1195-1206.
[36]Jacobson IM,McHutchison JG,DusheikoG,etal.Telaprevir for previously untreated chronic hepatitis C virus infection[J].N Engl J Med,2011,364(25):2405-2416.
[37]Bacon BR,Gordon SC,Lawitz E,et al.Boceprevir for previously treated chronic HCV genotype1 infection[J].NEnglJMed,2011,364 (13):1207-1217.
[38]Zeuzem S,Andreone P,Pol S,et al.Telaprevir for retreatment of HCV infection[J].NEngl JMed,2011,364(25):2417-2428.
[39]EASL.European Association for the Study of the Liver Recommendations on treatment of hepatitis C 2014[EB/OL].[2014-10-01]. http://www.easl.eu/_newsroom/latest-news/easl-recommendationson-treatment-of-hepatitis-c-2014.
(2014-09-18收稿 2014-10-24修回)
(责任编委 王永怡 本文编辑 陈玉琪)
Research progress of interactions between HIV and HCV and antiviral therapy in co-infected patients
FENG Li-zhi,CAIWei-ping*,HU Feng-yu
Department of Infectious Diseases,Guangzhou Eighth People's Hospital,Guangzhou,Guangdong 510060,China
*
,E-mail:caiwp@163.net
HIV and HCV frequently coexistbecause of their similar routes of transmission.Both viruses aremainly transmitted by exposure to contaminated blood or blood products,sexual contact,mother-to-child transmission and intravenous drug use.HIV/ HCV co-infection rate ishigh.There are complex interations ofHIV with HCV andmultiple disease courses in the co-infected patients. So they are more difficult to be treated.The authors describe the progress of the interactions of HIV and HCV and antiretroviral treatment in HIV/HCV co-infected patients.
HIV;helatitis C virus;therapeutics
R373.51
A
1007-8134(2014)06-0333-05
国家“十二五”科技重大专项(2012ZX10001003-003);广州市科技计划项目(201300000092)
510060,广州医科大学附属广州市第八人民医院感染科(冯理智、蔡卫平、胡凤玉)
蔡卫平,E-mail:caiwp@163.net

