结核病实验室诊断新技术的临床应用
王心静,王仲元
结核病实验室诊断新技术的临床应用
王心静,王仲元
结核分枝杆菌全基因组测序的完成,使得对结核分枝杆菌的认识进入分子水平,分子生物学和免疫学的发展为诊断新方法提供了技术平台,结核病实验室诊断技术得到快速发展。为帮助临床医生了解现有新技术,以便更好地应用,本文系统介绍现有结核病实验室诊断新技术的原理和临床应用特点。
结核分枝杆菌;基因扩增;诊断
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染造成的慢性传染病,1993年WHO宣布全球结核病控制处于紧急状态[1],2006年提出全球结核病控制目标是到2015年结核病患病率和病死率较1990年降低一半[2]。2013年报告新发结核病例数减少,但患病率下降缓慢,耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)的诊治远未达到目标[3]。结核病控制效果不佳原因很多,AIDS、糖尿病和自体免疫性疾病等影响机体免疫功能的疾病发病率上升,以及耐多药Mtb尤其是广泛耐药Mtb感染率上升是重要因素;另一个十分重要的原因是结核病传统的抗酸杆菌涂片及培养等技术灵敏度低、耗时长,造成结核病的诊断延迟或误诊。
在WHO的推动下,结核病的实验室诊断技术时效性和准确率上得到了显著提高。为帮助临床医生了解结核病检测技术,以便更好地应用,本文系统介绍现有结核病实验室诊断新技术的原理和应用。
1 核酸扩增技术(nucleic acid am plification tests, NAAT)
Mtb H37Rv株的全基因组测序工作的完成,使得人们能够从基因水平上认识Mtb[4]。近些年,针对Mtb耐药和遗传变异等相关基因的序列和功能的研究取得了突破性进展,如发现分枝杆菌特异性保守序列IS6110、16S rRNA基因、hsp65基因和rpoB基因等[5],为开发新的诊断技术提供了理论基础。
NAAT的快速性和高灵敏度是其用于结核病实验室诊断的最大优势。近几年NAAT的快速发展为结核病诊断提供了技术基础,Mtb核酸检测也成为结核病实验室诊断技术发展的最大亮点。
1.1 技术原理及相应产品
1.1.1 实时荧光定量PCR此技术不仅实现了PCR从定性到定量的飞跃,而且与常规PCR相比,它具有特异性更强、可有效解决PCR污染问题以及自动化程度高等特点,目前已得到广泛应用[6]。荧光定量PCR技术有以下2个需要了解的概念。Ct值:C代表Cycle,t代表threshold(阈值,临界值)。Ct值的含义是每个反应管内的荧光信号到达设定阈值时所经历的循环数。每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct值越小。熔解曲线:PCR扩增反应完成后,逐渐升高温度,随着反应中双链DNA变性,荧光染料又回复到游离状态导致荧光信号降低。用荧光信号改变的负一次导数与温度作图,形成熔解曲线,不同产物有自己的特征峰(熔解温度,即DNA双链解链50%的温度),用这个特征峰可将特异性产物与其他产物区分开。
目前,临床开展的Mtb核酸检测多数是使用实时荧光定量PCR技术[7],根据Ct值判断样本中是否存在Mtb特有DNA片断,敏感性良好。但是由于死亡的Mtb DNA也能够被检测到,所以不能作为病情追踪。
根据熔解曲线与标准曲线的对照,能够准确区分野生型、杂合突变型和纯和突变型基因。此法不受突变位点和类型的局限,无需序列特异性探针,但不能测出基因突变的具体位置和类型。临床上已有应用此技术检测Mtb耐药的试剂盒[8-9]。
1.1.2 RNA恒温扩增实时检测(simultaneousamplification and testing,SAT)该技术是将新一代核酸恒温扩增技术和实时荧光检测技术相结合的一种新型核酸检测技术。在同一温度下,首先通过M-MLV反转录酶产生靶标核酸RNA的1个双链DNA拷贝,然后利用T7RNA多聚酶从该DNA拷贝上产生多个RNA拷贝,每个RNA拷贝再从反转录开始进入下一个扩增循环;同时,带有荧光标记的探针和这些RNA拷贝特异结合,产生荧光。此实验检测的底物是RNA,其扩增效率、灵敏度和特异度高,反应时间短,操作简单,同时RNA容易降解,可减少污染。
将SAT技术应用于Mtb检测是国内自主专利技术[10]。因为只有活菌才有阳性检测结果,因此与DNA检测相比,此检测结果可作为区分死菌和活菌的依据,有利于用药后的疗效监测。
1.1.3 环介导等温扩增法(loopmediated isothermal amplification,LAMP)该技术于2000年由日本荣研公司开发,利用链置换型DNA聚合酶在恒温下进行扩增反应,产生大量的扩增产物即焦磷酸镁白色沉淀,通过肉眼观察白色沉淀的有无判断靶基因是否存在,是一种适合现场和基层进行快速检测的方法。
应用LAMP定性检测临床标本中的Mtb DNA无需扩增仪,肉眼就能观察结果,整个过程只需要1h。2011年WHO专家组认为LAMP是一项潜在的快速诊断结核病的技术。但是与痰涂片镜检相比,其特异性是个问题,较高的成本可能会制约临床应用[11]。
1.1.4 基因芯片技术基因芯片又称DNA芯片(DNA chip)或DNA微阵列(DNAmicroarray),是将大量特定序列的探针分子密集、有序地固定于经过处理的载体上,加入标记的待测样品,进行多元杂交,通过杂交信号的强弱及分布,用特殊仪器来分析目的分子的有无,从而获得样品的遗传信息。基因芯片能够进行高通量筛选及检测分析,解决了传统核酸印记杂交技术操作复杂、检测目的分子数量少等不足。
临床上应用我国有自主知识产权的Mtb耐药检测芯片及非Mtb菌种鉴定芯片,耐药芯片可同时检测利福平和异烟肼的耐药情况,非Mtb菌种鉴定芯片可鉴定常见的17种非Mtb。这2种芯片检测均可在6 h内完成,但结果与样本中菌量有一定的相关性,菌量过少或操作失误容易出现无效检测结果。
1.1.5 分子线性探针技术(line probe assay,LPA)此技术基于多重PCR原理,将PCR扩增、反向杂交和膜显色技术合为一体。首先通过使用引物扩增目的片断,扩增产物后与膜上已固定的特异性探针杂交,杂交物通过生物素标记的酶发生显色反应,由此判断靶DNA特定基因的碱基突变。
GenoType MtbDR是德国Hain Lifescience的产品,利用LPA检测是否存在Mtb DNA,同时检测Mtb耐利福平和异烟肼基因来诊断MDR-TB,在2008年得到WHO的认可[12]。推荐LPA用于涂片阳性的痰标本和培养物中,以快速检测利福平和异烟肼耐药,但不推荐用于二线抗结核药耐药性检测。此技术耗时约8 h,反应相对容易被污染,对技术水平要求较高。
1.1.6 自动化核酸扩增Xpert Mtb/RIF由美国Cepheid公司研发,是一项全自动分子诊断方法,集痰标本处理、DNA提取、核酸扩增、Mtb特异核酸检测和利福平耐药基因检测于一体,是一种半巢式实时荧光定量PCR体外诊断技术,只需2 h即可同时实现Mtb定性和利福平耐药的检测。整个过程在封闭的腔室内自动化完成,可在普通实验室条件下进行。2010年12月,该技术被WHO誉为突破性结核病诊断方法而向全球推荐[13]。2013年5月,WHO推荐对结核病疑似患者首先使用Xpert Mtb/RIF检验,尤其是疑似MDR-TB患者和合并HIV感染者,并建议在MDR-TB或HIV感染率低的地区,Xpert Mtb/RIF可用于涂片阴性病例的进一步检测[14]。
1.2 临床应用效率以上结核分子诊断产品部分已应用于各国临床检验,因此应用效率研究报告比较丰富,WHO亦对其推荐的产品做了详细的报告分析。比较分析这些报告的样本均是临床患者痰标本,考虑到每份痰标本的异质性,培养和核酸检测如果不是来自同一份痰标本,可能会有不同的结果。它们的比较标准均是培养阳性,其中部分是罗氏固体培养阳性,部分是液体培养阳性,而液体培养灵敏度比固体培养高。另外,检测场所的级别不同造成环境条件和使用人员的技术水平差别,这些因素都将影响最后的结果,因此试验结论不尽相同。但基本共识是结核分子诊断产品所需时间少、诊断特异性高,可提高对涂片阴性患者的诊断灵敏度。表1~2为不同分子检测的灵敏度和特异度。
应用于Mtb检测的核酸扩增方法检测快速、准确率高、便捷,优点很突出。但是临床标本成分复杂,可能存在PCR反应的抑制因素,如某些血痰或干酪样痰可能由于蛋白成分过高而造成检测假阴性,这在临床检测中并不少见。耐药基因的存在不是惟一的耐药机制,Mtb katG和inhA基因突变占异烟肼耐药菌株约80%,即使是灵敏度最高的耐利福平基因rpoB突变,也只能发现约95%的耐药菌,临床应用时会发现耐药表型和基因型不一致[21-22]。所以,核酸扩增方法还不能完全代替传统的抗酸杆菌涂片和培养方法。另外,目前国内核酸扩增方法的收费、试剂或仪器价格比较高,在很大程度上影响了临床应用。
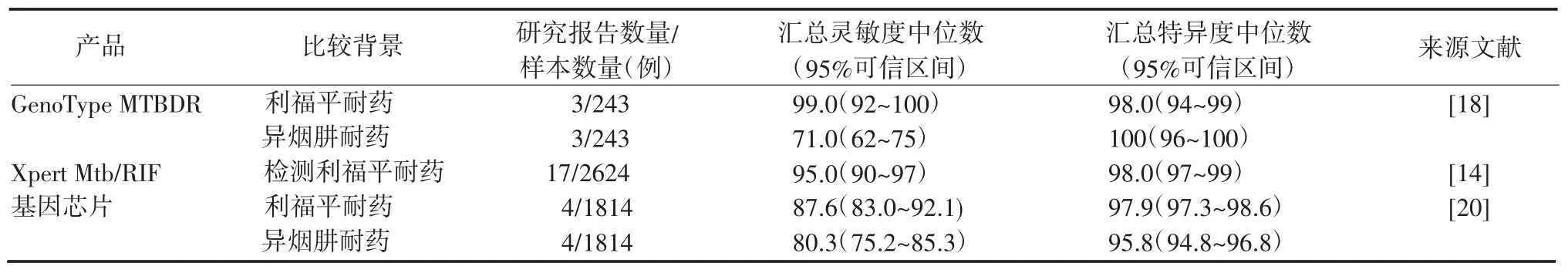
表2 不同核酸扩增方法诊断M tb耐药的灵敏度和特异度Table 2 Sensitivity and specificity of different diagnostic assays for detecting drug-resistant M tb
2 免疫学诊断
2.1 Mtb干扰素释放试验Mtb核酸的RD-1区是卡介苗和大部分非Mtb缺失的部分,RD-1区表达的蛋白ESAT-6和CFP-10是Mtb特异的分泌蛋白,免疫原性强,被用作Mtb的特异性刺激原。多种Mtb特异性反应性因子如肿瘤坏死因子-α、白细胞介素-2和干扰素γ诱导蛋白-10等被用做Mtb感染的潜在诊断指标[23-25]。其中干扰素γ释放试验(interferon-gamma release assay,IGRA)已被WHO宣布为Mtb潜伏感染的诊断试验,此试验有ELISA方法和ELISpot方法,这2种方法诊断潜伏感染效能无差别,用于诊断结核病时,ELISpot方法灵敏度更高,但也有研究认为差异无统计学意义[26-27]。
近几年对干扰素释放试验在结核病诊断中的意义有较多研究,有研究显示在结核病的治疗过程中干扰素水平下降;也有截然相反的研究结果,即治疗过程中干扰素水平上升,还有研究发现治疗2个月后干扰素的下降水平与复发的可能性相关[28-29]。目前多数研究认为干扰素释放试验不适于评价治疗反应[30]。2011年10月WHO发表专家报告,指出IGRA不能准确预测潜伏感染发展至活动性结核病的风险,不应作为活动性结核病的诊断指标[31]。干扰素释放试验在结核病和结核感染诊断上是否优于结核菌素试验还有争议,基本达成共识的是对卡介苗接种人群和非Mtb感染高发人群,干扰素释放试验的特异度显著高于结核菌素试验[30]。因此,对于结核病高发区,干扰素释放试验的意义更在于其对阴性的排除诊断价值[32-33]。但要注意此试验的假阴性,尤其对于伴发其他免疫性或血液疾病的患者以及应用糖皮质激素治疗超过1周的患者,阴性结果不能排除诊断。
2.2 结核抗体检测结核抗体检测已历时多年,现有的抗体检测主要是针对Mtb LAM、38kD和16kD抗原,已有报道的灵敏度和特异度比较差异较大。WHO明确提出现有结核抗体试验不能作为结核病和结核感染的诊断依据,希望新的具有诊断效能的抗原被发现,而试图发现新的具有高诊断效能因子的脚步从未停歇[34]。
3 结语
分子生物学和免疫学的发展为结核病诊断技术的突破提供了可能,目前新出现的核酸扩增方法和免疫学方法在诊断效能上确有提高,但由于其自身的限制和Mtb的特点,这些方法依旧不能替代传统的Mtb涂片和培养方法,临床应用时应清楚每一种诊断方法的意义和局限性,以利于临床诊断和治疗。
[1]WHO.A review of current epidemiological data and estmation of future tuberculosis incidence and mortality[EB/OL].[2014-07-02].http://whqlibdoc.who.int/hq/1993/WHO_TB_93.173.pdf?ua=1.
[2]WHO.The global plan to stop tuberculosis[EB/OL].[2014-07-05].http://whqlibdoc.who.int/hq/2003/WHO_CDS_STB_2003.23.pdf? ua=1.
[3]WHO.Global tuberculosis report 2013[EB/OL].[2014-07-05]. http://www.who.int/tb/publications/global_report/en/.
[4]Srivastava R,Kumar D,Waskar MN,et al.Identification of a repetitive sequence belonging to a PPE gene of Mycobacterium tuberculosis and its use in diagnosis of tuberculosis[J].JMed Microbiol,2006,55(Pt8):1071-1077.
[5]Luo RF,Banaei N.Molecular approaches and biomarkers for detection of Mycobacterium tuberculosis[J].Clin Lab Med,2013,33 (3):553-566.
[6]陈旭,齐凤坤,康立功,等.实时荧光定量PCR技术研究进展及其应用[J].东北农业大学学报,2010,41(8):148-155.
[7]吴驰,张红梅,詹能勇,等.荧光定量PCR技术在肺结核诊断中的临床应用研究[J].中国防痨杂志,2010,32(10):647-650.
[8]王峰,崔运勇,胡思玉,等.实时聚合酶链反应熔解曲线法快速检测耐多药结核分枝杆菌[J].中华结核和呼吸杂志,2011,34(12): 888-893.
[9]陆学东,汤一苇.多重耐药微生物的实验室检测新技术[J].传染病信息,2011,24(2):113-116.
[10]中国防痨协会临床专业委员会.结核病临床诊治进展年度报告(2012年)[J].中国防痨杂志,2013,35(6):405-426.
[11]WHO.The use of a commercial loop-mediated isothermal amplification assay(tb-lamp)for the detection of tuberculosis[EB/OL].[2014-07-02].http://apps.who.int/iris/bitstream/10665/83142/1/ WHO_HTM_TB_2013.05_eng.pdf?ua=1.
[12]WHO.WHO policy statement:molecular line probe assays for rapid screening of patients at risk ofmultidrug-resistant tuberculosis[EB/OL].[2014-07-10].http://www.who.int/tb/laboratory/line_ probe_assays/en/.
[13]WHO.Policy statement:Xpert MTB/RIF system[EB/OL].[2014-07-10].http://who.int/publications/2011/97892415-01545_eng.pdf.
[14]WHO.Policy statement:Xpert MTB/RIF assay for the diagnosis of pulmonary and extrapulmonary TB in adults and children[EB/OL].[2014-07-11].http://apps.who.int/iris/bitstream/10665/112472/1/ 9789241506335_eng.pdf?ua=1.
[15]Yuan LY,Li Y,Wang M,et al.Rapid and effective diagnosis of pulmonary tuberculosiswith noveland sensitive loop-mediated isothermal amplification(LAMP)assay in clinical samples:a metaanalysis[J].J Infect Chemother,2014,20(2):86-92.
[16]于霞,梁倩,马异峰,等.环介导等温扩增技术快速检测痰标本中结核分枝杆菌的初步评价[J].中国实验诊断学,2013,5(17):846-849.
[17]Luetkemeyer AF,Kendall MA,Wu X,etal.Evaluation of two line probe assays for rapid detection of Mycobacterium tuberculosis, tuberculosis(TB)drug resistance,and non-TB Mycobacteria in HIV-infected individuals with suspected TB[J].JClin Microbiol, 2014,52(4):1052-1059.
[18]Bwanga F,Hoffner S,Haile M,et al.Direct susceptibility testing for multi drug resistant tuberculosis:a meta-analysis[J].BMC Infect Dis,2009,9:67.
[19]倪丽丽,罗柳,林景玲,等.恒温扩增实时荧光检测技术在肺结核诊断中的临床价值[J].中华检验医学杂志,2012,35(8):702-705.
[20]Pang Y,Xia H,Zhang Z,etal.Multicenter evaluation of genechip for detection of multidrug-resistant Mycobacterium tuberculosis[J].JClin Microbiol,2013,51(6):1707-1713.
[21]陈曦,马玙,金奇,等.耐异烟肼结核分枝杆菌临床分离株耐药相关基因突变研究[J].中华结核和呼吸杂志,2005,28(4):250-253.
[22]Dalla Costa ER,Ribeiro MO,Silva MS,etal.Correlations ofmutations in katG,oxyR-ahpC and inhA genes and in vitro susceptibility in Mycobacterium tuberculosis clinical strains segregated by spoligotype families from tuberculosis prevalent countries in South America[J].BMCMicrobiol,2009,9:39.
[23]Harari A,Rozot V,Bellutti Enders F,et al.Dominant TNF-α+ Mycobacterium tuberculosis-specific CD4+T cell responses discriminate between latent infection and active disease[J].NatMed, 2011,17(3):372-376.
[24]Mamishi S,Pourakbari B,TeymuriM,etal.Diagnostic accuracy of IL-2 for the diagnosis of latent tuberculosis:a systematic review and meta-analysis[J].Eur JClin Microbiol Infect Dis,2014,33 (12):2111-2119.
[25]Wang S,Diao N,Lu C,etal.Evaluation of the diagnostic potential of IP-10 and IL-2 as biomarkers for the diagnosis of active and latent tuberculosis in a BCG-vaccinated population[J].PLoSOne, 2012,7(12):e51338.
[26]LalvaniA,Pareek M.Interferon gamma releaseassays:principlesand practice[J].Enferm Infecc Microbiol Clin,2010,28(4):245-252.
[27]高孟秋,刘菲,纪滨英,等.两种γ干扰素释放分析技术在结核病临床诊断中的比较研究[J].中华结核和呼吸杂志,2012,35(10): 762-765.
[28]Chiappini E,Fossi F,Bonsignori F,et al.Utility of interferon-γ release assay results tomonitor anti-tubercular treatment in adults and children[J].Clin Ther,2012,34(5):1041-1048.
[29]Hang NT,Matsushita I,Shimbo T,etal.Association between tuberculosis recurrence and interferon-γresponse during treatment[EB/OL].[2014-07-10].http://www.ncbi.nlm.nih.gov/pubmed? term=Association+between+tuberculosis+recurrence+and+interferon-%CE%B3+response+during+treatment&TransSchema=title&cmd= detailssearch.
[30]Belknap R,Daley CL.Interferon-gamma release assays[J].Clin Lab Med,2014,34(2):337-349.
[31]WHO.New WHO recommendations on use of commercial TB interferon-Gamma release assays(IGRAs)in low-andmiddle-income countries[EB/OL].[2014-07-10].http://www.who.int/tb/fea-tures_ archive/igra_policy24oct/en/.
[32]Zhu C,Liu Z,Li Z,et al.The performance and limitation of TSPOT.TB for the diagnosis of TB in a high prevalence setting[J].J Thorac Dis,2014,6(6):713-719.
[33]Li T,Bao L,Diao N,et al.Influencial factors of the performance of interferon-γrelease assays in the diagnosis of childhood tuberculosis[EB/OL].[2014-07-10].http://www.ncbi.nlm.nih.gov/pubmed/ ?term=Influencial+factors+of+the+performance+of+interferon-% CE%B3+release+assays+in+the+diagnosis+of+childhood+tuberculosis.
[34]Feng X,Yang X,Xiu B,etal.IgG,IgM and IgA antibodies against thenovelpolyprotein inactive tuberculosis[J].BMC InfectDis,2014, 14(1):336.
(2014-07-29收稿 2014-08-15修回)
(责任编委 王永怡 本文编辑 陈玉琪)
Clinical application of the new laboratory diagnostic techniques of tuberculosis
WANG Xin-jing,WANG Zhong-yuan
Clinical Laboratory Department,Institute of Tuberculosis,309 Hospital of PLA,Beijing 100091,China
As whole-genome sequencing of Mycobacterium tuberculosis(Mtb)makes it possible to understand Mtb at the molecular level,and the development ofmolecular biology and immunology provides a technology platform for the new diagnostic assays,there has been a rapid development in novel diagnostic assays designed to detect Mtb and its drug resistance.To help clinicians understand the existing novel assays for better application,the authors introduce the principles and features of the existing novel diagnostic techniques of tuberculosis.
Mycobacterium tuberculosis;gene amplification;diagnosis
R378.911
A
1007-8134(2014)06-0373-04
国家自然科学基金(81071319)
100091北京,解放军第三〇九医院结核病研究所临床实验室(王心静),全军结核病研究所(王仲元)

