聚乙二醇干扰素α-2a联合利巴韦林治疗老年慢性丙型肝炎的疗效与安全性评价
周 昊,田展飞,樊和斌,严福明
(中国人民解放军第161医院感染内科,湖北 武汉 430010)
丙型肝炎病毒(HCV)感染后,常无明显症状,60%以上感染者会发展为慢性丙型肝炎(CHC),若未经及时有效的治疗,可转化为肝硬化、肝癌[1-2]。疫情监测数据显示,离退休等老年人群中丙型肝炎的发病形势非常严峻[3-4]。聚乙二醇干扰素(PEG-IFN)联合利巴韦林(RBV)是国际公认的丙型肝炎标准治疗方案[5-6],但老年人代谢机能减弱,常合并其他疾病,该方案的疗效和安全性研究报道还很少。笔者采用此标准方案对老年患者及中青年患者进行治疗,比较两组患者的疗效和安全性差异。现报道如下。
1 资料与方法
1.1 一般资料
参照《丙型肝炎防治指南》的诊断标准[7],选择我院2008年1月至2012年6月间收治的73例成年CHC患者,排除酒精肝或代谢性肝病;失代偿期肝硬化,心、肺、肾功能不全,合并其他肝炎病毒感染,合并艾滋病毒感染,恶性肿瘤、自身免疫性疾病或严重精神疾病的患者。其中老年组(60岁以上)19例,中青年组(18~59岁)患者 54 例。老年组中,男 11例,女 8 例;平均年龄(69.55 ±10.37)岁;体重指数(BMI)为(25.46 ±3.34)kg/m2;HCV-RNA 为(6.23 ±1.53)log10 copies/mL。中青年组中,男 28 例,女 26 例;平均年龄(41.89 ±11.72)岁;BMI为(25.13 ±3.51)kg/m2;HCV-RNA 为(5.97 ±1.42)log10 copies/mL。两 组 患 者 在 性 别 构 成、BMI 及HCV-RNA均值方面比较,无统计学差异(P>0.05),具有可比性。
1.2 治疗方法
两组患者均给予聚乙二醇干扰素 α-2a(PEG-IFN α-2a)注射液(上海罗氏制药有限公司,国药准字J20070055)皮下注射180 μg,每周1次;同时口服利巴韦林片(北京双鹭药业股份有限公司,规格为每片 0.1 g,国药准字 H20054218),体重 60 kg以下300 mg/次,体重 60 kg以上 400 mg/次,均 3次 /日。两组患者均用药48周,然后随访观察24周。研究方案经伦理委员会批准,并取得患者知情同意。出现不良反应时,给予对症处理,必要时辅以心理疏导。若不良反应严重且对症处理无效,可改用普通干扰素治疗,但视为脱组。
1.3 观察指标
采用AU640型全自动生化分析仪(日本OLYMPUS光学株式会社)测定患者丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶(AST)等肝功能指标,试剂盒由Olympus Diagnostica GmbH公司提供;采用 BD FACSCanto II型流式细胞仪(美国BD Biosciences公司)测定患者 T 细胞亚群 CD3+、CD4+、CD8+、CD4+/CD8+、自然杀伤细胞(NK)水平,试剂由 BD Biosciences公司提供;采用 iCycler iQ型荧光定量 PCR仪(美国BIO-RAD公司),以实时荧光定量聚合酶链反应法测定HCV-RNA水平,试剂盒由中山大学达安基因股份有限公司提供。治疗过程中,监测患者血常规、尿常规、心电图、甲状腺功能等,并采用 SDS(Self-rating depression scale)抑郁自评量表评价患者精神状态,记录患者出现的各种不良反应。
1.4 疗效评价标准
病毒学应答评价标准:治疗4周时,HCV-RNA水平低于检测限,为快速病毒学应答(RVR);治疗12周时,HCV-RNA水平低于检测限,为早期病毒学应答(EVR);治疗结束时,HCV RNA低于检测限,为治疗结束时病毒学应答(ETVR);治疗结束后随访24 周时,HCV RNA 低于检测限,为持续病毒学应答(SVR)[8-9]。
1.5 统计学处理
2 结果
结果见表1至表4。

表1 两组患者的病毒学应答情况比较[例(%)]
表2 两组患者 ALT及 AST含量比较(U/L,±s)

表2 两组患者 ALT及 AST含量比较(U/L,±s)
注:与本组治疗前相比,*P <0.05;与中青年组同期相比,#P <0.05。下表同。
分组老年组 治疗前(n=1 9) 治疗 2 4周时治疗4 8周时2 4周随访时中青年组 治疗前(n=5 4) 治疗 2 4周时治疗4 8周时2 4周随访时A L T 8 7.3 4 ± 1 3.7 8 3 7.7 1 ± 8.8 2*#2 7.8 0 ± 6.8 4*3 3.6 3 ± 7.5 8*8 5.5 7 ± 1 2.3 6 2 6.1 8 ± 7.7 9*2 4.2 9 ± 7.2 2*3 2.75± 8.1 7*A S T 9 2.1 1 ± 1 5.0 1 3 8.6 3 ± 7.9 3*#3 0.1 8 ± 6.0 8*3 3.2 6 ± 6.5 7*9 0.3 7 ± 1 6.3 2 2 9.5 4 ± 6.3 6*2 7.9 3 ± 6.2 2*3 2.6 9 ± 6.8 9*
表3 两组患者T细胞亚群及NK细胞比较(±s)

表3 两组患者T细胞亚群及NK细胞比较(±s)
?
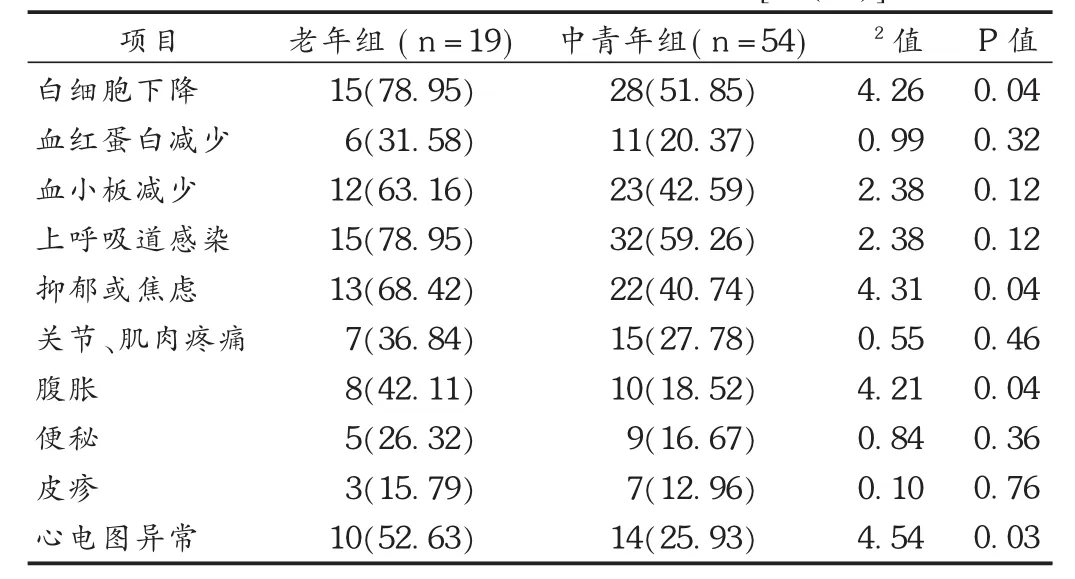
表4 两组患者不良反应发生情况比较[例(%)]
3 讨论
PEG-IFN α-2a通过对聚乙二醇和重组干扰素α-2a的共价结合,增强了干扰素的抗分解能力,延长了体内半衰期,从而实现了持久的抗病毒作用。与普通干扰素相比,PEG-IFN α-2a仅需每周注射1次,患者依从性较好,且疗效也优于普通干扰素,可使丙肝的 SVR率提高 30%左右[10-11]。虽然PEG-IFN联合 RBV治疗CHC的疗效和安全性已获广泛认可,但相关研究多基于中青年患者。老年患者因代谢能力下降,免疫机能减弱,合并基础病变增加等不利因素影响,采用该联合方案治疗是否安全有效,药物起效时间与中青年患者是否一致等,都还缺乏足够的研究。
本试验中以60岁为界,将CHC患者划分为中青年组和老年组,并采用PEG-IFN α-2a联合RBV的治疗方案,全面比较两组患者的疗效和安全性。结果表明,中青年组患者治疗后RVR,EVR,ETVR,SVR均高于老年组患者,但无统计学差异;中青年组患者治疗24周时,ALT及AST的降幅比老年组患者更显著,但随着治疗时间的延长,两组间ALT及AST的差异不断缩小;中青年组患者在治疗 24 周时,CD3+、CD4+、CD8+、CD4+/CD8+已有显著改善,而老年组患者则需到治疗48周时;治疗过程中,两组患者均无严重不良反应发生,但老年组患者在白细胞下降、抑郁或焦虑、腹胀、心电图异常等4项不良反应的发生率明显高于中青年组。上述结果提示,中青年组在治疗24周时,肝功能、机体免疫功能即已出现明显的改善,药物起效时间早于老年组患者;但在治疗48周时及随访24周时,老年组患者各项指标的改善情况已非常接近于中青年组,疗效较确切。这可能与中青年患者身体机能状况和免疫状态相对较好,合并基础疾病相对较少有关。郑颖颖等[12]发现,年龄不影响SVR率,本试验结果与其一致。曲思麦等[13]采用单因素分析时发现,PEG-IFN联合RBV治疗小于40岁的CHC患者可获得高于老年患者的RVR及EVR,但其在采用更为可信的多因素logistic回归分析筛选危险因素时,排除了年龄分组的影响。
虽然老年组患者接受48周的PEG-IFN α-2a及RBV联合治疗,可获得接近于中青年组患者的治疗效果,但前者在血液和淋巴系统异常、精神异常、心脏异常和胃肠道异常等方面的不良反应发生率还是高于中青年组,这可能与老年患者心理敏感、依赖性强及药物耐受能力弱有关。因此,对老年患者要积极控制基础病变,给予心理疏导和干预,高度重视并及时对症处理治疗过程中出现的不良反应。在此基础上,老年患者接受48周以上的PEG-IFN α-2a及RBV联合治疗时,也可获得与中青年患者相近的疗效。不过,本试验中老年组患者例数还不多,HCV基因型对老年患者治疗效果的影响也未充分考虑,这些都有待于后续研究做更深入和全面的探讨。
参考文献:
[1]Lemon SM,McKeating JA,Pietschmann T,et al.Development of novel therapies for hepatitis C[J].Antiviral Research,2010,86(1):79-92.
[2]Burlone ME,Budkowska A.Hepatitis C virus cell entry:role of lipoproteins and cellular receptors[J].Journal of General Virology,2009,90(5):1 055-1 070.
[3]刘 佳,蔡亚平.中国大陆地区1990~2010年丙型病毒性肝炎流行现状分析[J].现代预防医学,2013,40(14):2 590-2 592.
[4]李 杰,陈 杰,庄 辉.丙型肝炎的流行病学[J].实用肝脏病杂志,2012,15(5):379 -381.
[5]Sulkowski MS,Reindollar R,Thomas DL.Combination therapy with peginterferon alfa-2a(Pegasys)and ribavirin in ther treatment of patients with chronic hepatitis C:a phase II open-label study[J].Bio Drugs,2002,16(4):105-109.
[6]Ghany MG,Strader DB, Thomas DL,et al.Diagnosis,management, and treatment of hepatitis C:an update[J].Hepatology,2009,49(4):1 335 -1 374.
[7]中华医学会肝病学分会,中华医学会传染病与寄生虫病学分会.丙型肝炎防治指南[J].中华肝脏病杂志,2004,12(4):194-198.
[8]王 瑞,刘玉佩,钱 静,等.慢性丙型肝炎抗病毒治疗后患者体内持续病毒学应答率影响因素分析[J].山东医药,2013,53(27):7-10.
[9]刘雪梅,朱跃科,刘海霞,等.干扰素治疗老年丙型病毒性肝炎的临床分析[J].中国老年学杂志,2013,33(13):3 033-3 035.
[10]Craxì A.EASL clinical practice guidelines:management of hepatitis C[J].J Hepatol,2011,55(2):245-264.
[11]McCaughan GW,Omata M,Amarapurkar D,et al.Asian Pacific Association for the Study of the Liver consensus statements on the diagnosis,management and treatment of hepatitis C virus infection[J].Journal of gastroenterology and hepatology,2007,22:615-633.
[12]郑颖颖,范晓红,王力芬,等.聚乙二醇干扰素α-2a联合利巴韦林治疗老年慢性丙型肝炎的疗效和安全性[J].临床肝胆病杂志,2011,27(8):821-823.
[13]曲思麦,韩 峰,吴 丹,等.干扰素治疗慢性丙型肝炎获得快速和早期病毒学应答的影响因素[J].世界华人消化杂志,2012,20(24):2 281-2 287.

