几丁糖电纺膜对大鼠皮肤创面的病理学影响
陈汇浩 郭兴锋 侯春林*
论著·实验研究
几丁糖电纺膜对大鼠皮肤创面的病理学影响
陈汇浩 郭兴锋 侯春林*
目的观察本课题组自行研制的几丁糖电纺膜对大鼠创面的病理学变化的影响。方法取健康 SD大鼠25只,体重240~300g,于脊柱两侧切取直径1.8cm圆形创面,制作皮肤创面模型,左侧为实验组,右侧为对照组。实验组采用几丁糖电纺膜外敷,对照组用无菌纱布外敷,每日进行大体观察并记录创面愈合时间;术后3、5、7、9、12天切取包括创面在内直径为2.0cm的皮肤标本,行HE染色观察创面的组织学改变,计算实验组及对照组组织病理学评分。结果实验组创面无红、肿、热等局部炎性征象,从第3天开始观察到明显的创面收缩,残余面积第4天接近55%,第7天时达30%;对照组创面结痂迟,创缘收缩较慢,第4天开始观察到明显的创面收缩,第5天残余面积接近65%,第7天接近40%。实验组创面完全愈合时间为 (272.87±11.74)小时,对照组为 (303.80±12.15)小时,愈合时间有统计学意义 (P<0.01)。病理学观察实验组自手术后第3天开始依次出现肉芽组织增生及细胞浸润,胶原组织增生、创面皱缩及上皮化,到术后9天,胶原组织已排列整齐,上皮化过程基本完成,可见皮肤附件;对照组相应时间点观察到细胞浸润出现晚,且部分创面出现肉芽组织伴溃疡,上皮化过程较晚。实验组及对照组组织病理学评分有统计学意义 (P<0.01)。结论几丁糖电纺膜能减轻创面炎症反应,缩短创面愈合时间,促进创面上皮化,提高创面愈合质量,具有显著的促进愈合作用。
几丁糖电纺膜;病理学变化;大鼠;创面
目前在院外急救以及临床换药时应用的敷料一般为无菌纱布,仅有单纯止血和物理保护作用,无抑菌作用。几丁糖[1]已被证实是一种组织相容性良好的天然高分子材料,具有止血、抑菌、促进上皮细胞生长、抑制成纤维细胞生长等功能。但传统工艺生产的几丁糖膜脆性大,与组织黏附性差,缝合强度不足。而几丁糖电纺膜,是以单一几丁糖为原料、通过电纺技术制成几丁糖电纺膜(Chitosan electrospun membrane,CEM)强度大、厚度薄、柔韧性好,体外生物力学实验证实其物理性能适合作为敷料,我们采用大鼠皮肤创面模型,从病理学角度研究几丁糖电纺膜对创面的作用。
1 材料与方法
1.1 实验动物及主要试剂、仪器
健康SD大鼠25只,雌雄不限,体重240~300g,由第二军医大学动物中心提供。几丁糖电纺膜(本课题组自行研制,见图片2f,拉伸强度为 (7.93±0.35)MPa,弹性模量为(117.9±7.6)MPa);水合氯醛(国药集团上海分公司);BX41显微镜 (Olympus公司,日本)。
1.2 动物模型制备及分组
大鼠以10%水合氯醛 (25mg/100 g)腹腔注射麻醉后,俯卧固定。于两侧脊柱旁开0.8cm处,切取直径1.8 cm圆形创面,深至肌筋膜,两创面间距1.6cm,制备大鼠皮肤创面模型,左侧为实验组,右侧为对照组。实验组采用几丁糖电纺膜外敷,对照组用无菌纱布外敷,独笼饲养,期间不行创面消毒及换药,不使用抗生素。
1.3 检测指标
1.3.1 大体观察
观察术后创面结痂情况、炎性反应和创面残余面积等。参照 Lodha SC[2]残余创面小于初时总面积的5%或愈合面积大于95%为创面愈合愈合标准,记录不取标本的15只大鼠创面愈合时间。
1.3.2 组织学观察
于术后3天随机处死2只大鼠,切取创面及其周围直径为2.0cm皮肤标本,10%中性甲醛固定。每个标本经脱水、透明、浸蜡、包埋,切片,厚度为1 m,切取25片,每第5个备用,共选取5个切片行常规HE染色,即实验组及对照组各选取10个切片行镜下观察创面组织学改变。同法于5、7、9、12天随机处死2只大鼠并行组织学观察。
1.3.3 组织病理学评分
常规HE染色切片按照Eldad[3]等设定的组织学标准定量评价系统进行组织病理学评分,即在放大400倍光镜下通过观察:表皮结构、真皮-表皮邻接处和微水疱、胶原束和皮肤结构、表皮再生、粒细胞浸润数量来评分,每项指标0~2分,总分0~10分。
1.4 统计学方法
采用 SPSS 13.0统计软件包进行分析。结果以均数±标准差(±S)表示,两两比较采用方差齐性检验,组间比较采用两样本 检验,P<0.05为有统计学意义。
2 结果
2.1 创面情况
在本实验中选用SD大鼠,手术后均未使用抗生素。实验侧创面无红、肿、热等局部炎性征象,对照组创面结痂迟,创缘收缩较慢。实验组从第3天开始观察到明显的创面收缩,残余面积第4天接近55%,第7天时达30%,而对照组愈合相对较慢,第4天开始观察到明显的创面收缩,第5天残余面积接近65%,第7天接近40%。大鼠背部创面残余面积随时间而变化的函数关系如图1所示。
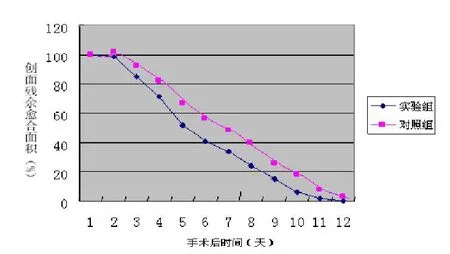
图1 大鼠背部创面残余面积随时间而变化关系图
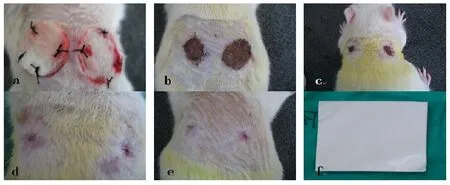
图2 实验照片:a~e分别为术后1、4、7、9、12模型,左侧为实验组,右侧为对照组。f为几丁糖电纺膜。彩图见插页
2.2 术后创面愈合时间如表1
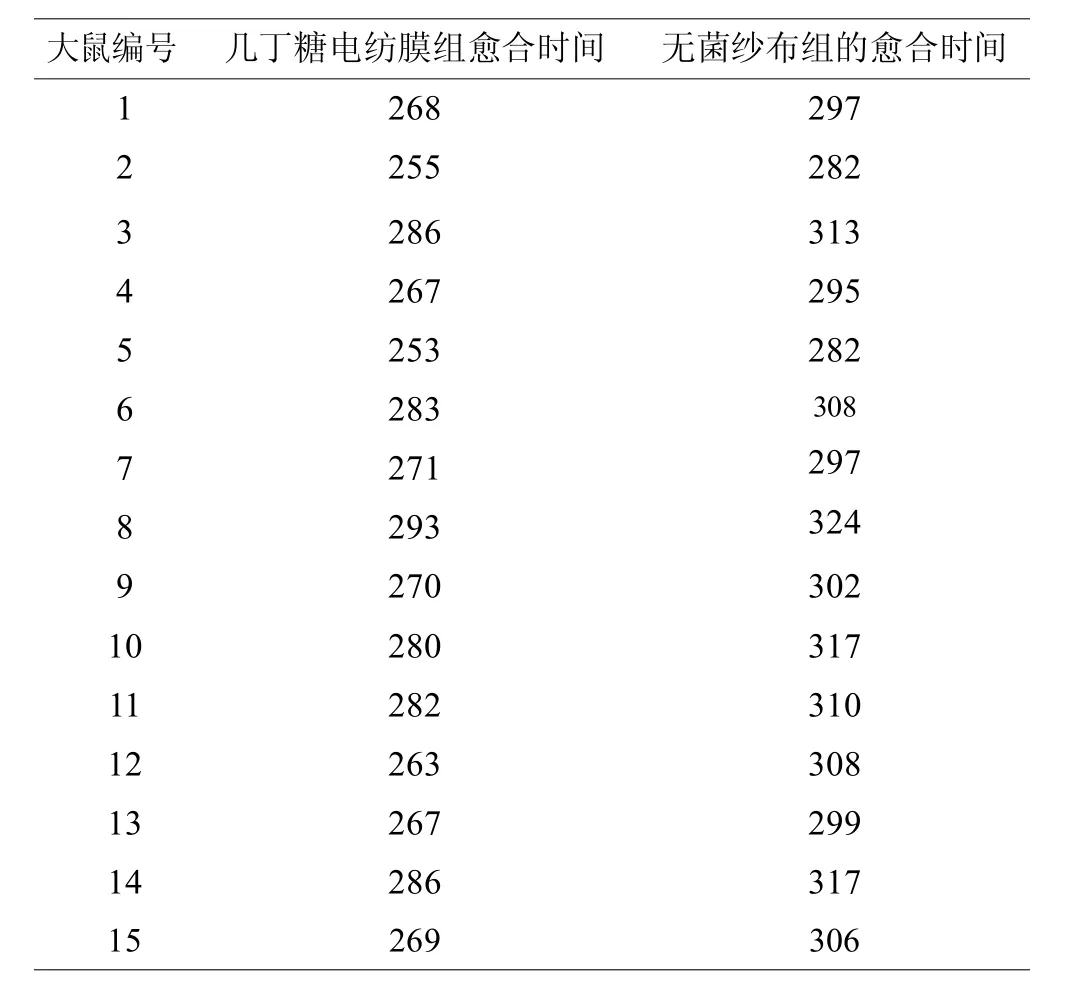
表1 几丁糖电纺膜组及无菌纱布组的愈合时间HT(小时)
几丁糖电纺膜组创面完全愈合时间为 (272.87±11.74)小时,无菌纱布组为(303.80±12.15)小时,两者之间有显著性差异(P<0.01)。
2.3 HE染色组织学观察
实验组术后3天可见创面深层大量肉芽组织增生,肉芽组织由垂直于创面生长的实性细胞索、扩张的毛细血管、成纤维细胞及炎性细胞组成;术后5天创面炎性细胞浸润减少,部分毛细血管闭塞、数目减少,胶原组织增生。术后7天创面已无明显细胞浸润,大部分毛细血管闭塞,大量胶原组织增生及部分上皮化;术后9天胶原组织排列整齐,上皮化过程基本完成,可见少量皮肤附件;术后12天情况,肉芽组织生长成熟,成为为纤维结缔组织,上皮化完成,皮肤愈合 (图3 a~e,彩图见插页)。
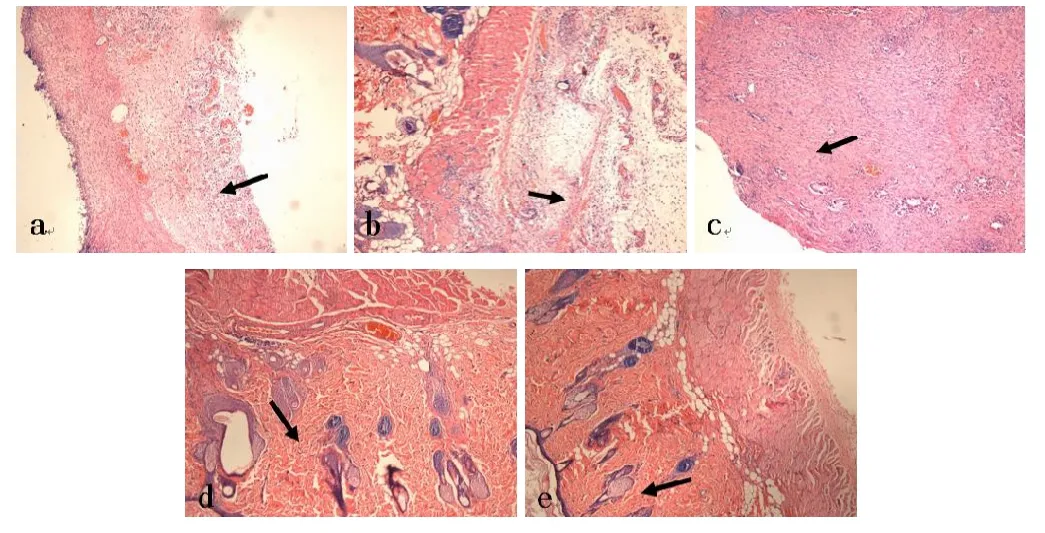
图3 实验组(HE×100)a术后3天箭头所指为新生肉芽组织;b术后5天箭头所指为新生胶原组织;c术后7天箭头所指为形成的大量胶原组织;d术后9天箭头所指为排列整齐的胶原;e术后12天箭头所指为成熟结缔组织及部分皮肤附件
对照组术后3天大量炎性细胞浸润,少量扩张的毛细血管及成纤维细胞;术后5天可见炎性细胞仍大量浸润,肉芽组织增生,部分切片可见溃疡组织,少量胶原组织增生;术后7天创面炎性细胞比较多,胶原纤维增多,不均匀;术后9天见炎性细胞减少;毛细血管闭塞,纤维结缔组织增生,罕见皮肤附件;术后12天上皮化过程基本完成,但部分创面中心见溃疡,可见慢性肉芽肿性炎症性改变(图4a~e,彩图见插页)。
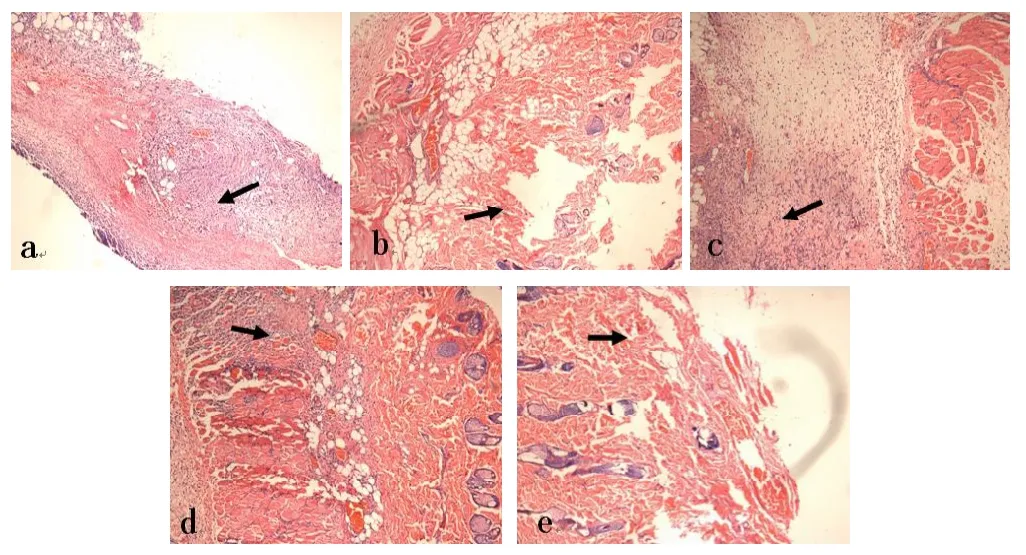
图4对照组a术后3天箭头所指为新生肉芽组织及大量炎性细胞;b术后5天箭头所指为少量新生胶原组织及局部溃疡组织;c术后7天箭头所指为胶原组织形成及炎性细胞;d术后9天箭头所指为纤维组织形成及浸润的炎性细胞;e术后12天箭头所指为基本完成上皮化的创面
2.4 组织病理学评分

表2 实验组及对照组不同时段组织病理学评分
3 讨论
湿润环境可促进创面愈合是自Winter于1962年提出以来,自此产生了功能活性敷料的概念。其基本功能要求是能维持一个湿润的愈合环境,并保护创面免受细菌感染[4]。天然高分子多聚糖类具有卓越的生物相容性和形成水凝胶的生物特性[1],已成为新型创面敷料的主要基材,可用于促进伤口愈合[5]。随着近年对几丁糖研究的深入,其促进伤口愈合的作用也被众多学者证明[6],其可能的机制有:①几丁糖被酶降解而释放N乙酰葡糖胺 (Nacetyl glucosamine,NAG),由NAG对创面发挥促进愈合作用;②几丁糖对成纤维细胞有调节作用;③几丁糖可激活巨噬细胞,刺激促进伤口愈合的炎性成分产生,同时促进与创面愈合有关的细胞(如内皮细胞和间质纤维母细胞)增殖,加速创面的收缩和适度的胶原组织增生[7]。几丁糖具备止血作用[8],通过对红细胞聚集、对血小板的粘附和聚集[9]阻止血纤维蛋白束的形成,亦可促进创面的愈合。体外细胞培养的研究发现几丁糖具有促进上皮生长、抑制成纤维细胞生长的双重作用[10],有利于创面的愈合。几丁糖具有良好的生物相容性,被广泛应用于创面修复领域,郭兴锋等通过动物实验模型证实了几丁糖海藻酸敷料具备促进伤口愈合的作用[11]。Arockianathan PM等将几丁糖、西米淀粉加入纳米银离子后制备成膜,用于老鼠的创面修复研究,能显著加快创面的愈合[12]。TranNQ等将芦丁和壳聚糖制成几丁糖凝胶用于老鼠创面的修复,组织学检测提示能促进上皮细胞再生,促使创面上皮化[13]。
几丁糖电纺膜以单一几丁糖为原料,工艺简单,成本低廉;几丁糖为凝胶状,易流失,而几丁糖电纺膜物理化学性状稳定,能长时间覆盖、保护创面;就几丁糖本身来说,机械强度方面明显不足,制成几丁糖电纺膜后其拉伸强度能达到 (7.93±0.35)Mpa,弹性模量到达 (117.9±7.6)Mpa,强度大,具有良好的生物力学效应,在覆盖创面时能避免材料的崩裂,柔韧性好,能更好的贴附于创面,因而几丁糖电纺膜是一种优良的促进创面愈合的材料。我们认为其对创面愈合可能主要有以下影响:①形成的水凝胶体黏附创面,其良好的生物力学效应能长久封闭创面,减少了创面污染的机会。②快速吸收创面渗出液及血液,溶胀成为水凝胶体,保持创面湿润环境,利于创面愈合。③几丁糖具备的止血作用能减少创面出血,缩小或避免局部血肿形成,利于创面愈合。④该敷料能促进损伤区血管内皮细胞和上皮细胞增生,促进间质纤维母细胞增殖,加速创面的收缩和适度的胶原组织增生,促进肉芽形成和加速瘢痕塑形。抑制成纤维细胞生长,减少瘢痕形成,提高创面愈合质量。当然其保护创面及促进愈合机制值得进一步深入研究。
我们的实验中,实验组创面炎性反应轻,结痂收缩较快;对照组创面结痂收缩较慢。实验组创面完全愈合时间较对照组明显缩短(P<0.01)。组织学检查提示使用几丁糖电纺膜后,创面上皮爬行速度及上皮层成熟度均明显优于对照组,且实验组真皮层胶原分布稀疏,排列成网状,结构类似正常皮肤,实验组创面组织病理学评分优于对照组 (P<0.01)。结果提示几丁糖电纺膜能减轻大鼠创面炎症反应,缩短创面愈合时间,促进创面上皮化,提高创面愈合质量,具有显著的促进愈合作用。
[1] Lawrie G,Keen I,Drew B,et al.Interactions between alginate andchitosan biopolymers characterized using FTIR and XPS. Biomacromolecules,2007,8(8) : 2533-2541.
[2] Lodha SC,Lohiya ML,Vyas MC,et al.Role of phenytoin in healing of large abscess cavities[J].Surg,1991,78(1):105-8.
[3] Eldad A,Weinberg A,Breiterman S,et al.Early nonsurgical removal of chemically injured tissue enhances wound healing in partial thickness burns.Burns,1998,3,24(2):166-72.
[4] Murakami K.Enhanced healing of mitomycin C-treated healingimpairedwounds in rats with hydrosheets composed of chitin/chitosan,fucoidan, and alginate as wound dressings[J].Wound RepairRegen,2010,18(5) :478-485.
[5] Tchemtchoua,V T.Development of a chitosan nanofibrillar scaffold forskin repair and regeneration[J]Biomacr-omolecules,201l, 12(9):3194-3204.
[6] Tran NQ.In situ forming and rutin-releasing chitosan hydrogels as injectable dressings for dermal wound healing[J].Biomacromolecules,201l,12(8):2872-2880.
[7] Yang Y,He Q,Duan L,et al.Assembled alginate/chitosan nanotubes for biological application.Biomaterials,2007,28(20):3083-3090.
[8]谢学锋,郭万厚,吴会静.壳聚糖膜在皮瓣止血中的应用研究.中国美容医学,2012,21(10):334.
[9] 尹刚等.浅析壳聚糖的止血作用及机理.生物骨科材料与临床研究,2009,6(4):18-19.
[10]夏平光,侯春林,王万宏.几丁糖抑制人成纤维细胞增殖的实验研究.中国修复重建外科杂志,2007,21(8):833-836.
[11]郭兴锋等.几丁糖/海藻酸敷料止血性能的实验研究.生物骨科材料与临床研究,2008,5(2):4-6.
[12]Aroekianathan P , Preparation M. Characterization and evaluationof biocomposite films containing chitosan and sago starch impregnatedwith silver nanoparticles[J].Int Biol Macromol,2012,50(4)939-946.
[13]Tran NQ.In situ forming and rutin-releasing chitosan hydrogels asinjectable dressings for dermal wound healing[J].Biomacro-molecules,2011,12(8): 12872-2880.
Pathological changes of novel chitosan membrane on skin wound in rats
ObjectiveTo observe the Pathological changes of electrospun chitosan membrane's effect on wound.MethodsSD rats 25 and weighing 240 to 300g,a 1.8cm skin round incisions were made bilaterally along the SD rats' spine to establishthe model of rat's skin wounds.The left side is experimental group,the right side is control group.In the experimentalgroup, wounds were treated with electrospun chitosan membrane, whereas the sterile gauze was used in the control group.To observe and record the wound healing condition erery days. The 2.0cm skin tissues in diameter were removed 3,5,7,9,12 days after the operation, stained with HE. To observe the histological changes by microscope and calculate histopathologicalscores of two groups.ResultsIn the experimental group, wound inflammatory response was lighter and crustshrinked faster. The wounds healing time is (272.87±11.74) h in experimental group versus (303.80±12.15) h in control,there is a significantly difference between them ( <0.01). Granulation tissue proliferation and cell infiltration, collagentissue proliferation, wound shrinkage and epithelization were observed to occur after the operation for 3 days in the experimentalgroup. 9 days after the operation, Collagen tissue lined regularly, epithelization basically completed and appendagesof the skin were also observed. 12 days after the operation, The wounds have healed. Reversely, at the sametime point , cell infiltration and epithelization were observed later, and some granulation tissue with ulcers was observed.There is a significantly difference in histopathological scores between two groups ( <0.01).ConclusionChitosan electrospunmembranes can reduce inflammation , shorten healing time, promote wound epithelialization and improve thequality of wound healing. It plays a significant role in healing promotion.
Electrospun Chitosan Membrane;Pathological changes;Rats;Wound
R318.08 Q813.1
A
陈汇浩(1978-)男,硕士研究生,住院医师。研究方向:创伤骨折与修复重建、生物材料。
*[通讯作者]侯春林(1945-)男,硕士研究生,主任医师。研究方向:创伤骨折与修复重建、生物材料。
2013-12-23)
第二军医大学附属长征医院骨科,上海 200003

