电喷雾离子化质谱在岩藻聚糖结构研究中的应用
胡 培,吴 斌,李志雄*
(1.上海中医药大学 曙光临床医学院,上海 201203;2.中国科学院上海药物研究所,上海 201203)
电喷雾离子化质谱在岩藻聚糖结构研究中的应用
胡 培1,2,吴 斌2,李志雄2*
(1.上海中医药大学 曙光临床医学院,上海 201203;2.中国科学院上海药物研究所,上海 201203)
综述了电喷雾离子化质谱的电离原理和多糖的电喷雾电离机理,以及电喷雾电离质谱技术在岩藻聚糖结构解析中的应用。
电喷雾电离质谱;岩藻聚糖;结构解析;综述
近年来,随着对多糖生物大分子的深入研究,多糖的许多重要生物活性引起了越来越多的学者关注,在高活性多糖的新药开发及其生物学构效关系研究中,阐明多糖的具体结构具有至关重要的意义。多糖结构的分析较蛋白质结构分析复杂,因为组成多糖的单糖种类多,连接方式不同及连接有分支,因而需要将各种化学及物理方法结合起来才能完成对多糖结构的分析。多糖结构分析中,质谱由于具有高灵敏性及高选择性的优点,逐渐成为结构分析中的一种主要分析手段。尤其是各种软电离技术在多糖中的应用[1-2],如快原子轰击质谱[3]、电喷雾质谱[4]、基质辅助激光解吸离子化[5]等飞行时间质谱,使多糖结构的研究取得了日新月异的进展。本文主要综述电喷雾离子化质谱(ESIMS)技术在岩藻聚糖结构分析中的应用。
1 电喷雾电离质谱
1.1 电喷雾电离技术
电喷雾电离是现代质谱中的软电离技术,是将溶液中分子转变成气相分子非常有用的手段[6],其电离的过程主要分为三个阶段:液滴的形成、液滴蒸发和气态离子的形成。样品溶液通过毛细管导入大气压电离源内,在毛细管的出口处施加高电压,使得样品溶液在强电场及雾化气的作用下形成细小的带点液滴。细小的带电液滴在高温干燥气流下,溶剂不断蒸发,液滴直径快速变小,比表面电荷不断增加,然后达到瑞利极限后,发生库仑爆炸,生成更小的带电小液滴,此过程不断地进行(如图1),直至溶剂蒸发完全形成待测物离子[7-14]。
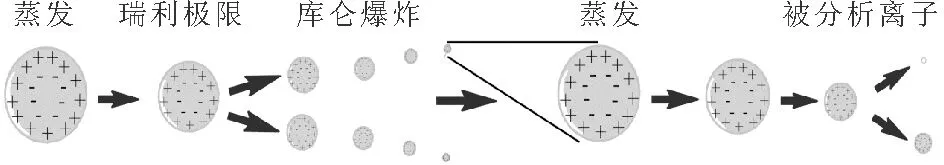
图1 电喷雾电离过程
1.2 多糖在电喷雾中的电离机理
研究表明,多糖、蛋白质等生物大分子的电喷雾电离机理主要为带电残基模型[15],首先由喷针外加电场使溶液带电,形成带电液滴,然后在电场的作用下加速运动并迅速去除溶剂,溶液中的分子所带电荷被保留在溶质分子上,形成离子化分子后进入质谱检测器中检测。
2 岩藻聚糖质谱结构分析
2.1 岩藻聚糖
岩藻聚糖是硫酸化的杂多糖,主要由岩藻糖、半乳糖、葡萄糖、甘露糖、葡萄糖醛酸等单糖组成,其中各种糖环上有硫酸基团的取代[16]。由于其无毒,具有广泛的生物活性,逐渐成为研究的热点,其活性主要包括免疫调节[17]、抗凝血作用[18]、抗病毒作用[19]、抗氧化活性[20]及抗肿瘤活性[21]。然而这些活性与岩藻聚糖的结构特征是紧密相关的,如岩藻聚糖上的硫酸基团的取代度[22]、分子量大小[23]及糖链的链接方式[24],因此其结构研究对其生物活性作用机理的阐明发挥着十分重要的作用。
2.2 糖链质谱裂解碎片命名
多糖在质谱中的糖链裂解模式如图1,采用Costello等[25]命名的糖类碎片离子规则,以区分碎片离子的类型,断裂后电荷保留在糖的还原端的离子被命名为Y、Z(糖苷键断裂)和A(开环断裂),断裂后电荷保留在非还原端的离子命名为B、C(配糖体断裂)和X(开环断裂),其中开环断裂离子A和X的上标表示断裂两个键的位置。通过质谱数据分析识别和确认这些类别的离子,就能得到糖链结构的信息。同时多糖生物大分子及其寡糖的碎片在电喷雾电离质谱中的负离子模式下易离子化且响应度和灵敏度均较高。

图2 糖链质谱裂解碎片类型
2.3 岩藻聚糖中不含硫酸基团寡糖链的质谱裂解
岩藻聚糖经部分酸水解后得到各种寡糖片段,将得到的含有大量结构信息的寡糖通过质谱的裂解碎片来分析寡糖的结构,从而推导岩藻聚糖的一级结构。岩藻聚糖中常见的不含硫酸基团的单糖及寡糖质谱碎片如下,含有两个单糖的寡糖[FucGlcA-H]-[26-27],如图3-A,其分子离子峰为m/z339.093,其中非还原端的岩藻糖经过0,2A型糖环裂解产生较高强度的离子m/z 235.046,而碎片离子m/z 261.061为还原端的葡萄糖糖醛酸通过2,5A型裂解,此裂解方式为糖醛酸的特征裂解方式[16,26],碎片离子m/z 193.033和碎片离子m/z 175.025分别为葡萄糖醛酸的分子离子峰及脱去一分子水后的碎片离子,即[FucGlcA-H]-的Y型裂解和Z型裂解。碎片离子m/z 355.089 为一分子六碳糖与一分子糖醛酸相连的寡糖的分子离子峰[27],如如图3-B,分子离子峰[GalGlcA-H]-,其裂解碎片m/z 295.063、m/z 277.054及m/z 265.055分别为还原端的葡萄糖醛酸的0,2A、2,5A及0,3A糖环裂解,其中0,3A的裂解方式可推测出该糖链的连接为(1→4)连接。碎片离子m/z 235.047 为[GalGlcA-H]-的非还原端半乳糖0,2X糖环裂解。
含四个单糖的寡糖[Fuc3GlcA-H]-分子离子峰为m/z 631.204[26],如图3-C,其主要碎片裂解方式为糖苷键的断裂,产生Y型和Z型离子,该寡糖连接方式为Fuc-(1→3)-Fuc-(1→4)-Fuc-(1→3)-GlcA,从糖链左边至右边裂解,其中碎片离子m/z 485.147和碎片离子m/z 467.140为该寡糖非还原端的岩藻糖的Y3型和Z3型裂解离子,碎片离子m/z 339.097和碎片离子m/z 321.083为第二个岩藻糖的Y2型及Z2型裂解离子,碎片离子m/z 193.033和碎片离子m/z 175.025为葡萄糖醛酸与第三个岩藻糖连接处的Y1型及Z1型裂解离子。其它离子碎片主要为糖环裂解方式产生A型和X型的离子,如碎片离子m/z 571.189和碎片离子m/z 553.174分别为还原端的葡萄糖醛酸0,2A裂解碎片及2,5A裂解碎片,碎片离子m/z 527.159为非还原端的岩藻糖的0,2X糖环开环裂解碎片,碎片离子m/z 381.102为第二个岩藻糖的0,2X糖环开环裂解碎片,碎片离子m/z 235.045为第三个岩藻糖的0,2X糖环开环裂解碎片。
岩藻聚糖中含有[GlcAMan]n类型的两个重复单糖的寡糖链[16],如图3-D,[GlcAMan]3,该寡糖结构还原端为甘露糖,非还原端为葡萄糖醛酸,糖链连接方式主要为甘露糖的1,2连接和葡萄糖醛酸的1,4连接,其分子离子峰为m/z 1031,脱去一分子水后形成碎片离子为m/z 1013,其B型糖苷键裂解碎片主要有m/z 851、m/z 675、m/z 513、m/z 337、m/z 175;C型糖苷键裂解碎片主要有m/z 693、m/z 531、m/z 355;Y型糖苷键裂解碎片主要有m/z 693、m/z 355;Z型糖苷键裂解碎片主要有m/z 675、m/z 337、m/z 193。由于该寡糖碎片只含有两种单糖,因此该寡糖在结构中的糖苷键裂解碎片B型裂解与Z型裂解有重合的碎片m/z 675、m/z 337,C型裂解与Y型裂解也有重合的碎片m/z 693、m/z 355。其还原端甘露糖0,2A型裂解碎片离子为m/z 911,与非还原端的葡萄糖醛酸相连的甘露糖的0,2A型裂解可产生碎片离子m/z 235,中间的甘露糖的0,2A型裂解可产生碎片离子m/z 573。
2.4 岩藻聚糖中含有硫酸基团寡糖的质谱裂解
岩藻聚糖中含有大量的硫酸基团,其主要连接位置是在糖环上的2位和4位,岩藻聚糖中常见的含硫酸基团的糖环有木糖、岩藻糖、葡萄糖、半乳糖等,由于硫酸基团在连接位置上的不同,糖环在质谱中具有不同的裂解碎片,因而可以根据裂解碎片的不同来确定硫酸基团在糖环上的取代位置。如含有一个硫酸基团的木糖[26,28][XylSO3Na-Na]ˉ,如图4-a和b,其2位取代和4位取代的分子离子峰均为m/z 229.003,2位取代的木糖经过0,2X裂解产生裂解碎片m/z 138.970,而4位取代的木糖经过0,2A裂解产生裂解碎片m/z 168.979。因此通过碎片离子m/z 138.970和m/z 168.979即可判断该木糖的硫酸基团的取代位置。同样岩藻糖上硫酸基团的2位取代和4位取代在质谱中具有不同的裂解碎片,如2位取代的岩藻糖以m/z 139.0为基峰,而4位取代的岩藻糖以m/z 183.0为基峰,因而通过识别这两个离子峰即可判别该岩藻糖硫酸基的取代位置。
另外寡糖[XylFucSO3][26],如图4-c,有三种可能的连接方式:第一种是木糖与含2位取代的硫酸基的岩藻糖以1,4糖苷键连接;第二种是岩藻糖与含2位取代的硫酸基的木糖以1,4糖苷键相连;第三种是含2位取代的硫酸基的岩藻糖与木糖以1,4糖苷键相连。以上三种形式的寡糖在质谱中的分子离子峰均为m/z 375.059,其分子式为[XylFucSO3Na-Na]-。其中第一种连接方式在质谱中的分子离子峰为m/z 375.059,岩藻糖糖环0,2X裂解产生离子碎片为m/z 138.972,木糖环0,2X裂解离子碎片为m/z 285.032,糖苷键Z型裂解产生离子碎片m/z 225.006,Y型裂解产生离子碎片m/z 228.996。第二种连接方式在质谱中分子离子峰同样是m/z 375.059,岩藻糖糖环0,2X裂解产生离子碎片m/z 271.008,含硫酸基的木糖糖环0,2X裂解产生离子碎片m/z 138.972,Y型裂解产生离子碎片m/z 228.996,Z型裂解产生离子碎片m/z 210.993。第三种连接方式在质谱中分子离子峰为m/z 375.059,岩藻糖糖环0,2X裂解产生离子碎片m/z 271.008,木糖糖环0,2A裂解产生离子碎片m/z 315.043,糖苷键B型裂解产生离子碎片m/z 225.006,C型裂解产生离子碎片m/z 243.014。以上三种连接方式因含有硫酸基团,在质谱中具有不同的裂解碎片,所以可以通过以上的碎片来区分寡糖的连接方式。

图3 不含硫酸基寡糖质谱碎片裂解过程
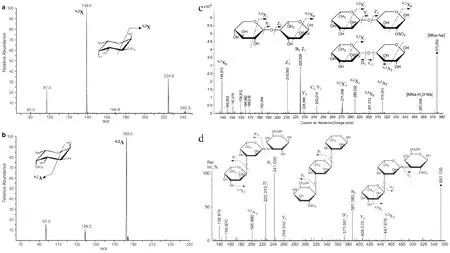
图4 含有硫酸基寡糖质谱碎片裂解过程
寡糖[Fuc2HexSO3][27],如图4-d,同样有三种可能的连接方式:第一种是非还原端为2位硫酸基取代的岩藻糖,还原端为六碳糖;第二种是非还原端为2位硫酸基取代的六碳糖,还原端为岩藻糖;第三种为非还原端为岩藻糖,还原端为2位硫酸基取代的六碳糖。三种连接方式的分子离子峰均为m/z 551.130,其中第一种连接方式的非还原端的岩藻糖进行0,2X裂解产生离子碎片m/z 447.070,非还原端岩藻糖与中间的岩藻糖之间的糖苷键B型裂解产生离子碎片m/z 225.010,中间岩藻糖与还原端的六碳糖之间的糖苷键B型裂解产生离子碎片m/z 371.001;第二种连接方式的非还原端的六碳糖与中间的岩藻糖之间的糖苷键B型裂解产生离子碎片m/z 241.000,中间的岩藻糖与还原端的岩藻糖之间的糖苷键B型裂解产生离子碎片m/z 387.060;第三种连接方式的非还原端的岩藻糖进行0,2X裂解产生离子碎片m/z 447.070,非还原端的岩藻糖与中间的岩藻糖之间的糖苷键进行Y型裂解产生离子碎片m/z 405.070,中间岩藻糖与还原端的含硫酸基的六碳糖之间的糖苷键进行Y型裂解产生离子碎片m/z 259.010。通过以上不同的离子碎片,可以判断出该寡糖的连接方式及所含硫酸基团的取代位置。
3 展望
多数岩藻聚糖是由多种单糖共同组成,其结构具有非均匀性,支链较多,复杂程度高[29-30],因而对糖链结构的解析非常难,需结合各种化学物理方法获得各种糖环信息,然后将所得到的信息进行综合,从而推测出糖链的一级结构,其中电喷雾电离质谱能针对岩藻聚糖非均匀性阴离子碳水化合物提供单糖的连接顺序及基团的取代位置,在含有硫酸基团的岩藻聚糖中,电喷雾电离质谱技术显示出了强大的生命力,能提供非常丰富的结构信息,成为多糖结构解析的有力手段。虽然由于各种单糖的差异性小,均为差向异构体,质谱无法完全区分各种戊糖之间的差异及各种己糖之间的差异,同时无法准确确定糖链中的全部连接方式,但是可以通过甲基化气质联用共同获得。随着质谱技术在多糖中的不断应用和发展,相信不久将来质谱能区分各种差向异构体的糖类,从而达到仅通过质谱就能解析出多糖的一级结构,促进多糖领域的发展。
[1] OKAMOTO M.A comparative study on structural elucidation of sialyl oligosaccharides by mass spectrometry with fast atom bombardment,electrospray ionization and matrix assisted laser desorptian/ionization [J].Biosci Biotechnol Biochem,2001,65(11):251.
[2] HARVEY DJ,DWEK RA,RUDD PM,et al.Determining the structure of glycan moieties by mass spectrometry [J].Current Protocols in Protein Science,2006,43:1271-1278.
[3] NAKAMURA A,FURUTA H,MAEDA H,et al.Analysis of the molecular construction of xylogalacturonan isolated from soluble soybean polysaccharides [J].Bioscience,Biotechnology,and Biochemistry,2002,66(5):1155-1158.
[4] VIRGINIA MF GONALVES,ANA REIS,M ROSARIO M DOMINGUES,et al.Structural analysis of gellans produced by sphingomonas elodeastrains by electrospray tandem mass spectrometry [J].Carbohydrate Polymers,2009,77(1):10-19.
[5] HARVEY DJ. Matrix-assisted laser desorption ionization mass spectrometry of carbohydrates and glycoconjugates [J].Int.J.Mass Spectrometry,2003,226(1):1-35.
[6] FENN,JB,MANN M,MENG CK,et al. Electrospray ionization for mass spectrometry of large biomolecules [J].Science,1989,246:64-71.
[7] VAN BERKEL G.Electrolytic deposition of metals on to the high-voltage contact in an ESI emitter:implications for gas-phase ion formation [J].Mass Spectrometry, 2000,35:773-783.
[8] COLE R. Some tenets pertaining to ESI-MS [J].Mass Spectrometry,2000,35:763-772.
[9] FENN J,MANN M,MENG C,et al.Electrospray ionization:principles and practice [J].Mass Spectrum Rev,1990(9):37-70.
[10] AMAD M,CECH N,JACKSON G,et al.Importance of gas-phase proton affinities in determining the electrospray ionization response [J].Mass Spectrometry,2000,35: 784-789.
[11] GAMERO-CASTANO M,MORA J.Kinetics of small ion evaporation from the charge and mass distribution of multiply charged clusters in electrosprays [J].Mass Spectrometry,2000,35:790-803.
[12] KEBARLE P.A brief overview of the present status of the mechanisms involved in electrospray mass spectrometry [J].Mass Spectrometry,2000,35:804-817.
[13] TAKATS Z,WISEMAN J,GOLOGAN B,et al.Mass spectrometry sampling under ambient conditons with desorption electrospray ionization [J].Science,2004,306:471-473.
[14] CHEN H,YANG S,YANG C,et al.Sensitive detection of native proteins using extractive electrospray ionization mass spectrometry [J].Angew Chem Int Ed,2010, 49:3053-3056.
[15] IRIBARNE J,THOMAON B.On the evaporation of small ions from charged droplets [J].Chem Phys,1976,64:2287-2294.
[16] WANG PP,ZHAO XL,YU GL,et al.Analysis of structural heterogeneity of fucoidan from Hizikia fusiforme by ES-CID-MS/MS [J].Carbohydrate Polymers,2012,90:602-607.
[17] CHEN XM,NIE WJ,JIN LQ,et al.Antitumor and immunomodulatory activity of polysaccharides from sargassum fusiforme [J].Food and Chemical toxicology,2012,50(3-4):695-700.
[18] ATHUKORALA Y,LEE KW,KIM SK,et al.Anticoagulant activity of marine green and brown algae collected from Jeju Island in Korea [J].Bioresource Technology,2007,98(9):1711-1716.
[19] LEE JB,TAKESHITA A,HAYASHI K,et al.Structures and antiviral activities of polysaccharides from sargassum trichophyllum [J].Carbohydrate Polymers,2011, 86(2):995-999.
[20] MINGJIANG WU,YUE WU,XIUFENG YAN, et al.Evaluation of antioxidant activities of water-soluble polysaccharides from brown alga Hizikia fusiforme [J].International Journal of Biological Macromolecules,2013,56:28-33.
[21] SYNYTSYA A,KIM WJ,KIM SM,et al.Structure and antitumor activity of fucoidan isolated from sporophyll of korean brown seaweed Undaria pinnatifida [J].Carbohydrate Polymers,2010,81(1):41-48.
[22] TERUYA T,KONISHI T,UECHI S,et al.Anti-proliferative activity of oversulfated fucoidan from commercially cultured Cladosiphon okamuranus TOKIDA in U937 cells [J].International Journal of Biological Macromolecules,2007,41(3):221-226.
[23] NISHINO T,AIZU Y,NAGUMO T.The relationship between the molecularweight and the anticoagulant activity of 2 types of fucan sulfates from the brown seaweed ecklonia-kurome [J].Agricultural and Biological Chemistry,1991,55(3):791-796.
[24] ANASTYUK SD,SHEVCHENKO NM,ERMAKOVA SP,et al.Anticancer activity in vitro of a fucoidan from the brown alga Fucus evanescens and its low-molecular fragments,structurally characterized by tandem mass-spectrometry [J].Carbohydrate Polymers,2012,87(1):186-194.
[25] DOMON B,COSTELLO CE.A Systematic nomenclature for carbohydrate fragmentations in FAB-MS/MS spectra of glyconjugates [J].Glycoconjugate, 1988,4(5):397-409.
[26] ANASTYUK SD,SHEVCHENKO NM,SHEVCHENKO EL,et al.Structural analysis of a fucoidan from the brown alga fucus evanescens by MALDI-TOF and tandem ESI mass spectrometry [J].Carbohydrate Research,2009,344:779-787.
[27] ANASTYUK SD,TATYANA II,NATALIA MS,et al.ESIMS analysis of fucoidan preparations from costaria costata,extracted from alga at different life-stages [J].Carbohydrate Polymers,2012,90:993-1002.
[28] DANIEL R,CHEVOLOT L,TISSOT B,et al.Electrospray ionization mass spectrometry of oligosaccharides derived from fucoidan of ascophyllum nodosum [J].Carbohydrate Research,2007,342:826-834.
[29] BILAN MI,GRACHEV AA,USOV AI,et al.Preliminary investigation of a highly sulfated galactofucan fraction isolated from the brown alga sargassum polycystum [J].Carbohydrate Research,2013,337:48-57.
[30] USOV,AI,BILAN MI.Fucoidan-sulfated polysaccharides of brown algae [J].Russian Chemical Reviews,2009,78 (8):785-799.
(责任编辑:宋勇刚)
Application of ESI Mass Spectrometry In Structural Analysis of Fucoidan
Hu Pei1,2, Wu Bin2, Li Zhixiong2﹡
(1.The Affiliated Shuguang Hospital of Shanghai University of Traditional Chinese Medicine, Shanghai 201203,China; 2.Shanghai Institute of Materia Medica of Chinese Academy of Sciences, Shanghai 201203,China)
The article review ionization theory of ESI MS, ionization mechanism of ESI in polysaccharide, and the application of ESI mass spectrometry in structural analysis of fucoidan.
Electrospray Ionization Mass Spectrometry; Fucoidan; Structrural Analysis; Review
2014-01-09
国家科技重大专项《重大新药创制》课题资助项目(2012ZX09301001-003)
胡培(1988-),男,上海中医药大学硕士研究生,研究方向为中药药效物质基础。
李志雄(1975-),男,中国科学院上海药物研究所高级工程师,研究方向为中药药效物质基础。
R962
A
1673-2197(2014)09-0046-04

