氟伐他汀对厄贝沙坦药代动力学的影响研究*
周霞瑾,齐惠珍 ,王明霞 ,常 青,马海飞
(1.河北医科大学附属第四医院药剂科,河北 石家庄 050011; 2.河北医科大学药学院,河北 石家庄 050017)
氟伐他汀是临床常用的全合成的降胆固醇药物,大剂量可抑制不稳定型心绞痛患者冠状动脉病变的炎性反应[1],常与降压药厄贝沙坦联用,且与厄贝沙坦都经CYP2C9代谢。有报道氟伐他汀不仅是CYP2C9的底物,当与其他药物联用时,则成为CYP2C9抑制剂[2]。本试验中选择氟伐他汀和厄贝沙坦作为研究药物,拟通过研究氟伐他汀对厄贝沙坦药代动力学参数的影响,探讨经同种酶代谢的药物相互作用的规律,为临床合理用药提供参考。
1 材料与方法
1.1 仪器、试药与动物
Waters高效液相色谱仪,515泵,474荧光检测器,Empower色谱数据工作站;ZH-2型涡旋混合器(天津药典标准仪器厂);800型离心机(上海分析仪器厂);梅特勒AE240型电子分析天平(瑞士);SANYO低温冰箱。替米沙坦标准对照品(美国Sigma-Aidrich公司,批号为Lot No T-8949);厄贝沙坦标准对照品(中国药品生物制品检定所,批号为100607-200301);乙腈为色谱纯,乙醚、二氯甲烷、磷酸为分析纯,试验用水为多效蒸馏水;羧甲基纤维素CMCS(化学纯,天津市光复精细化工研究所,批号为20050815);氟伐他汀片(北京诺华制药有限公司,批号为X0669,规格为每片40mg);厄贝沙坦片(赛诺菲安万特<杭州>制药有限公司,批号为0A020,规格为每片0.15 g)。新西兰大白兔18只,均为雄性,体重2.5~3 kg,购于河北医科大学动物中心,动物合格证号为709198,并通过河北医科大学动物实验伦理委员会批准。
1.2 试验方法
1.2.1 动物处置
每只笼子装1只新西兰大白兔,编号,称重,进入动物室,经1周以上适应性饲养后,随机分为3组,即对照组、氟伐他汀低剂量(10mg /kg)诱导组和氟伐他汀高剂量(50mg /kg)诱导组,每组6只。对照组(A组)灌胃给予2%羧甲基纤维素溶液每只10mL,每日1次,连续3 d,于第4天晨8:00给予厄贝沙坦(50mg/kg)的2%羧甲基纤维素溶液灌胃。氟伐他汀低剂量诱导组(B组)动物前3 d给予氟伐他汀(10mg/kg)的2%羧甲基纤维素溶液灌胃,每日1次,于第4天晨8:00给厄贝沙坦(50mg/kg)的2%羧甲基纤维素溶液灌胃。氟伐他汀高剂量诱导组(C组)动物前3 d给予氟伐他汀(50 mg/kg)的2%羧甲基纤维素溶液灌胃,每日1次,于第4天晨8:00给予厄贝沙坦(50mg/kg)的2%羧甲基纤维素溶液灌胃。所有动物于灌胃厄贝沙坦的前1天晚8:00开始禁食不禁水,厄贝沙坦的给药剂量按人/兔体重的等效剂量换算。
1.2.2 取血方法
预先给动物置留置针,分别于给药前和给药后0.25,0.5,1,1.5,2,3,5,7,9,12,24,36 h 从新西兰大白兔的耳中动脉取血2mL,置肝素管中,以 10000 r/min的速率离心 10 min,取上清液,放入-80℃低温冰箱保存,用于测定厄贝沙坦的浓度。
1.2.3 血浆样品处理[3]
取血浆400μL,置10mL具塞玻璃离心管中,精密加入内标工作液 40 μL(5 μg/mL),涡旋混匀 15 s,加入 100 μL 磷酸溶液(1mol/L),涡旋 30 s,使其酸化,加入乙醚 - 二氯甲烷(7 ∶3)[4]混合液 5mL 提取,涡旋振荡 5 min,离心(1500 r/min)5 min,取有机层4.5mL于洁净干燥具塞玻璃离心管中,加入200μLNaOH溶液(0.05 mol/L),涡旋震荡 3 min,离心 (1500 r/min)5 min,于-80℃低温冰箱中冷冻15min,弃去上层未冻有机相,待下层融化后,用微量取样器取150μL于1mL的Ephendroff管中,加入 100μL 磷酸溶液(0.2mol/L)酸化,涡旋混匀 30 s,进样 50 μL分析。
1.2.4 色谱条件[3]
色谱柱:Diamonsil C18柱(200 mm ×4.6 mn,5μm);流动相:水-乙腈(57∶43),三乙胺0.1%,磷酸调节 pH至3.00;流速:1.0mL/min;柱温:室温;荧光检测波长:激发波长为254 nm,发射波长为 371 nm[5]。内标物:替米沙坦;进样量:50 μL。在该色谱条件下,替米沙坦和厄贝沙坦的保留时间分别为4.2 min和6.0 min,分离效果良好,空白血浆的内源性物质对药物和内标物无干扰。
1.2.5 标准曲线制备[3]
用空白血浆将质量浓度为100μg/mL的厄贝沙坦贮备液配制成质量浓度为 5,2,1,0.5,0.2,0.1,0.05 μg/mL 的系列标准曲线工作液。精密量取替米沙坦内标溶液(5μg/mL)40μL置10 mL具塞玻璃离心管中,分别加入400μL上述系列浓度的标准曲线工作液,按2.3项下方法进行处理,用高效液相色谱(HPLC)-荧光检测法测定,以厄贝沙坦峰面积与内标峰面积的比值(Y)为纵坐标、厄贝沙坦质量浓度(X)为横坐标进行线性回归,得回归方程Y=0.0032+0.192X(r=0.9996)。结果表明,在0.05~5μg/mL质量浓度范围内,厄贝沙坦峰面积与内标峰面积的比值与血浆中厄贝沙坦浓度呈良好线性关系,厄贝沙坦的最低检测限为0.023μg/mL,其日内RSD为3.21%,日间RSD为 4.37%(n=5)。
1.2.6 药代动力学分析
每只新西兰大白兔的血浆厄贝沙坦浓度值均用DASVersion 3.0(Bontz Inc.,北京,中国)药代动力学软件进行智能化数据处理,模拟血药浓度-时间曲线,并计算非房室模型统计矩参数,Cmax和Tmax为实测值。分析采用SPSS 13.0统计软件,计量资料采用,多组比较采用方差分析(ANOVA),P<0.05时再用Dunnett检验,Tmax采用秩和检验,P<0.05为差异有统计学意义。
2 结果
各组的平均血药浓度-时间曲线见图1。各组的血药浓度-时间数据经DAS 3.0软件处理后的非房室模型统计矩参数见表1。经单因素方差分析,与A组比较,氟伐他汀低剂量(10mg/kg)诱导对厄贝沙坦的药代动力学无影响;氟伐他汀高剂量(50mg/kg)诱导,厄贝沙坦的主要药代参数0~36 h药时曲线下面积(AUC0~36),0 ~ ∞ 药时曲线下面积(AUC0~∞),0 ~ ∞ 平均驻留时间(MRT0~∞)虽有变化,但经单因素方差分析均无统计学差异,氟伐他汀高剂量(50mg /kg)诱导组的半衰期 (t1/2)和 0 ~36 h 平均驻留时间(MRT0~36)显著延长(P< 0.05),且表观清除率(CL)显著降低(P<0.05)。
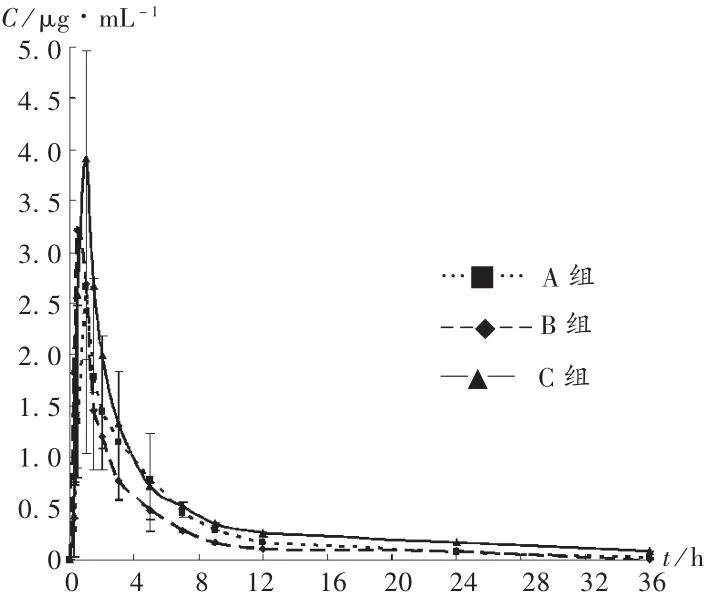
图1 血药浓度-时间曲线
表1 各组口服厄贝沙坦的非房室模型药代动力学参数( ± s,n=6)
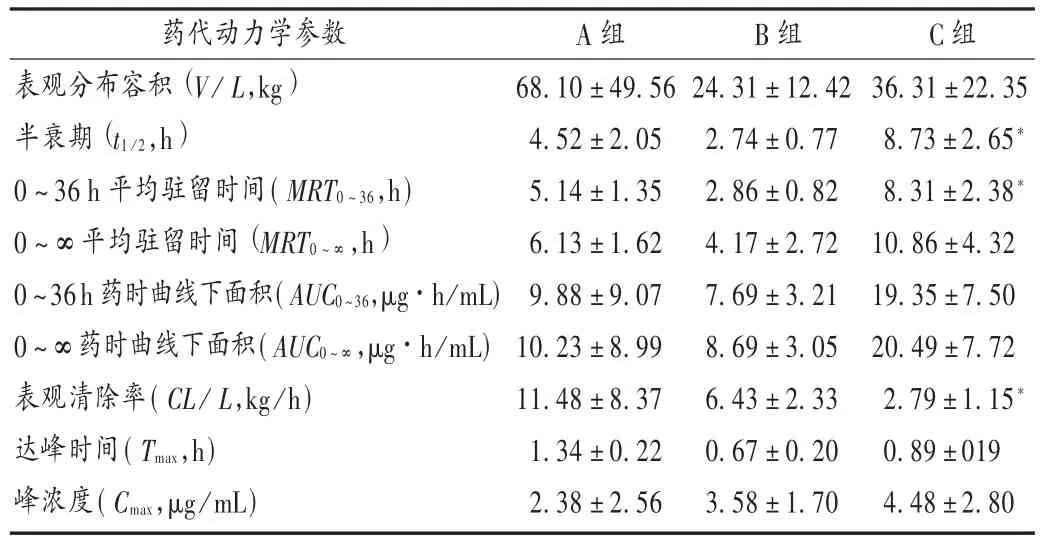
表1 各组口服厄贝沙坦的非房室模型药代动力学参数( ± s,n=6)
注:与 A组比较,*P<0.05。
药代动力学参数表观分布容积(V /L,kg)半衰期(t1/2,h)0 ~ 36 h 平均驻留时间 (MRT0~36,h)0~∞平均驻留时间(MRT0~∞,h)0~36h药时曲线下面积(AUC0~36,μg·h/mL)0 ~∞药时曲线下面积(AUC0~∞,μg·h/mL)表观清除率(CL/L,kg/h)达峰时间(T max,h)峰浓度(C max,μg/mL)A组B组C组68.10±49.564.52±2.055.14±1.356.13±1.629.88±9.0710.23±8.9911.48±8.371.34±0.222.38±2.5624.31±12.422.74±0.772.86±0.824.17±2.727.69±3.218.69±3.056.43±2.330.67±0.203.58±1.7036.31±22.358.73±2.65*8.31±2.38*10.86±4.3219.35±7.5020.49±7.722.79±1.15*0.89±0194.48±2.80
3 讨论
厄贝沙坦不需经生物转化就能发挥药理作用,但有试验证明其确实经 CYP2C9氧化代谢[2]。氟伐他汀是第 1个全合成的HMG-CoA还原酶抑制剂,其消除主要经CYP2C9代谢为N-去异丙基丙酸、5-羟基氟伐他汀和6-羟基氟伐他汀,氟伐他汀还被证明是CYP2C9酶的抑制剂[2]。本试验结果显示,氟伐他汀低剂量(10mg/kg)诱导组对厄贝沙坦的药代动力学无影响,而高剂量(50mg /kg)诱导组显著延长了厄贝沙坦的t1/2(P< 0.05),说明氟伐他汀抑制厄贝沙坦的代谢,且与剂量相关。氟伐他汀属亲水性化合物,且在肠道具有高渗透性,因此口服后在小肠广泛、迅速吸收[2]试验设计氟伐他汀与厄贝沙坦服用时间相差12 h以上故不会对厄贝沙坦的吸收产生影响。P-gp底物唯一的特性是亲脂性,氟伐他汀为亲水性化合物,故推测氟伐他汀不是P-gp底物,也有试验证实氟伐他汀不影响P-gp介导的转运[6-7],氟伐他汀对厄贝沙坦的吸收无影响。故推测氟伐他汀对厄贝沙坦药代动力学的影响与抑制CYP2C9有关。
氟伐他汀的生物利用度很低,源于其首过效应,服用剂量的60% 被 CYP2C9 代谢[2]。Siekmeier 等[8]观察到 10 mg 速释胶囊的绝对生物利用度为(29±18)%。多次口服或单剂量口服剂量超过20mg时,生物利用度增加,峰浓度(Cmax)和AUC均不成比例地明显增加。并认为这一结果可能因为多次口服或增加剂量时,肝脏上的转运体或代谢酶达到了饱和,部分药物逃逸了肝脏首关代谢,导致进入血液循环的药量增加。本试验结果与此研究结果一致,高剂量氟伐他汀影响厄贝沙坦的代谢。与对照组相比,其CL显著降低(P<0.05),这一结果与MRT0~36显著延长一致。考虑CYP2C9酶具有饱和性,氟伐他汀通过竞争性与CYP2C9酶结合而抑制影响厄贝沙坦的代谢。
总之,氟伐他汀高剂量时通过竞争性抑制CYP2C9酶而影响厄贝沙坦的药代动力学,显著延长其t1/2和MRT,并且显著降低其CL。因此,临床上厄贝沙坦与氟伐他汀联用时,尤其氟伐他汀剂量较大时,要进行监测,必要时调整厄贝沙坦的给药间隔。
参考文献:
[1]刘 娟,刘 莹.氟伐他汀对不稳定型心绞痛患者血清C反应蛋白和基质金属蛋白酶的影响[J]. 中国药业,2010,19(5):6 -7.
[2] Scripture CD,Pieper JA.Clinical pharmacokinetics of fluvastatin[J].Clin pharmacokinet,2001,40 (4):263 -281.
[3]周霞瑾,齐惠珍,牛哲哲,等.辛伐他汀对厄贝沙坦药代动力学影响的研究[J]. 中国药理学通报,2012,28(5):701 -704
[4]Shakya AK,Al-Hiari YM,Alhamami OM.Liquid chromatographic determination of irbesartan in human plasma[J].JChromatogr BAnalyt Technol Biomed Life Sci,2007,848(2):245.
[5]Gonzalez L,Lopez JA,Alonso RM,etal.Fast screeningmethod for the determination of angiotensin receptor antagonists in human plasma by highperformance liquid chromatography with fluorimetric detection[J].JChromatogr A,2002,949(1 - 2):49 - 60.
[6]Bogman K,Peyer A,Torok M,etal.HMG-CoA reductase inhibitorsand P -glycoproteinmodulation[J].Br JPharmacol,2001,132(6):1183 - 1192.
[7]Sakaeda T,Fujino H,Komoto C,et al.Effects of acid and lactone forms of eight HMG-CoA reductase inhibitors on CYP-mediatedmetabolism and MDR1 - mediated transport[J].Pharm Res,2006,23(3):506 - 512.
[8]Siekmeier R,Lattke P,Mix C,et al.Dose dependency of fluvastatin pharmacokinetics in serum determined by reversed phase HPLC[J].Cardiovasc Pharmacol Ther,2001,6(2):137 - 145.

