琼脂包裹纳米零价铁的制备及处理废水中Cu(Ⅱ)试验研究
樊文井,成 岳,余淑贞,范小丰,陈文庆
(景德镇陶瓷学院材料科学与工程学院,江西 景德镇 333403)
琼脂包裹纳米零价铁的制备及处理废水中Cu(Ⅱ)试验研究
樊文井,成 岳,余淑贞,范小丰,陈文庆
(景德镇陶瓷学院材料科学与工程学院,江西 景德镇 333403)
以琼脂(Agar)为包裹剂,采用流变相法制备琼脂包裹纳米零价铁(Agar-Fe0),并用XRD、SEM和TEM、氮气吸附-脱附手段对样品进行表征。考察了Agar-Fe0投加量、Cu(II)浓度、pH对模拟废水中铜的去除效果的影响。结果表明:在Cu(II)废水浓度为10 mg/L,pH=8,Agar-Fe0投加量为0.3 g/L去除效果最好,去除率达99.87% 。
Agar-Fe0;Cu(II);去除率;反应动力学
0 引 言
含铜废水主要源于金属冶炼、矿山开采、机械制造、电镀行业等的废水排放。此外,冶炼气通过降水也会进入地表径流成为含铜废水的来源。虽然铜是生命必需的微量元素之一,然而过量接触铜对有机体有害[1-3],过度摄入铜会导致严重的中毒,呕吐,痉挛,抽搐,甚至死亡[4]。
目前,含铜废水的传统处理方法主要有:电解法、离子交换法、化学沉淀法、反渗透法、吸附法等[5,6]。在众多含铜废水的处理方法中,寻求一个操作简单,成本低,满足排放标准,同时还能避免对环境造成二次污染的方法势在必行。
纳米零价铁被广泛用于含含氮有机物、氯代有机物、重金属等污染物的修复[7]。由于其具有比表面积大和还原能力强的特点,已成为修复重金属污染的高效方法[8]。
本实验以硼氢化钾和七水合硫酸亚铁为原料,琼脂为包裹剂,采用流变相法制备包裹型Agar-Fe0,对其去除水中Cu2+的影响因素、反应机制、反应动力学等进行探讨。
1 材料与方法
1.1 Agar-Fe0材料的制备
配制0.06 g/mL的琼脂(AR,北京康普汇维科技有限公司)水溶液作为液体介质,称取1.6182 g硼氢化钾(KBH4,国药集团化学试剂有限公司)和4.1703 g七水合硫酸亚铁(FeSO4·7H2O,上海久亿化学试剂有限公司)于玛瑙研钵中研磨10 min作为固体介质,然后将两者调配成流变相体系,体系中反应如下:
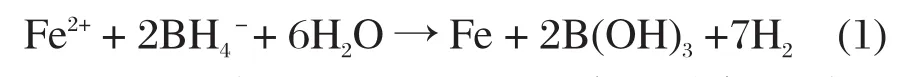
室温下反应2 h后,再用磁选法进行固液分离,将得到的黑色固体用无水乙醇(上海久亿化学试剂有限公司)和去离子水洗涤数次,然后真空烘干,即得包裹型Agar-Fe0材料。
1.2 样品表征
采用德国Bruker公司D8-Advance型XRD衍射仪以Kα为辐射源,Cu为靶,管电流为100 mA,管电压为40 kV,扫描步长0.2°/s,扫描范围10~70°,测试样品物相;采用日本JEOL公司JSM-6700F型扫描电镜(SEM)观察样品表面形貌,JEM-2010(HR)型电子透射电镜(TEM)观察样品显微结构。氮气吸附-脱附等温线在等温吸附仪MieromeriticSASAP2000上测得,比表面积按照Barrett-Emmett-Teller(BET)模型计算。
1.3 包裹型纳米零价铁去除Cu(Ⅱ)的试验
用五水硫酸铜(CuSO4·5H2O, 分析纯,上海展云化工有限公司)配置一定浓度Cu2+储备液,根据需要用去离子水逐级稀释。取100 ml稀释后溶液于250 mL具塞锥形瓶中,调节pH,加入一定量Agar-Fe0,放于振荡器中在室温常压下震荡(200 r/min)。间隔一定时间取样,水样经 0.22 μm滤膜过滤后,取适当滤液。采用分光光度法,用二乙基二硫代氨基甲酸钠(DDTC)测定水中铜的含量[9]。原理:在氨性溶液中(pH为9-10),铜与二乙胺基二硫代甲酸钠作用,生成摩尔比为1:2的黄棕色络合物,该络合物可被四氯化碳萃取,其最大的吸收波长为440 nm。
按下式计算铜的去除率:
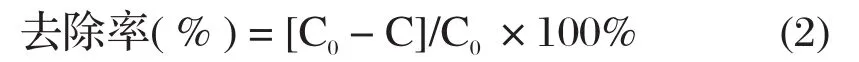
式中,C0为初始废水中铜的浓度, mg/L,C为处理后铜的浓度, mg/L。
2 结果分析与讨论
2.1 XRD、SEM和TEM分析
图1为Agar-Fe0的XRD图谱。从铁的标准衍射图样可知,2θ为44.67 °和65.3 °衍射峰代表了体心立方晶格(bcc)铁的(110)面及(200)面[10]。由图1可见,在2θ=44.8°和65.3 °处附近都出现了衍射峰,与标准的体心立方晶格(bcc)铁的衍射锋位置正好相吻合。另外,图谱中没有其他的杂峰出现,表明利用流变相法所制备的物质没被氧化或者氧化程度极低。
从图2可以得知,Agar-Fe0颗粒为球状,平均粒径较大,约为60-120 nm,呈高度分散状态。也可以观察到纳米铁颗粒表面有网状的物质覆盖在表面,这层物质是Agar。因为Agar是一种大分子物质,在纳米铁制备过程中,会在纳米颗粒表面形成一层保护膜,防止铁表面的高活性位点与周围介质发生反应,并较好地克服了纳米粒子的表面效应、小尺寸效应、近距离效应和表面电子效应所产生的团聚,使得纳米铁的分散性得到了提高[11]。
图3显示了Agar-Fe0粒子的核壳结构,外层的壳状结构是分散剂Agar,球状颗粒的中心是Fe0,形成这种结构的原因是大分子物质Agar包覆在了纳米Fe0颗粒的表面。从图片中可清晰地看出,纳米粒子呈球形或椭球形,平均粒径约为50-100 nm。高友良[12]以PVP作为还原剂和稳定剂,合成了稳定性能良好的银纳米溶胶。Sun[13]等利用PV3A作分散剂制成的纳米铁颗粒也呈现这种核壳结构,能以均匀的悬浮状态存在六个月以上。

图1 Agar-Fe0的XRD图谱Fig.1 The XRD pattern of Agar-Fe0

图2 Agar-Fe0的SEM图谱Fig.2 The SEM image of Agar-Fe0
2.2 氮气吸附-脱附实验
从图4可以看出Agar-Fe0的吸附脱附曲线有HI型回滞环,并具有典型的Ⅳ型特征[13],证明Agar-Fe0具有一维柱状介孔孔道构。在相对压力0.8<ps/ p0<1.0之间,等温线有明显凹陷,这是由于氮气分子在介孔孔道里的毛细管凝聚产生的,说明材料的孔道结构规整。普通的铁粉(粒径<l0 μm)的比表面积仅为0.9 m2/g[15],而所制备的Agar-Fe0的比表面积14.0717 m2/g,Agar-Fe0的比表面积可以达到普通铁粉的15倍,决定了其具有更高的反应活性。
2.3 投加量的影响

图3 Agar-Fe0的TEM图谱Fig.3 The TEM image of Agar-Fe0
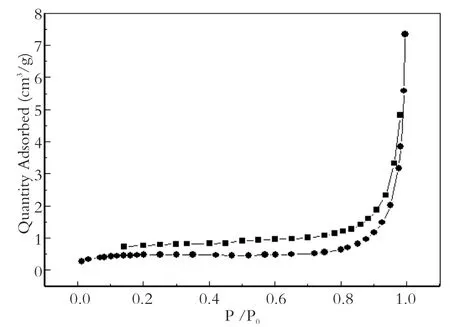
图4 Agar-Fe0氮气吸附-脱附等温线Fig.4 Nitrogen isothermal adsorption-stripping of Agar-Fe0
为研究Agar-Fe0去除水中Cu2+时的最佳使用量,在温度为25 ℃,溶液的pH值为7,Cu2+的初始浓度为10 mg/L,反应3 h,考察了Agar-Fe0的投加量为 0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、 0.9、1.0 g/L。实验结果如图5所示。随投加量增大,去除率也增加。投加量为 0.1 g/L时,溶液中Cu2+的去除率仅为85.19%,而投加量为0.3 g/L时溶液中Cu2+的去除率已达到95.56%。这是因为增大Agar-Fe0浓度,相应增加反应的活性位点,有助于还原反应的进行。继续增加Agar-Fe0的用量,效果变化不明显。说明对于一定浓度的Cu2+溶液来说,存在一个最佳投加量,超过这个值对Cu2+的去除意义不大。
2.4 初始浓度的影响
Cu2+初始浓度的不同也会对反应物之间的接触产生影响,从而影响反应效果。为了研究初始浓度对Agar-Fe0还原去除溶液中Cu2+反应的影响,在温度 25 ℃,pH值7,Agar-Fe0投加量0.3 g/L的条件下,使得溶液的初始浓度分别为5、10、20、30、40、50 mg/L,反应3 h,结果如图6所示。Agar-Fe0对Cu2+的去除率随初始浓度的增大而减小。初始浓度为5.0 mg/L时去除率为99.39%,当初始浓度增大到50.0 mg/L时去除率降低为16.72%。初始浓度对Cu2+的去除影响极为显著。
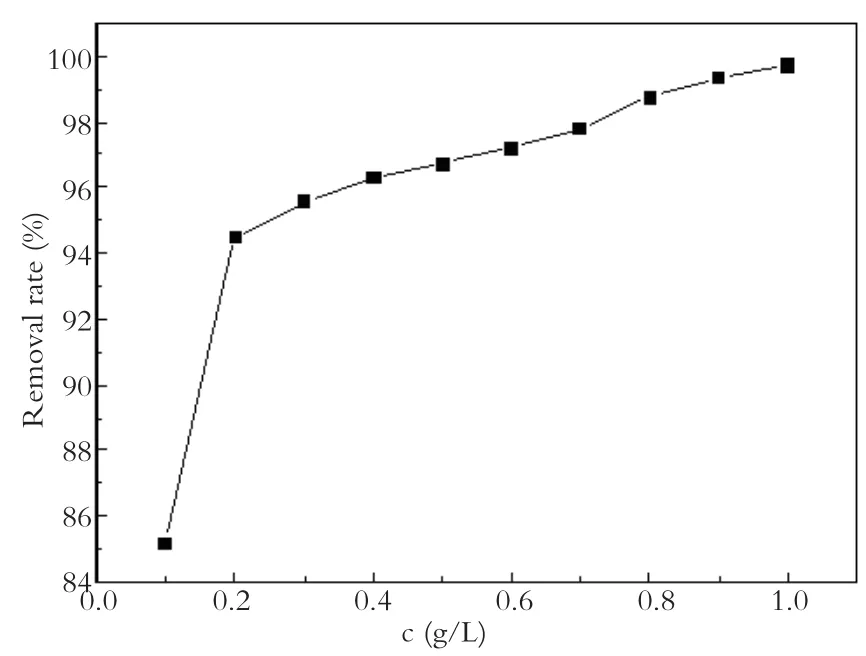
图5 Agar-Fe0加入量对去除率的影响Fig.5 Effect of Agar-Fe0amount on removal effciency
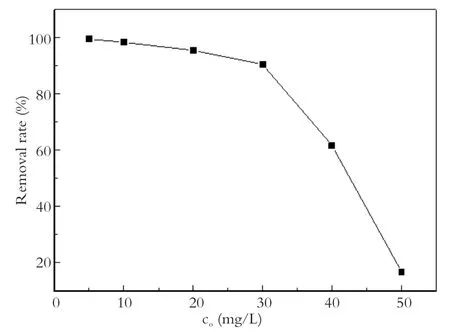
图6 初始浓度对去除率的影响Fig.6 Effect of initial concentration on removal effciency
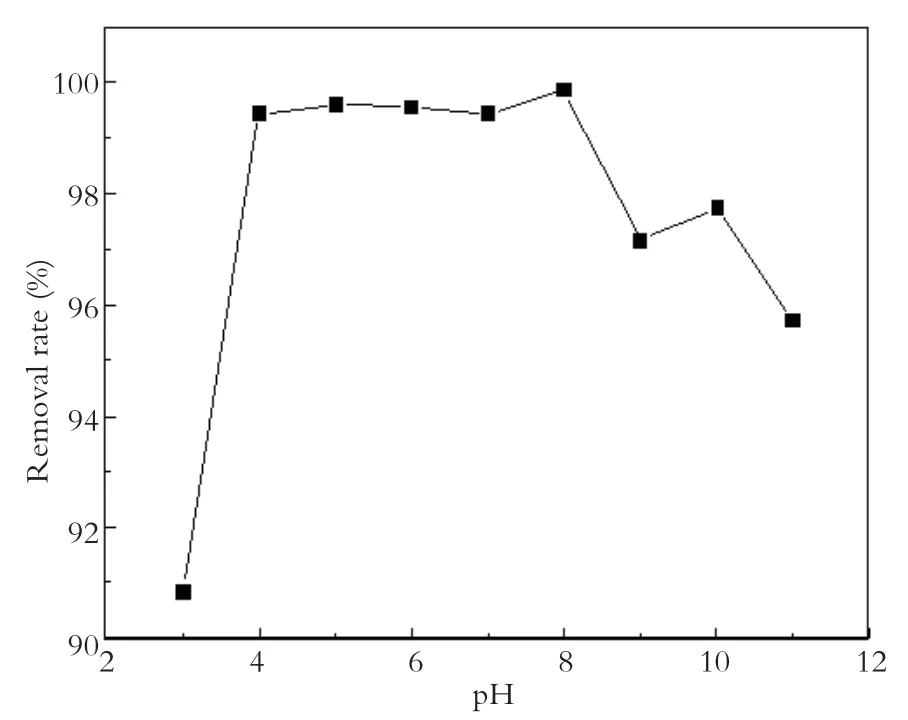
图7 pH值对去除率的影响Fig.7 Effect of pH on removal effciency
2.5 pH值的影响
考察反应初始pH值对Cu2+去除的影响,选择初始 pH 值分别为 3、4、5、6、7、8、9、10和11进行比较研究。条件设置为温度25 ℃、Cu2+初始浓度10 mg/L、Agar-Fe0用量均为0.3 g/L,反应3 h,实验结果如图7所示。本实验中Cu2+的去除率强烈依赖于体系pH值。初始pH为3时,去除率为90.83%;而初始pH为4,5,6,7,8时去除率分别为99.45%、99.61%、99.55%、99.45%、99.87%,之后随初始pH上升至9,去除率下降到97.16%。
2.6 Agar-Fe0去除Cu(II)的反应机理
Agar-Fe0去除Cu(II) 的反应中,溶液中纳米颗粒均匀的分散,其表面的包裹剂经过一段时间开始溶解,其中Fe0慢慢的暴露出来,一部分同水和其中的溶解氧发生反应,过程如下:

由于Agar-Fe0比表面积较大,对Cu(II) 具有较强的吸附能力,另一部分Agar-Fe0就将溶液中的Cu(II) 吸附表面,发生氧化还原反应,反应过程如下[16]:
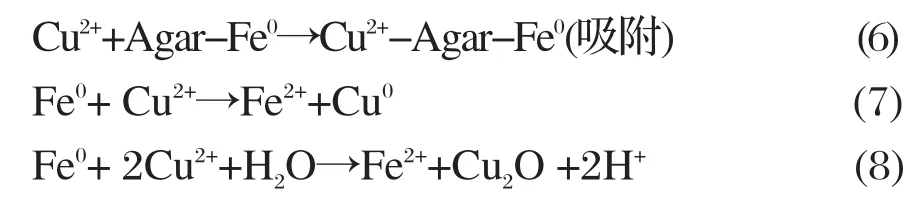
首先生成 Fe2+,但水溶液中 Fe2+被迅速氧化为 Fe3+,Fe3+继续与水溶液中H2O或OH-反应,生成Fe(OH)3。Duygu Karabelli等[17]证实了纳米零价铁能快速去除初始浓度200 mg/L的Cu2+,且1 g纳米铁能吸收250 mgCu2+,反应后Cu2+还原为Cu2O和Cu,同时Fe转化为铁的氧化物。
3 结 论
(1)Agar-Fe0材料表征结果显示:Agar-Fe0颗粒粒径约为60-120 nm,分布均匀,分散性较好,没发生团聚现象,且具有一定的抗氧化性能。包裹后粒子呈现出核壳结构,未发现团聚成堆或者呈链状粒子。
(2)Agar-Fe0具有很好的反应活性,能有效地去除水中Cu(II)。在温度25 ℃,溶液pH为8,初始浓度为10 mg/L,Agar-Fe0投加量为0.3 g/L,反应3 h时去除效果最好,去除率达99.87%。
(3)Agar-Fe0与Cu(II)反应以Fe0对Cu2+的还原作用为主,也具有吸附作用。
[1] BARAKAT M A. New trends in removing heavy metals from industrial wastewater. Arabian Journal of Chemistry,2011, 4(4): 361-377.
[2] 李姣. 化学沉淀法处理电镀废水的实验研究[D]. 湖南: 湖南大学, 2010, 4~5.
[3] AHMARUZZAMAN M. Industrial wastes as low-cost potential adsorbents for the treatment of wastewater laden with heavy metals. Advances in Colloid and Interface Science, 2011, 166(1-2): 36-59 .
[4]FU Fenglian, WANG Qi. Removal of heavy metal ions from wastewaters: A review. Journal of Environmental Management, 2011, 92(3): 407~418..
[5] RENGARAJ S, YEON J W, KIM Y H. Adsorption characteristics of Cu(II) onto ion exchange resins 252H and 1500H:Kinetics,isotherms and error analysis. Journal of Hazardous Materials, 2007, 143(1-2): 469-447..
[6] HASHIM M A, et al. Remediation technologies for heavy metal contaminated groundwater. Journal of Environmental Management, 2011, 92(10): 2355-2388.
[7] 董婷婷. CMC稳定化纳米Pd/Fe还原去除对硝基苯研究[D]. 广州: 华南理工大学, 2011, 8~9.
[8] Pengpeng Huang , Zhengfang Ye , Wuming Xie , Qi Chen. Jing Li ,Zhencheng Xu, Maosheng Yao. Rapid magnetic removal of aqueous heavy metals and their relevant mechanisms using nanoscale zero valent iron (nZVI) particles[J].Water Research.2013,47(12):4050-4058.
[9] 曲玉超. 改性火山渣陶粒去除废水中Cu2+/Ni2+离子的研究[D].长春: 长春工业大学, 2012, 13~14.
[10] 胡恒. 老化纳米铁去除地下水中六价铬和三氯乙烯的研究[D]. 北京: 中国地质大学, 2013, 25~26.
[11] 焦创. 流变相法制备包裹型纳米零价铁及处理重金属废水的研究[D]. 景德镇: 景德镇陶瓷学院, 2013, 19~21.
[12] 高友良. 银纳米粒子的绿色合成及其SERS性能和应用研究[J]. 陶瓷学报, 2014, 35(3): 277-280.
GAO Youliang. Journal of Ceramics, 2014, 35(3): 277-280.
[13] 徐莹璞, 王 宇, 曲凤玉, 等. 纳米介孔分子筛球作为难溶性药物长效缓释的研究[J]. 陶瓷学报, 2010, 31(1): 5-10.
XU Yingpu, et al. Journal of Ceramics, 2010, 31(1): 5-10.
[14] 朱晔. NZVI/SBA-15复合材料的合成及其对水中硝基苯去除机理研究[D]. 南京: 南京理工大学, 2012, 14-15.
[15] 许淑媛. 不同材料负载纳米零价铁去除水/土中挥发性氯代烃的实验研究[D]. 北京: 轻工业环境保护研究所, 2012, 38.
[16] SHI Lina, ZHOU Yan, CHEN Zuliang, et al. Simultaneous adsorption and degradation of Zn2+and Cu2+from wastewaters using nanoscale zero-valent iron impregnated with clays. Environmental Science and Pollution Research, 2013, 20(6): 3639-3648.
[17] KARABELLI D, UZUM C, SHAHWAN T, et al. Batch removal of aqueous Cu2+ions using nanoparticles of zerovalent iron: A study of the capacity and mechanism of uptake. Ind. Eng. Chem. Res., 2008, 47(14): 4758-4764.
Synthesis of Agar-wrapped Nanoscale Zero-valent Iron Particles and Removal of Cu(Ⅱ) in Wastewater
FAN Wenjing, CHENG Yue, YU Shuzhen, FAN Xiaofeng, CHEN Wenqing
(Jingdezhen Ceramic Institute of Materials Science, Jingdezhen 333403, Jiangxi, China)
The wrapped nanoscale zero-valent iron (Agar-Fe0) is synthesized by using rheological phase reaction method with agar as coating agent. The sample is characterized by means of XRD, SEM, TEM and N2adsorption-stripping. The effect of Agar-Fe0dosage, initial Cu(II) concentration and pH values on removal rate of Cu(II) in simulated wastewater are studied. The experimental results indicate that the best removal rate of Cu(II) is 99.87% when the initial Cu(II) concentration is 10 mg/L, the pH value is 8, the Agar-Fe0dosage is 0.3 g/L.
Agar-Fe0, Cu(II),removal rate, reaction kinetic
TQ174.75
A
1000-2278(2014)06-0608-05
10.13957/j.cnki.tcxb.2014.06.009
2014-05-08。
2014-06-09。
国家自然科学基金项目(编号:51268018);景德镇市科技局项目;景德镇陶瓷学院研究生创新基金项目。
成岳(1963-),男,博士,教授。
Received date: 2014-05-08. Revised date: 2014-06-09.
Correspondent author:CHENG Yue(1963-), male, Doc., Professor.
E-mail:cy_jci@163.com

