扛板归及苦菜黄酮类物质超声波提取工艺优化及其抗氧化活性
李 伟
(1.湖北民族学院 生物科学与技术学院,湖北 恩施 445000;2.湖北民族学院 湖北省生物资源保护与利用重点实验室,湖北 恩施 445000)
扛板归(Polygonum perfoliatum L.)又名河白草、地葡萄,分布于全国各地,生长在山野、路旁、荒地或河岸的草丛、灌丛中,资源丰富[1]。扛板归的化学成分主要有黄酮苷、蒽苷、强心苷、酚类、鞣质等,据《中药大辞典》记载,扛板归以其根和地上部全草入药,具有利水消肿、清热活血、解毒等功效[2-4]。目前多以全草药效进行研究,对其所含黄酮成分的药用和食用价值的开发利用尚未见报道。苦菜(Sonchus oleraceus L.)在我国很早就被当作一种野菜食用,属无毒害纯天然绿色食品,具有很高的营养价值和明显的抗氧化作用[5-6]。由于利用超声波产生的强烈振动、高的加速度、强烈的空化效应、搅拌作用等,可加速植物材料中的有效成分进入溶剂从而增加有效成分的提取率,缩短提取时间,并且可避免高温对提取成分的影响[7-9]。本研究主要以扛板归为原料,采用超声波对其黄酮提取工艺进行优化,并用优化的工艺浸提苦菜黄酮,而后对比2种原料黄酮的体外抗氧化作用,以期为扛板归和苦菜资源的开发利用提供新的信息资料。
1 材料与方法
1.1 材料与试剂
扛板归全草、苦菜全草:采于湖北民族学院,洗净、烘干、粉碎过80目筛备用。
芦丁(纯度≥95%):西安艾沃生物科技有限公司;1,10邻菲罗啉(邻二氮菲)(分析纯):沈阳市新光化工厂;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、硫酸亚铁、石油醚、过氧化氢、水杨酸(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
722S可见分光光度计:上海精密科学仪器有限公司;RE-5220旋转蒸发器:上海亚荣生化仪器厂;HH-8电子恒温水浴锅:深圳国华仪器厂;FA2104电子天平:上海天平仪器厂;800B离心机:上海安亭仪学仪器厂。
1.3 实验方法
1.3.1 黄酮含量测定方法
NaNO2-Al(NO3)3-NaOH比色法[10-11]。
以芦丁作为标准品;以芦丁的质量C(mg)为横坐标,以吸光度值A510nm为纵坐标绘制标准曲线,标准曲线方程为A510nm=0.007 5+1.235 2C,r=0.999 6。样品中黄酮含量计算式:
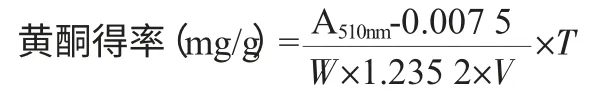
式中:T 为供试液总体积,mL;V 为测定时吸取的样品体积,mL;W 为样品质量,g;A 为510nm 波长下测定吸光度值。
1.3.2 扛板归黄酮的提取工艺优化
首先对乙醇体积分数、超声波时间、料液比进行单因素试验,而后采用L9(33)正交设计,对其提取条件进行优化。
1.3.3 黄酮对羟自由基的清除作用
黄酮在水杨酸体系中对羟自由基的清除作用:参照莫开菊等[12-13]的试验方法进行测定,利用H2O2与Fe2+混合产生·OH,在体系内加入水杨酸捕捉·OH并产生有色物质,该物质在波长510nm处有最大吸收。反应体系中含6mmol/L H2O2溶液、1.5mmol/L FeSO4溶液、10mmol/L水杨酸-乙醇1mL、不同质量浓度的样品溶液1mL。最后加H2O2启动反应,37℃反应0.5h。试剂的加入情况见表1。
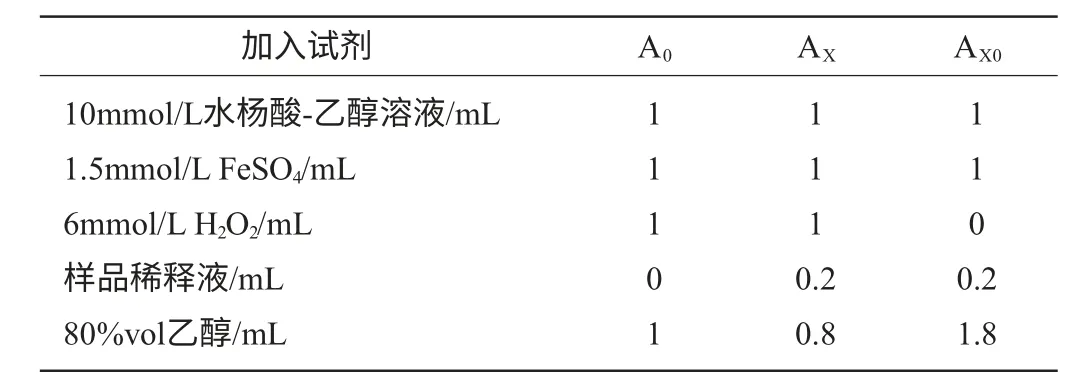
表1 水杨酸体系中加入试剂的方法Table 1 Method of adding reagents in the salicylic acid system
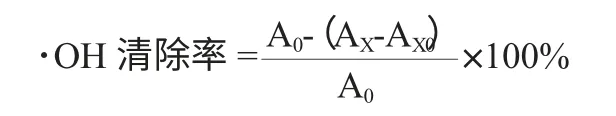
式中:A0为空白溶液吸光度值;AX为加入样品后的体系吸光度值;AX0为样品本底吸光度值。
黄酮在邻二氮菲体系中对羟自由基的清除作用:参照金鸣等[14]的方法进行测定。Fe2+/H2O2体系产生·OH自由基,由于·OH可特异地使邻二氮菲-Fe2+转化为邻二氮菲-Fe3+,从而使红色褪色,根据反应后体系的褪色程度,可衡量·OH的量。
体系含有0.75mmol/L邻二氮菲无水乙醇溶液1mL,2mL 0.2mol/L磷酸缓冲液(pH7.4)2mL,0.75mmol/L硫酸亚铁1mL,样品溶液0.2mL,混匀后加1mL 0.01%的双氧水,37℃水浴加热60min后,在波长536nm处测定吸光度值。分组及各试剂加入方法见表2。
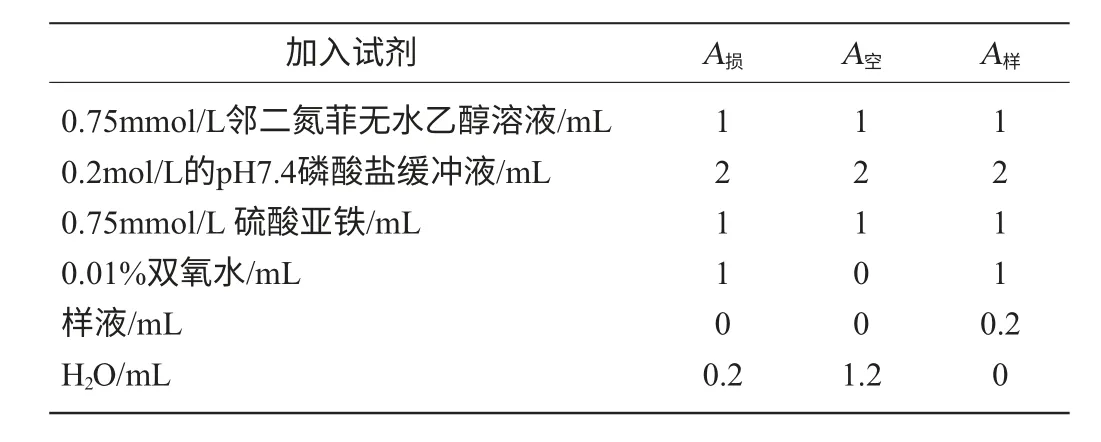
表2 在邻二氮菲体系内各试剂加入方法Table 2 Method of adding reagent in the phenanthroline system
2 结果分析
2.1 扛板归黄酮化合物的提取工艺优化
2.1.1 乙醇体积分数对扛板归黄酮得率的影响
准确称取0.5g脱脂扛板归干粉,以1∶30料液比,分别加入体积分数40%、50%、60%、70%、80%、90%、95%的乙醇,超声波提取30min,浸提结果见图1。
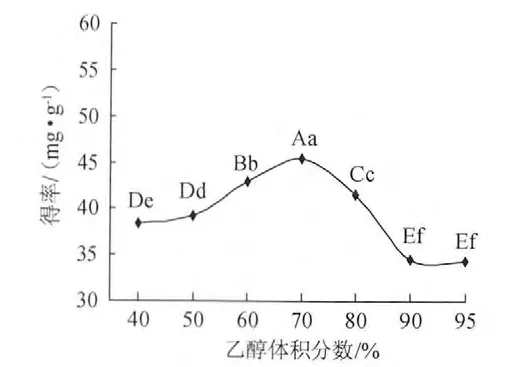
图1 乙醇体积分数对黄酮得率的影响Fig.1 Effect of ethanol volume fraction on flavonoids yield
由图1可以看出,随乙醇体积分数增加黄酮得率增加,当乙醇体积分数超过70%时黄酮得率反而下降,采用极差法分析[15]乙醇体积分数对扛板归黄酮得率的影响,乙醇体积分数70%时的黄酮得率与其他水平的得率相比,差异都极显著。因此选择最佳乙醇体积分数为70%。
2.1.2 超声时间对扛板归黄酮得率的影响
准确称取0.5g脱脂扛板归粉末,采用体积分数70%的乙醇,料液比1∶50超声波处理10min、20min、30min、40min、50min、60min,黄酮浸提结果见图2。在10~40min内随超声处理时间增加,黄酮得率增加,超过40min后,黄酮得率反而逐渐减少,可能是因此超声波在处理过程中具有一定的热效应,长时间的超声波处理使已经浸提出来的黄酮被氧化从而导致含量下降,因比选择40min为最佳超声时间。
2.1.3 料液比对扛板归黄酮得率的影响
准确称取0.5g脱脂扛板归粉末,用体积分数70%的乙醇,分别以1∶30、1∶40、1∶50、1∶60、1∶70料液比超声波处理40min,黄酮浸提结果见图3。图3结果表明,料液比越大,黄酮得率越高,但从1∶50开始,增加幅度趋于缓和,采用极差法分析在0.01水平1∶50、1∶60、1∶70料液比对扛板归黄酮得率的影响差异不显著,考虑到产业化和环境问题,选择1∶50为最佳料液比。
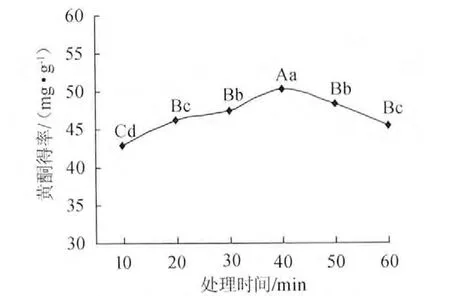
图2 超声波处理时间对黄酮得率的影响Fig.2 Effect of ultrasonic time on flavonoids yield

图3 料液比对黄酮得率的影响Fig.3 Effect of liquid to solid ratio on flavonoids yield
2.1.4 扛板归黄酮提取工艺优化的正交试验
扛板归黄酮提取工艺优化的正交试验结果如表3。

表3 黄酮提取的正交试验结果与分析Table 3 Results and analysis of orthogonal experiment for optimization of flavonoids extraction
采用SPSS17.0软件对表3试验数据进行方差分析[20],结果见表4。
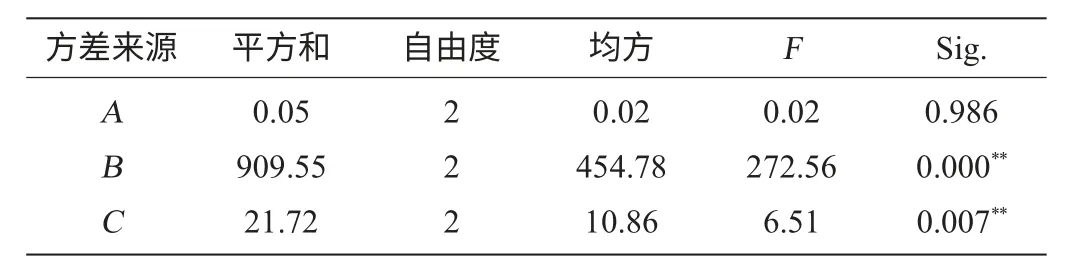
表4 正交试验方差分析表Table 4 Variance analysis of orthogonal experiment for optimization of flavonoids extraction
由表3、表4可得出超声波提取黄酮化合物的最佳工艺是A3B1C3,影响其得率的主次因素是B>C>A,即乙醇体积分数最为显著,其次是超声时间和料液比。各因素水平的分析(见表3、表4)说明A因素的各个水平间差异并不显著,B因素的3水平间差异非常显著,C因素的1、2水平差异不明显,2、3水平差异较大。按照试验得出的最佳提取条件组合是A3B1C3,同时由于A因素对得率影响很小,选择A1水平比A3水平节约成本,可获得更好的效益。分别以A1B1C3和A3B1C3做验证试验,得出苦菜黄酮的得率分别为70.77mg/g和71.18mg/g,二者差异不显著。在此条件下可得到苦菜黄酮得率为18.54mg/g。
2.2 扛板归黄酮对自由基的清除作用
2.2.1 扛板归黄酮在水杨酸体系中对羟自由基的清除作用
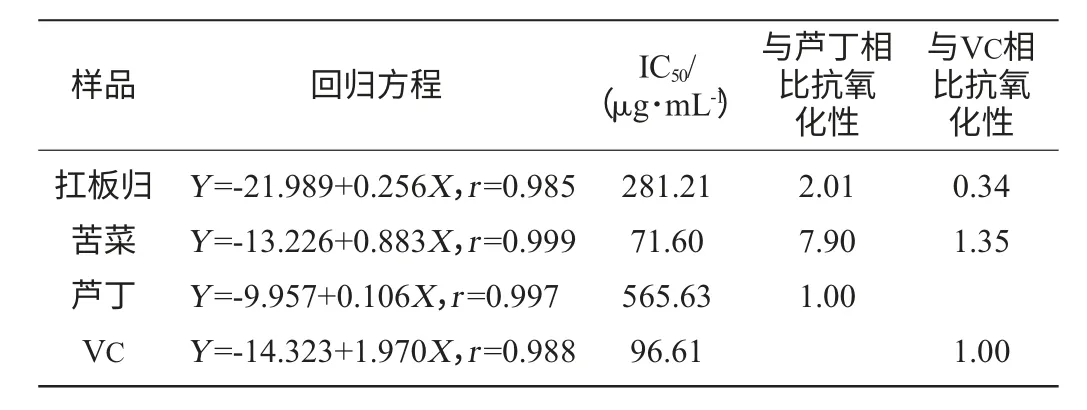
表5 黄酮类物质在水杨酸体系对羟基自由基清除作用Table 5 The scavenging activity of flavonoids on·OH in salicylic acid system
由表5可在,在水杨酸体系,扛板归黄酮对·OH的清除作用弱于苦菜黄酮,同时扛板归黄酮对·OH的清除作用强于芦丁弱于VC;苦菜黄酮对·OH清除作用约是芦丁的8倍,与VC效果相比,略高于VC。
2.2.2 扛板归黄酮在邻二氮菲体系中对羟自由基的清除作用

表6 黄酮类物质在邻二氮菲体系对羟基自由基清除用Table 6 The scavenging activity of flavonoids on·OH in phenanthroline system
由表6可知,在邻二氮菲体系,苦菜黄酮对·OH的清除作用略弱于芦丁和VC,大约是VC和芦丁活性的0.95~0.98倍左右。扛板归黄酮对·OH的清除作用强于苦菜黄酮的,约是芦丁和VC活性的2.5倍左右。
3 结论
利用超声波浸提扛板归和苦菜黄酮,通过单因素和正交试验分析,优化出扛板归黄酮超声波浸提的最佳条件为1∶50料液比,体积分数65%的乙醇,进行超声波提取50min,在此条件下,扛板归黄酮得率为70.77mg/g,苦菜黄酮得率为18.54mg/g。2种原料黄酮对在不同体系中对·OH的清除效果不同,总的来说在水杨酸体系中苦菜黄酮对·OH的清除效果强于扛板归黄酮,在邻二氮菲体系正好相反,具体原因还有待于进一步探索。
[1]赵海英,卢兆成,金开美,等.信阳毛尖茶区恶性杂草——扛板归的生物学特性及防除措施[J].广东农业科学,2007(11):65-67.
[2]蒋益花,蒋新龙.扛板归红色素的提取及稳定性研究[J].中国食品添加剂,2005(6):16-20.
[3]江苏新医学院.中药大辞典(上册)[M].上海:上海科学技术出版社,2000.
[4]章永红.抗癌中药大全[M].南京:江苏科学技术出版社,2000.
[5]韩阳阳,王天晓,朱海芳,等.苦菜不同部位提取物的抗氧化活性[J].食品科学,2010,31(19):45-48.
[6]周劝娥,田呈瑞,关 为,等.陕西苦菜叶总黄酮的提取及抗氧化活性的测定[J].食品工业科技,2013,34(9):97-102.
[7]谢明杰,宋 明,邹翠霞,等.超声波提取大豆异黄酮[J].大豆科学,2004,23(1):75-76.
[8]纪学芳,徐怀德,张淑娟,等.响应面试验优化超声波提取光皮木瓜黄酮和多糖复合物[J].食品科学,2013,23(6):47-51.
[9]乔 孟,屈晓清,丁之恩.响应面法优化超声波辅助提取湖北海棠叶中总黄酮工艺[J].食品科学,2013,34(2):143-147.
[10]周存山,余筱洁,杨虎清,等.油梨皮黄酮提取及大孔树脂纯化[J].农业工程学报,2008,24(8):271-274.
[11]李 涛,赵 云,陈增洁.龙眼核黄酮的微波提取工艺[J].食品研究与开发,2013,34(2):37-39.
[12]莫开菊,柳 圣,程 超.生姜黄酮的抗氧化活性研究[J].食品科学,2006,27(9):110-114.
[13]程 超.麦冬果实蓝色素的抗氧化特性研究[J].中国酿造,2009,28(4):58-60
[14]金 鸣,蔡亚欣,李金荣,等.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-555.
[15]王 颉.试验设计与SPSS 应用[M].北京:化学工业出版社,2006.

