绍兴黄酒熟麦曲制曲过程的宏蛋白质组学研究
张 波,余培斌,陆 健*
(1.浙江经贸职业技术学院,浙江 杭州 310018;2.江南大学 粮食发酵工艺及技术国家工程实验室,江苏 无锡 214122)
麦曲在黄酒酿造中占有极重要的地位,不仅是糖化发酵的粗酶制剂,而且其代谢产物能赋予黄酒特定的风味与口感,因此麦曲又有“酒之骨”的美誉[1]。20世纪60年代起,为适应黄酒现代化生产需要,在对传统生麦曲的继承和发展的基础上,开始推广应用熟麦曲。熟麦曲是将小麦蒸熟后,杀死原料中的微生物,接种纯种米曲霉进行培养[2-3]。生产出的麦曲具有加快黄酒发酵、提高原料利用率,防止醪液酸败和减少用曲量等优点[3]。
熟麦曲的制曲过程是在米曲霉的参与,在一定空气和温湿度调节的条件下,发生一系列生物化学变化的过程。通过对米曲霉生理活动的观察,一般将熟麦曲的制曲过程分为4个时期:孢子萌芽期(接种后最初6~8h,孢子开始吸水膨胀),菌丝生长期(接种后12~20h,菌丝迅速延长),菌丝繁殖期(菌体的生长繁殖进入旺盛时期,菌丝大量生长),孢子着生期(米曲霉的生命活动停滞,开始着生分生孢子)。由于麦曲品温和水分含量的变化,不同时期麦曲中微生物生长情况不同,所参与的反应以及产酶情况也有所不同[2-4]。
目前对黄酒麦曲制曲过程的研究,一般多是通过对酶活力的测定来研究制曲过程中主要水解酶系的活力变化,其操作步骤繁琐,准确度不高,并且对于这些同功酶的构成及其来源等往往不能进行全面而有效的分析[5-6]。本研究利用宏蛋白质组学的理论和方法,将麦曲样品浸提液中所有可溶性蛋白定义为待研究的“宏蛋白质组”,对麦曲制曲过程中的宏蛋白质组动态变化情况进行分析,有利于进一步了解麦曲发酵过程中主要水解酶系的变化,为制曲工艺的控制和改良提供参考依据。
1 材料与方法
1.1 材料与试剂
2012年3月,在绍兴某黄酒厂制曲车间跟踪三批熟麦曲在制曲过程中的温度和湿度变化,分别取8h、20h、32h和44h的产品作为熟麦曲制曲过程中4个典型时期样品。为了便于与原料小麦蛋白区分开来,选择已蒸熟尚未接种的小麦作为空白样品。
样品制备、双向电泳所用部分试剂见参考文献[8]。α-氰基-4-羟基肉桂酸、碳酸氢铵、三氟乙酸(trifluoroacetic acid,TFA)、胰蛋白酶、乙腈等购于美国Sigma公司。
1.2 仪器与设备
Ettan IPGphor 3等电聚焦电泳仪、ImageScanner扫描仪:美国GE公司;Mini-Protein 3 Cell蛋白垂直电泳系统:美国Bio-Rad公司;Ultraflextreme串联飞行时间质谱仪:德国Bruker公司;CR22G型高速冷冻离心机:日本HITACHI公司;CentriVap冷冻干燥系统:美国Labconco公司;UV-2100型紫外可见分光光度计:上海尤尼柯仪器有限公司。
1.3 方法
1.3.1 样品制备
熟麦曲宏蛋白质组样品的制备参照文献[9]方法,包括黄酒麦曲的浸提来获得蛋白粗提取液,使用Clean up kit试剂盒除去粗提取液中的杂质,获得纯净的蛋白沉淀加入样品水化液溶解,-20℃保存。
1.3.2 双向电泳(2-DE)实验分析[10]
按照GE公司《双向电泳操作手册》进行等电聚焦和聚丙烯酰胺凝胶电泳(SDS-PAGE)。将蛋白质样品(110μg)以水化上样的方式加到pH 3~10的固定化干胶条(immobilized pH gardient,IPG)中。使用Ettan IPGhor 3系统进行第一向等电聚焦电泳,程序设置如下:快速(250V×2h);线性(500V×1h);线性(1 000V×1h);线性(5 000V×2h);线性(5 000V×10 000Vh)。
等电聚焦结束后,立即进行平衡。IPG胶条在水化平衡液I(加1%的二硫苏糖醇)中振荡平衡15min。然后同法放置在水化平衡液II(加2.5%的碘乙酰胺)中振荡平衡15min。
平衡结束后将胶条转移至12.5%的SDS-PAGE凝胶上进行第二向分离。使用蛋白垂直电泳系统Mini-Protein 3 Cell以恒电流方式进行电泳:20mA/胶条。电泳结束后使用考马斯亮蓝(coomassie brilliant blue,CBB)R-250进行凝胶的固定、染色、脱色,直至背景无色透明,蛋白点清晰为止。
1.3.3 凝胶扫描及图谱分析[10-11]
使用Image Scanner III扫描仪对凝胶进行扫描并保存图像。使用PDQuest软件对不同时期的麦曲浸提液的双向电泳图谱进行比对分析,并对蛋白点的定量值以相对体积(%vol)进行标准化处理。定量差异≥2倍才被认定为差异蛋白点。为避免系统误差,对每个样品需要进行3次平行实验。
1.3.4 质谱鉴定及数据库搜索[12]
从双向电泳凝胶上手动切下差异蛋白点,并用胰蛋白酶溶液进行酶解。使用Ultraflextreme MALDI-TOF MS串联质谱仪器进行质谱鉴定。使用Mascot软件在美国国立生物技术信息中心(national center of biotechnology information,NCBI)数据库中对质谱数据进行搜索,Mascot分值大于55即为鉴定成功。
2 结果与讨论
2.1 熟麦曲制曲过程中水分含量和温度的变化情况
小麦经过轧碎、拌水、蒸煮、接种、入池、培养(包括静止培养、间断通风培养、连续通风培养),最终得到成品熟麦曲。在麦曲的生产过程中,工厂主要是通过控制通风来控制麦曲的品温,以获得品质优良的麦曲[2-4]。制曲过程中温度的变化曲线如图1所示。

图1 熟麦曲制曲过程中温度的变化曲线Fig.1 Change of temperature in cooked wheat koji-making
从图1可以看出,接种后最初6~8h,曲料品温在28~30℃,相对湿度为90~95%,孢子在适当的水分和温度条件下吸水膨胀。在此阶段,原料中的空气能够满足菌体生长繁殖需要,并且菌体的生长不是十分旺盛,产生的热量及CO2不是很多,不需要对曲层进行通风降温,为静止培养。接种后的12~20h,菌丝迅速延长,品温逐渐上升。需要间断通风,一方面调节品温,当品温上升至33~34℃,需要通风来降低品温,当品温降低至30℃时停止通风。另一方面供给足够氧气,并利用空气带走曲层中的CO2。间断通风3~4次后,菌体的生长繁殖开始进入旺盛时期,菌丝大量生长,产生大量的热量,品温达到38~40℃,此时应开始连续通风。到后期,米曲霉的生命活动逐步停滞,开始着生分生孢子,曲料呈现淡黄色直至嫩黄绿色。一般从入池到出曲时间达到38~42h时,应及时出房,以利于酶最大程度地积累[13-14]。
2.2 熟麦曲制曲过程中不同时期的双向电泳图谱分析
根据制曲过程中温湿度、水分含量、通风状况以及米曲霉自身的生长情况,分别取8h、20h、32h和44h作为熟麦曲制曲过程中4个时期的关键点,为了便于与原料小麦蛋白的区分开来,也选择已蒸熟尚未接种的小麦作为空白样品。用0.1mol/L HAc-NaAc缓冲液(pH 4.2)浸提麦曲,按照文献[9]方法来处理样品,控制每个时期蛋白样品相同上样量(110μg),应用7cm,pH 3~10非线性的IPG胶条进行双向电泳实验,实验获得的2-DE图谱见图2。

图2 绍兴黄酒熟麦曲制曲过程中不同时期的2-DE图谱Fig.2 2-DE atlas of the different stages in cooked wheat koji-making
对熟麦曲制曲过程的2-DE图谱分析发现,蒸熟的小麦(0h)图谱中呈现的蛋白点是原料小麦蛋白,随后在米曲霉分泌蛋白酶的作用下逐步降解,到菌丝繁殖期(32h)时原料小麦蛋白已基本消失。这与日本清酒所用的米曲霉RIB40在麦麸上的生长情况基本一致[15]。
为了深入了解熟麦曲制曲过程中宏蛋白质组的变化情况,使用PDQuest软件对制曲过程中4个时期的2-DE图谱进行差异分析。并对图谱中显著蛋白点的表达丰度(根据蛋白点的相对体积自动生成的数量值)进行定量分析,共找到5个明显差异蛋白点(见图3及表1)。

图3 绍兴黄酒熟麦曲孢子着生期样品的2-DE图谱上差异蛋白点Fig.3 Different spots of cooked wheat koji in mature period from 2-DE profiles
2.3 差异蛋白点的质谱鉴定结果
在熟麦曲孢子着生期样品的2-DE凝胶上挖取这5个差异蛋白点进行串联质谱分析,质谱分析所得数据通过Mascot软件,在NCBI蛋白质总库进行检索,鉴定结果列于表2。
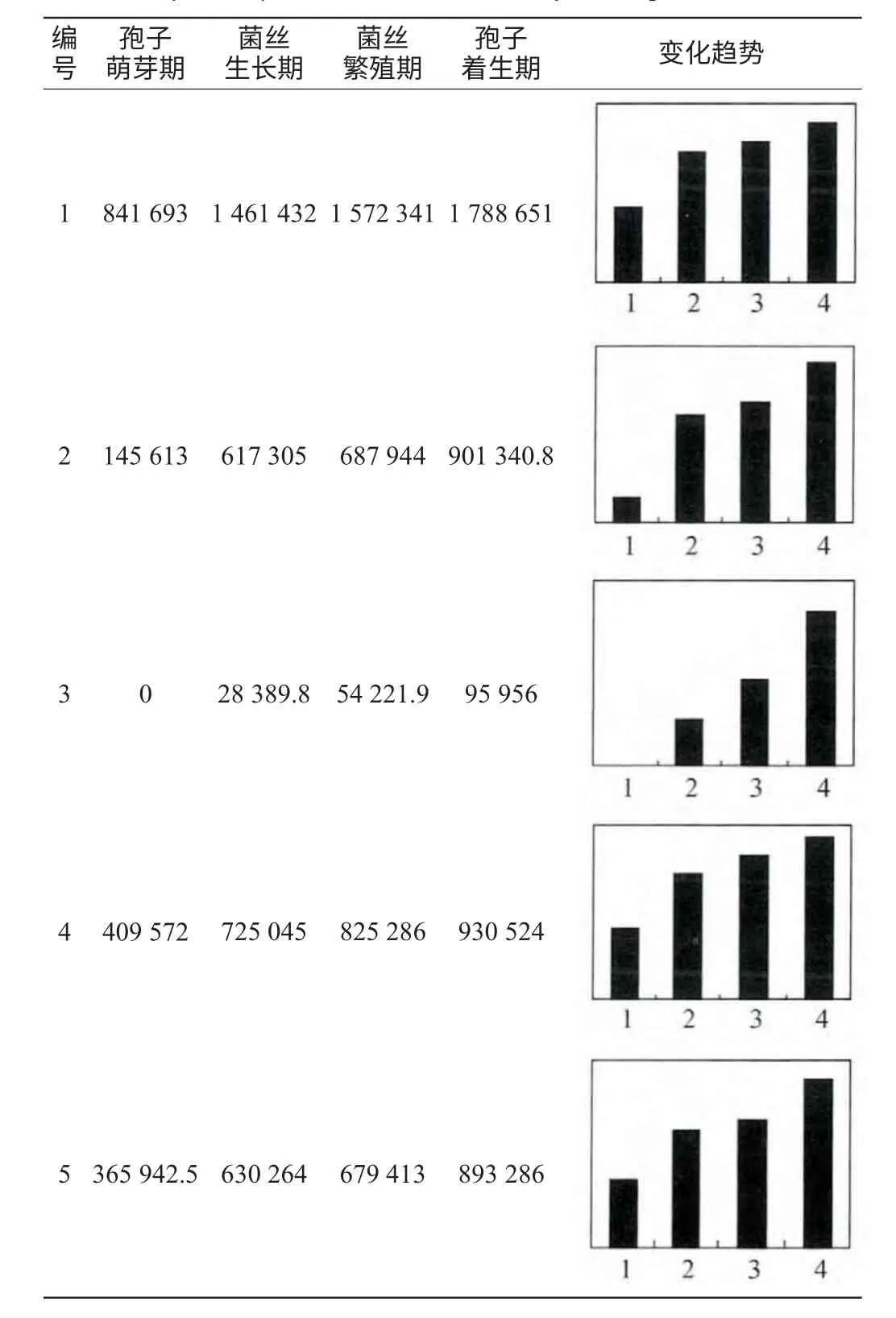
表1 熟麦曲制曲过程中显著蛋白点的表达丰度及变化趋势Table 1 Expressive abundance and variation trend of significant protein point in cooked wheat koji making

表2 绍兴黄酒熟麦曲制曲过程中不同时期差异蛋白点的MALDI-TOF/TOF MS鉴定结果Table 2 Identification of different spots from different stages of koji-making by MALDI-TOF/TOF MS
由表2可知,鉴定得到5种蛋白质(α-淀粉酶、葡萄糖淀粉酶B、酸性蛋白酶、中性蛋白酶II、碱性蛋白酶),全部来自于微生物米曲霉,且在整个制曲过程中蛋白表达丰度呈现逐渐递增的趋势,这与文献报道的米曲霉接种8~10h后分泌的淀粉酶、蛋白酶活力逐渐增大,至40h左右基本接近最高活力的结果相一致[16]。分析其原因主要有两方面:首先是菌种,熟麦曲采用纯种培养的米曲霉苏-16,产淀粉酶、蛋白酶的能力较强。其次是适宜的培养条件,一般曲霉菌生长适温在30~37℃,超过40℃对于微生物生长和产酶不利。在制曲过程中,培养温度始终控制在40℃以下,并且根据曲霉繁殖规律,以静止、间歇、连续的方式进行通风,来保证其生长产酶的需要[3]。在后期,米曲霉生命活动逐步停滞,开始生成孢子时及时出曲,此时曲中积累了最多的酶。因此在黄酒酿造中熟麦曲对原料的利用率更高,缩短发酵周期。
熟麦曲中淀粉酶主要为α-淀粉酶和葡萄糖淀粉酶B(又称糖化酶),二者相互配合,以接力的方式完成从淀粉到葡萄糖的一系列糖化反应。整个制曲过程中,2种淀粉酶在2-DE图谱中的蛋白丰度不断增大,其中丰度最高的是α-淀粉酶,PDQuset软件分析其约占图谱中总蛋白体积的70%,说明熟麦曲有较强淀粉分解能力。结合前人研究发现,熟麦曲中行使糖化功能主要是米曲霉分泌的葡萄糖淀粉酶B。而生麦曲除此之外,还有来源于原料小麦的β-淀粉酶,其酶系更加丰富,生成的代谢产物也会更加复杂多样[7]。
在孢子萌芽时期(米曲霉接种8h后),2-DE图谱中已出现酸性蛋白酶、中性蛋白酶II和碱性蛋白酶,整个制曲过程中图谱上这3个蛋白点丰度逐步增大,并始终以高丰度蛋白形式存在。三者共同作用将原料中的蛋白质水解形成多肽、低肽及氨基酸等含氮化合物,能赋予黄酒特有的风味并为酵母的繁殖提供营养物质[2,14]。
制曲过程的最后时期,2-DE图谱中出现了很多新的蛋白,一方面由于随着微生物的生长,代谢产物逐渐增多,此外随着微生物生命活动的终止,微生物细胞裂解也会释放出一些胞内蛋白。这些蛋白有待于进一步研究。
在工业化生产的大背景下,降低麦曲使用量将成为一种趋势,麦曲使用量的减少必须以保证黄酒麦曲品质,不影响黄酒质量为前提,因此迫切需要对麦曲进行机理性研究。本研究利用宏蛋白质组学理论和方法,对绍兴黄酒熟麦曲制曲过程中4个不同时期的麦曲浸提液进行宏蛋白质组学研究,包括通过双向电泳分离宏蛋白质组样品,利用PDQuest软件分析差异蛋白点,以及串联质谱鉴定差异蛋白,所获得研究结果有利于进一步了解麦曲中主要水解酶系变化,为制曲工艺的控制和改良提供参考依据。
[1]顾国贤.酿造酒工艺学[M].北京:中国轻工业出版社,2007.
[2]谢广发.黄酒酿造技术[M].北京:中国轻工业出版社,2010.
[3]寿泉洪.生麦曲与熟麦曲在黄酒生产中的应用[D].无锡:江南大学硕士论文,2006.
[4]许赣荣,胡文峰.固态发酵原理、设备与应用[M].北京:化学工业出版社,2009.
[5]王 璐.黄酒麦曲中淀粉酶的分离纯化及其性质研究[D].无锡:江南大学硕士论文,2007.
[6]徐 翔,毛 健,陈正行,等.黄酒生麦曲的生化性能及在发酵过程中的研究[J].食品工业科技,2008,29(8):140-142.
[7]ZHANG B,KONG L Q,CAO Y,et al.Metaproteomic characterization of a Shaoxing rice wine“wheat Qu”extract[J].Food Chem,2012,134(1):387-391.
[8]孔令琼.黄酒麦曲浸提液的宏蛋白质组学研究[D].无锡:江南大学硕士论文,2011.
[9]ZHANG B,GUAN Z B,CAO Y,et al.Secretome of Aspergillus oryzae in Shaoxing rice wine koji[J].Int J Food Microbiol,2012,155(3):113-119.
[10]魏开华,应天翼.蛋白质组学实验技术新编[M].北京:化学工业出版社,2010:21-24.
[11]辛普森.蛋白质与蛋白质组学实验指南[M].北京:化学工业出版社,2006.
[12]陈 捷.农业生物蛋白质组学[M].北京:科学出版社,2009.
[13]XIE G F,LI W J,LU J,et al.Isolation and identification of representative fungi from Shaoxing rice wine Wheat Qu using a polyphasic approach of culture-based and molecular-based methods[J].J I Brewing,2007,113(3):272-279.
[14]CAO Y,XIE G F,WU C.et al.A study on characteristic flavor compounds in traditional chinese rice wine-Guyue Longshan rice wine[J].JI Brewing,2010,116(2):182-189.
[15]ODA K,KAKIZONO D,YAMADA O,et al.Proteomic analysis of extracellular proteins from Aspergillus oryzae grown under submerged and solid-state culture condition[J].Appl Environ Microb,2006,72(5):3448-3457.
[16]张艳芳,陶文沂.米曲霉40188 产中性蛋白酶、α-淀粉酶特性的研究[J].食品与发酵工业,2008,34(5):35-37.

