山楂叶中总黄酮的浸提工艺研究
曹乐民,周志强,崔俊林,石明生*
(1.河南农业职业学院,河南 郑州 451450;2.重庆三峡职业学院,重庆 404001)
山楂叶为蔷薇科植物山里红(Crataegus pinnatifida Bge.var.maior N.E.Br.)或山楂(Crataegus pinnatifida Bge.)的干燥叶。药理及临床试验表明,山楂叶中黄酮类化合物具有降血压、调血脂、增加冠脉流量、改善心肌供血供氧等作用,对高血压、高血脂、冠心病及心绞痛等心血管疾病均具有良好疗效。山楂叶总黄酮在应用及含量测定时常用的方法有水提法和乙醇溶液提取法2种,本试验考察了山楂叶的采摘时节、温度、pH值、料液比、提取时间等因素对山楂叶中总黄酮提取率的影响,得出了水提法最优的提取工艺,为山楂叶中黄酮类物质的提取和使用提供了科学依据。
1 材料与方法
1.1 材料与试剂
干燥的芦丁:西安融升生物科技有限公司购买;山楂叶(A采果后9月下旬绿叶;B落叶前绿叶;C落叶):太行山上采摘;氢氧化钠NaOH(分析纯)、亚硝酸钠Al(NO)3(分析纯)、硝酸铝Al(NO)3(分析纯):成都科龙化工试剂厂;蒸馏水:pH 7.0~8.0。
1.2 仪器与设备
HH-4型数显水浴锅:金坛市杰瑞尔电气有限公司;圆底烧瓶、容量瓶、称量瓶、移液管:北京汇海科仪科技有限公司;DHG-9053A型恒温鼓风干燥箱:上海合恒仪器设备有限公司;7200型分光光度计:上海尼龙柯仪器有限公司。
1.3 试验方法
1.3.1 标准曲线的制定
称取20.8mg芦丁,用体积分数60%的乙醇溶解并稀释至100mL,作为对照品溶液。精密量取1mL、2mL、3mL、4mL、5mL、6mL,分别置于25mL容量瓶中,各加水至6mL,加5%NaNO2溶液1mL,使混匀放置6min,然后用1mL移液管移取10%的Al(NO)3溶液1mL,使混匀放置6min,然后用10mL移液管移取4%的NaOH溶液10mL,再加水至刻度,摇匀放置15min,并做空白对照。按分光光度法在波长500nm处测定吸光度值,所取标准溶液的浓度和吸光度值数据经回归处理,得回归方程:y=11.687 265x-0.008 186,R=0.999 719,结果表明,芦丁浓度为0.008 3~0.049 92mg/L范围内具有良好的线性关系。
1.3.2 提取
试探试验:经初步试验得出浸提液在稀释50倍时,其吸光度值在标准曲线的吸光度值范围之内。
优化试验依次对样品A、样品B、样品C进行浸提。
提取步骤:
水体和底层溶氧低、水体易分层、水体交换能力差:①多开增氧机和爬水机,滚动和震动水体,促进水体上下层交换,防止溶氧、水温分层,工作基本点必须围绕溶氧。增氧机并不产氧,而是起到活络水体和输送氧的作用,70%以上的溶氧是依靠藻类光合作用生产提供的,可见适时适量培藻,保持藻类新陈代谢非常重要。②水质好坏决定溶氧高低。藻相的好坏决定了水色,水色的好坏可以判断溶氧的高低,所以冬棚养殖一定要养护好水质,才能保证溶氧充足。需对水质不定期的修复和保养,千万不要等到水质变坏了才去调改,既费成本又很难调。
干燥山楂叶→除杂→破碎→浸提→过滤→滤液→测定。
具体操作:
①称样:每次称取样品10.00g置于圆底烧瓶中,共16组,每组2个样品;②加碱液:按表1和表2要求向圆底烧瓶中加0.5%NaOH溶液;③加水:按表1和表2要求向1号~16号的烧瓶中加蒸馏水;④浸提:准备8台水浴锅,设定温度。待水温达到指定温度后放置样品,每2个平行样品放置在水浴锅的对角位置;⑤计时:按表1和表2要求给1号~16号的样品计时;⑥过滤:提取结束后过滤,静置冷却至常温且无沉淀。
1.3.3 样品测定
用1mL移液管取静置冷却后的滤液1mL至250mL容量瓶中,再用5mL移液管移取5mL蒸馏水进行稀释,用1mL移液管移取5%的NaNO2溶液1mL,混匀后放置6min,用1mL移液管移取10%的Al(NO)3溶液1mL,混匀后放置6min,用10mL移液管移取4%的NaOH溶液10mL,再加水至刻度,摇匀后放置15min。移取上清液1mL至50mL容量瓶中,并用蒸馏水稀释定容,然后进行测定。
2 结果与分析
2.1 试验因素水平及正交试验设计
采用标准曲线法测定样品滤液黄酮含量。对样品A、样品B、样品C分别测定。正交试验因素及水平见表1。
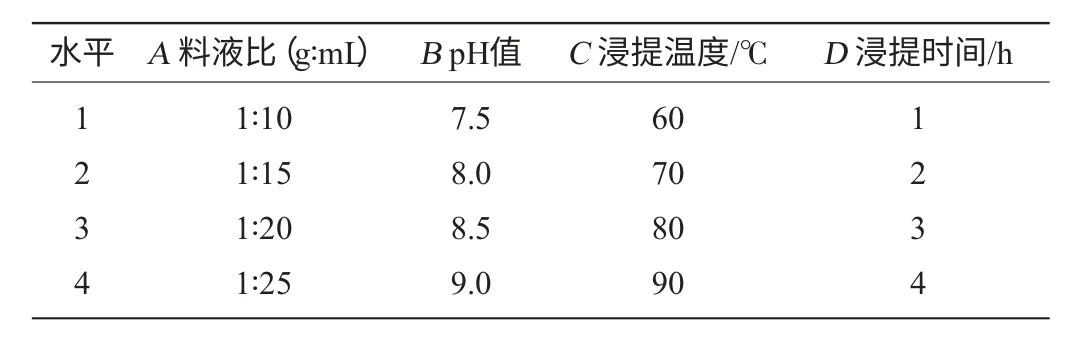
表1 山楂叶中总黄酮浸提工艺优化正交试验因素水平Table 1 Factors and levels of orthogonal test for optimization of extraction process of flavonoids from hawthorn leaves
2.2 样品提取结果与分析
2.2.1 样品A最佳提取条件的确定
由表2可知,各因素对吸光度值影响程度的主次顺序为浸提温度、浸提时间、料液比、pH值,并得出样品A在浸提温度90℃,浸提时间3h或4h,料液比1∶25,pH值为8.5时提取率最高,被确定为最优组合,考虑提取成本,提取时间最终确定为3h,即最优组合为A4B3C4D3。
2.2.2 样品B最佳提取条件的确定
对样品B进行测定,试验结果如表3所示。

表2 样A提取条件正交试验结果与分析Table 2 Results and analysis of orthogonal test for optimization of extraction process of flavonoids from sample A
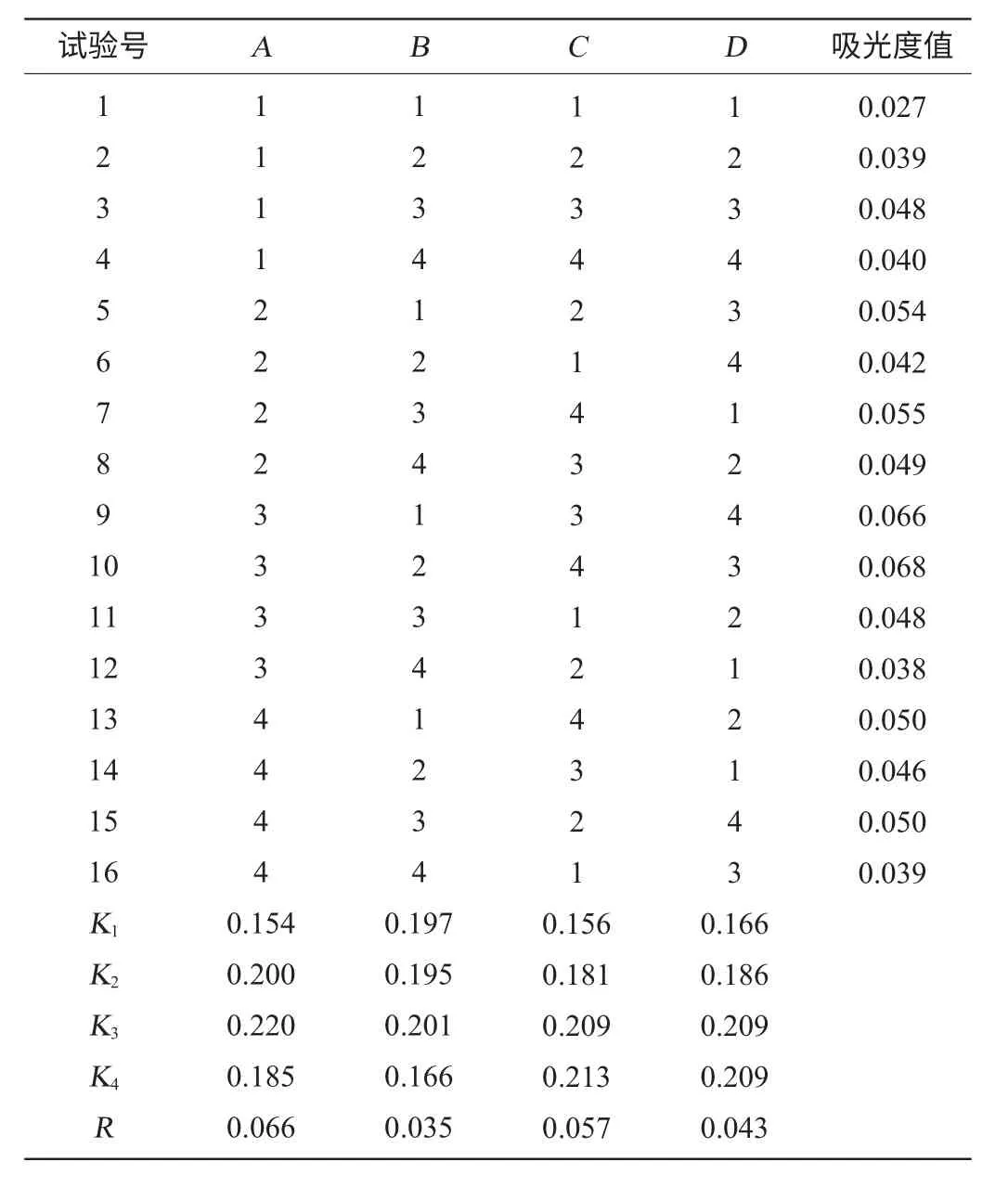
表3 样B提取条件正交试验结果与分析Table 3 Results and analysis of orthogonal test for optimization of extraction process of flavonoids from sample B
由表3可知,各因素对吸光度值影响程度的主次顺序为料液比、浸提温度、浸提时间、pH值,并确定样品B在浸提温度90℃,料液比1∶20,浸提时间3h或4h,pH值8.5时样品的吸光度值最大,即提取液中黄酮类物质含量更高。考虑提取成本,提取时间最终确定为3h,即最优组合为A3B3C4D3。从表3中样品的吸光度值经计算得出,样品B较样品A中黄酮含量高。
2.2.3 样品C最佳提取条件的确定
对样品C进行测定,试验结果如表4所示。
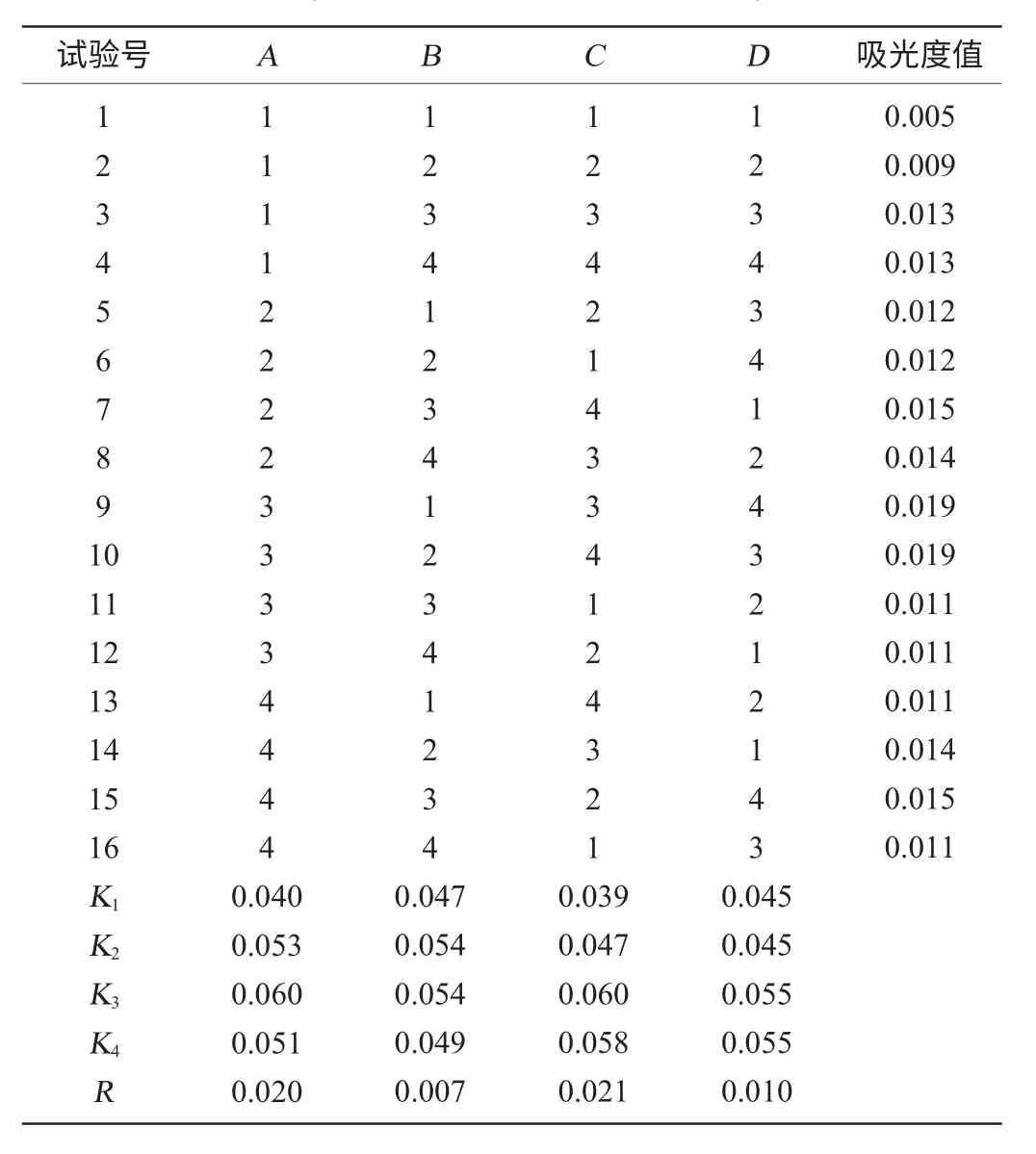
表4 样C提取条件正交试验结果与分析Table 4 Results and analysis of orthogonal test for optimization of extraction process of flavonoids from sample C
由表4可知,各因素对吸光度值影响程度的主次顺序为提取温度、料液比,提取时间、pH值,并确定样品C在浸提温度90℃,料液比为1∶20,浸提时间为3h或4h,pH值为8.0或8.5时样品的吸光度值最大,即黄酮类物质提取率最高。
2.3 采样时期对黄酮提取率的影响
试验结果得出,样品B中的黄酮类提取率最高,其次是样品A,最后是样品C。即不同的采样时期对黄酮的提取率有较大的影响。因此,建议采集山楂叶的时期在山楂收获前,采摘还没有脱落的叶子来进行黄酮的提取。从黄酮溶液的口感及提取效率考虑,确定最优组合为A3B3C4D3。
2.4 样品B中黄酮物质总含量
使用样品B的最优提取工艺对样品B进行2次提取,最终确定样品B中黄酮物质测定如表5所示,2次黄酮物质提取率分别为x1和x2。
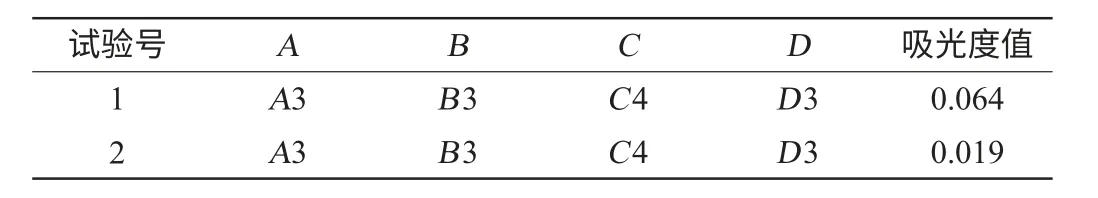
表5 样品B优化工艺提取结果Table 5 Results and extraction result of optimization process from sample B

经计算得出,每10g样品B前后2次提取黄酮类物质含量分别为x1=0.800 0g,x2=0.237 5g,故每10g山楂叶提取总黄酮含量为1.037 5g,山楂叶中总黄酮提取率为10.375%。
3 结论
经以上3次试验可知样品A、样品B、样品C山楂叶样品中,样品B中黄酮含量最高,并通过正交试验设计分析得出最优浸提条件为A3B3C4D3,即山楂采摘前的山楂叶中总黄酮提取率最高,并得出最佳提取工艺为浸提温度90℃,pH值8.5,料液比1∶20,浸提时间3h时,可将山楂叶中的黄酮类物质有效提取。试验得出山楂采摘前的山楂叶中总黄酮提取率为10.375%。
[1]国家药典委员会.中华人民共和国药典[M].北京:人民卫生出版社,2010.
[2]何 改.山楂叶黄酮类化合物最佳提取工艺研究[J].食品研究与开发,2002,23(1):15-17.
[3]邢小莉,杨 玲.新疆药桑桑皮总黄酮提取工艺的优化[J].中国酿造,2013,32(1):57-60.
[4]向东山.基于正交旋转组合设计的藤茶总黄酮提取工艺优化研究[J].中国酿造,2010,29(2):116-119.
[5]赵 翾,李红良,张惠妹.响应面法优化火麻仁黄酮提取工艺[J].食品科学,2011(2):127-131.
[6]柳 嘉,POPOVICH D E,景 浩.山楂黄酮提取物的抗氧化活性和对癌细胞生长抑制作用[J].食品科学,2010(3):220-223.
[7]雷昌贵,孟宇竹,蔡 利.柑橘皮中黄酮提取工艺研究[J].中国食品添加剂,2008(2):135-138.
[8]顾 英,韩凤丽,王洪洋.响应面法优化红薯叶类黄酮提取工艺的研究[J].食品工业科技,2012(3):286-289,333.
[9]余 清,许慧星,肖小蓉,等.基于响应面分析法优化的乌饭树叶总黄酮提取条件[J].中国农学通报,2008(1):93-97.
[10]王昌禄,江慎华,陈志强,等.香椿老叶总黄酮提取工艺及其抗氧化活性的研究[J].北京林业大学学报,2008(4):28-33.
[11]王兰珍,马希汉,王姝清,等.元宝枫叶总黄酮提取方法研究[J].西北林学院学报,1997(4):66-69.
[12]韩雅慧,顾赛麒,陶宁萍,等.甘草总黄酮提取工艺及总抗氧化活性研究[J].食品工业科技,2012(2):239-242.
[13]潘进权,张世英,何敏婷,等.竹叶总黄酮提取工艺及抗氧化特性的研究[J].中国食品学报,2012(3):39-44.
[14]张艳军,彭重威,徐淑庆,等.银叶树树叶中总黄酮提取工艺优化[J].中药材,2012(4):638-641
[15]李 琴.香蕉皮黄酮提取工艺研究[J].陕西农业科学,2012(2):34-37.
[16]李培培,戚向阳,罗 彤,等.化学发光法研究不同杨梅黄酮提取物的抗氧化活性[J].中国食品学报,2011(7):190-194.

