一种喹诺酮类药物的酶联免疫快速检测试剂盒的研制
郑百芹,罗晓琴 *,冯才伟,董李学,贾芳芳,蒙君丽,郝立武,张书宏
(1.唐山市畜牧水产品质量监测中心,河北 唐山 063000;2.北京勤邦生物技术有限公司,北京 102206)
喹诺酮类药物是一类全合成的抗菌药物[1-2],具有抗菌谱广、高效、低毒、组织穿透能力强等优点,已成为水产养殖中最重要的抗感染药物之一[3-4]。随着我国水产品养殖业的发展,近年来水污染影响严重,水产病害时有发生,因此,渔用兽药用量越来越频繁,导致了药物残留超标问题。中国、日本、欧盟均对喹诺酮类药物制定了最大允许限量,美国等一些国家未允许用于水产养殖业[5]。因此,研究对喹诺酮类药物的检测方法有着重要意义。
喹诺酮类药物残留的检测手段有常规仪器法和快速检测法。常规仪器法有高效液相色谱法、气相色谱法、色质联用等技术,快速检测法有酶联免疫吸附法、胶体金免疫层析法等[6-13]。本实验研究了水产品中氧氟沙星、环丙沙星、氨氟沙星等3种喹诺酮类药物残留的酶联免疫吸附法。该方法的准确性高于一般的快速检测方法,检测程序及所需条件较仪器法更方便,尤其便于现场大量样本的检测,更适于中小企业对成本控制的需求。
1 材料与方法
1.1 材料与试剂
氧氟沙星、环丙沙星、氨氟沙星标准品:北京标准物质研究中心;乙腈:北京百欣试剂公司;鱼肉:市售;包被原、氧氟沙星单克隆抗体、酶标二抗:北京勤邦生物技术有限公司。
0.1mol/L氢氧化钠溶液:实验室自制;抗原稀释液(0.05mol/L碳酸盐缓冲液(pH 9.6);复溶液(0.02mol/L磷酸盐缓冲液(phosphate buffer solution,PBS);洗涤液(向0.02mol/L PBS中加入1%吐温);封闭液(在0.02mol/L PBS中加入0.05%牛血清蛋白(bovine serum albumin,BSA);底物显色液由A液和B液组成,A液为过氧化氢,B液为四甲基联苯胺;终止液(2mol/L H2SO4)。以上实验用化学试剂:北京百欣试剂公司。
1.2 仪器与设备
MK3酶标仪(最大量程为4.0):上海雷勃分析仪器有限公司;MX-F涡旋仪:湖南湘立科学仪器有限公司;HFJ-10均质器:湖南湘立科学仪器有限公司。
1.3 实验方法
1.3.1 最佳抗原包被浓度、单克隆抗体浓度的确定
以棋盘法确定最佳抗原包被浓度,氧氟沙星标准品质量浓度分别为0,0.2μg/L,抗原液稀释倍数:2 000、6 000、18 000;单克隆抗体液稀释倍数:10 000、30 000、90 000、270 000;根据实验室前期已有基础,选择的酶标二抗液稀释倍数为1 000。
1.3.2 喹诺酮类药物试剂盒的制备
以100μL适宜稀释倍数的抗原稀释液包被96孔酶标板,37℃孵育2h,然后用洗涤液洗板3次,拍干,用150μL封闭液封闭,37℃孵育2h,取板后拍干即可。
1.3.3 喹诺酮类药物试剂盒配套试剂
96孔酶标板,标准品1~6(质量浓度分别为0、0.2μg/L、0.6μg/L、1.8μg/L、5.4μg/L、16.2μg/L),高质量浓度标准品(质量浓度为1mg/L),酶标二抗,抗体工作液(即以最佳稀释浓度稀释的单克隆抗体),底物液A液,底物液B液,终止液,20×浓缩洗涤液,5×浓缩复溶液。
1.3.4 样本前处理方法
研究以鱼肉为样本,称取2.0g均质后的鱼肉样本至50mL聚苯乙烯离心管中,分别加入1mL 0.1mol/L氢氧化钠溶液和7mL乙腈,用振荡器振荡5min,3 000r/min 以上,室温(20~25℃)离心10min;移取2mL上清液至10mL洁净干燥玻璃试管中于50~60℃水浴氮气流下吹干;加入1mL 正已烷用涡旋仪涡动30s,再加入1mL复溶工作液,涡动30s,3 000r/min以上,室温(20~25℃)离心5min;除去上层有机相,取下层水相50μL用于分析。
1.3.5 操作步骤
加标准品/样本50μL 到对应的微孔中,然后加入酶标二抗50μL/孔,再加入抗体工作液50μL/孔,轻轻振荡混匀,用盖板膜盖板后置25℃避光环境中反应30min。小心揭开盖板膜,将孔内液体甩干,加入洗涤工作液250μL/孔,充分洗涤4~5次,每次间隔10s,泼掉板孔内洗涤液,用吸水纸拍干。加入底物液A液50μL/孔,再加入底物液B液50μL/孔,轻轻振荡混匀,用盖板膜盖板后置25℃避光环境中反应15min。加入终止液50μL/孔,轻轻振荡混匀,设定酶标仪于450nm处,测定每孔OD450nm值。
1.3.6 结果判定方法
标准品或样本的百分吸光率等于标准品或样本的平均吸光度值(双孔)除以第一个标准品(0标准)的平均吸光度值,再乘以100%,即:
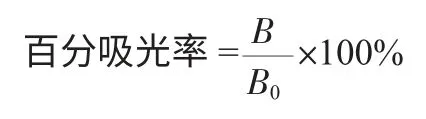
式中:B 为一定质量浓度标准品或样本溶液的平均吸光度值;B0为0μg/L 标准溶液的平均吸光度值。
1.3.7 ELISA方法测定标准曲线的建立
以标准品百分吸光率为纵坐标,以喹诺酮类药物标准品质量浓度(μg/L)的对数为横坐标,绘制酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)标准曲线。将样本的百分吸光率代入标准曲线中,从标准曲线上读出样本所对应的质量浓度,乘以其对应的稀释倍数即为样本中喹诺酮类药物的实际质量浓度。
1.3.8 喹诺酮类药物试剂盒的鉴定
根据上述实验,参照其操作步骤,分别加入最适量抗原、单抗和酶标二抗,氧氟沙星、环丙沙星、氨氟沙星标准品质量浓度分别以0、0.2μg/L、0.6μg/L、1.8μg/L、5.4μg/L、16.2μg/L加入,测定标准曲线。
1.3.9 试剂盒灵敏度和检测限试验
对20份鱼肉空白样品进行检测,从标准曲线上查出对应于各吸光度值的质量浓度,以20份样本质量浓度的平均值加上3倍标准差表示方法检测限(method detection limit,MDL)。
1.3.10 样本精密度和准确度试验
以回收率作为方法准确度评价指标,重复测定某一质量浓度样品的检测结果相对标准偏差(relative standard deviation,RSD)作为方法精密度评价指标。
分别按0.5μg/L、1.0μg/L、2.0μg/L 3个质量浓度的喹诺酮类药物对鱼肉样品进行添加回收试验,每个样品做3个平行,用3批不同试剂进行测定。
1.3.11 稳定性试验
将试剂盒存放在4℃条件下,连续12个月,每个月测定一次;将试剂盒存放在37℃条件下,放置7d进行测定。以上测定指标均为试剂盒的最大吸光度值(零标准)、50%抑制浓度(half-inhibitory concentration,IC50)以及按0.5μg/L、1.0μg/L、2.0μg/L 3个质量浓度的喹诺酮类药物对鱼肉样品进行添加回收试验所测得的回收率,直到试剂盒的灵敏度和回收率开始下降为止,根据试验结果判断试剂盒的稳定性。
由于考虑到在运输和使用过程中,会有非正常保存条件出现,因此将试剂盒在37℃保存条件下放置7d,测定试剂盒的各项指标是否符合要求。
1.3.12 交叉反应率试验
选择与氧氟沙星具有类似结构的药物环丙沙星、氨氟沙星进行酶联免疫吸附测定,通过ELISA标准曲线分别得到其50%抑制浓度,用下式计算试剂盒对其他药物的交叉反应率:

2 结果与分析
2.1 最佳抗原包被质量浓度、单克隆抗体质量浓度的确定
测定质量浓度为0和0.2μg/L的氧氟沙星标准品的光密度值OD450nm,结果见表1。
试剂盒的最大光密度值(零标准)范围应在1.5~2.2,当OD450nm(0.2μg/L)/OD450nm(0)的抑制率在70%~85%时,选择抗原的最大稀释倍数作为抗原效价,即抗原稀释倍数为18 000,单克隆抗体液稀释倍数为9 000。
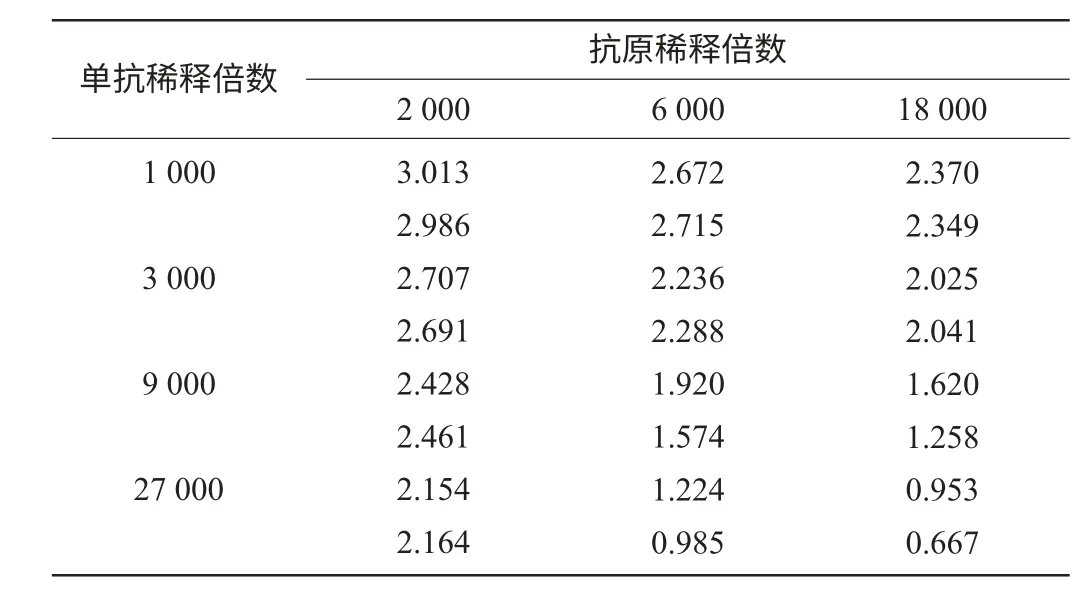
表1 抗原效价筛选Table 1 Detection of the suitable dilution time of antigen
2.2 喹诺酮类药物试剂盒的鉴定
ELISA方法测定氧氟沙星标准曲线见图1,喹诺酮类药物ELISA相关参数见表2。
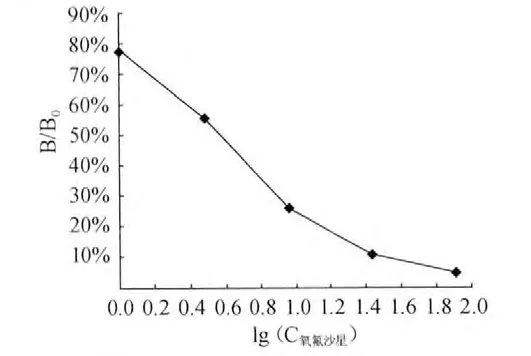
图1 氧氟沙星标准曲线Fig.1 Standard curve of ofloxacin

表2 喹诺酮类药物ELISA相关参数Table 2 ELISA related parameters of quinolones
由表2可知,标准曲线回归方程相关系数R2≥0.99,说明方程线性良好。IC50值较小,说明试剂盒的灵敏度较好。氧氟沙星、环丙沙星和氨氟沙星的检测限均为1μg/kg。
2.3 样本精密度和准确度试验
以0.5μg/kg、1.0μg/kg、2.0μg/kg 3个质量浓度的氧氟沙星、环丙沙星、氨氟沙星分别对鱼肉样品进行添加,检测结果见表3。
由表3可知,平均回收率在62.8%~97.7%之间,说明方法准确性较高;批内、批间相对标准偏差均小于10%,说明方法精密度较好。由于经高效液相色谱法测定添加回收实验的鱼肉样品的喹诺酮类药物含量均在0.19μg/L以下,因此视为鱼肉中喹诺酮类药物含量为0。
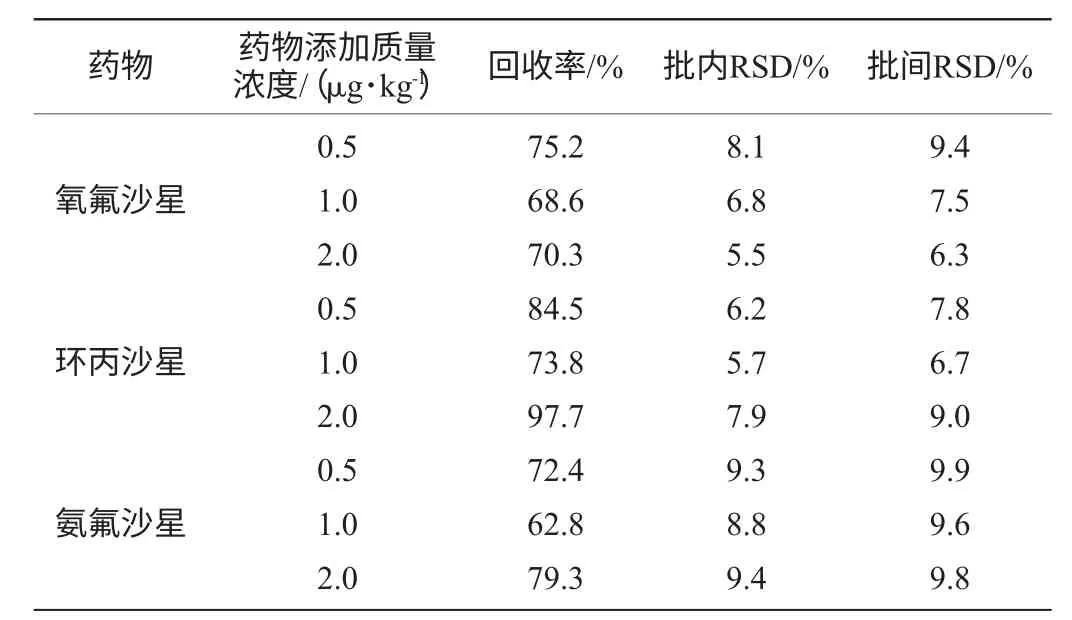
表3 鱼肉精密度及准确度试验Table 3 Precision and accuracy tests of fish sample
2.4 稳定性试验
将试剂盒分别在4℃条件下放置12个月、37℃条件下放置7d,经过测定,试剂盒的最大光密度值(零标准)(1.5~2.2)、50%抑制浓度(0.6~1.8μg/L)、喹诺酮类药物添加回收率(60%~100%)均在正常范围之内。
2.5 交叉反应率试验
氧氟沙星抗体与其他喹诺酮类药物的交叉反应率见表4。

表4 氧氟沙星抗体与其他喹诺酮类药物交叉反应率试验Table 4 Cross reaction rate test of ofloxacin antibodies and other quinolones
由表4可知,氧氟沙星抗体与环丙沙星、氨氟沙星的交叉反应率为100%,说明该抗体能够用于检测氧氟沙星、环丙沙星、氨氟沙星3种喹诺酮药物,为研制可以同时检测多种喹诺酮类药物的ELISA试剂盒提供了可能。
3 结论与讨论
我国国家标准GB/T20366—2006《动物源产品中喹诺酮类残留量的测定》利用液相色谱-串联质谱法检测喹诺酮类药物残留量,该种方法的优点是准确,缺点是所需仪器昂贵,需要专业的操作人员和较长的时间。因此,利用酶联免疫试剂盒能够比国标方法更加快速、简便地检测出鱼肉样本中的喹诺酮类药物含量,而该试剂盒的操作时间仅需45min,适合现场大量检测样本的检测。
本实验在已有的技术平台上,对影响喹诺酮类药物ELISA试剂盒的各个条件进行了研究,并确定了最佳的抗原液浓度和单克隆抗体浓度。通过一系列实验,确定了该试剂盒对氧氟沙星、环丙沙星、氨氟沙星的检测限均为1μg/kg,平均回收率为62.8%~97.7%,说明方法准确性较高;批内、批间相对标准偏差均小于10%,说明方法精密度较好。
SN/T 1751.1—2006《动物源性食品中喹诺酮类药物残留检测方法》的第一部分使用的方法是微生物抑制法。微生物法灵敏度高、结果准确,但也有许多局限性,如整个实验周期长,批次间检测结果重复性差,检测结果受样品中所含抗喹诺酮类药物或抗生素成分的影响等。由于某些不可避免的人为误差,不同批次的ELISA试剂盒在制作过程中很难保证质量完全一致,而本实验研制的喹诺酮类药物检测试剂盒的批内、批间相对标准偏差均小于10%,重现性较好。
由于酶联免疫试剂盒的试剂(尤其是酶)会受到温度的影响,保存温度的过高或过低都会对其质量产生影响,因此稳定性测试是评价试剂盒质量的一个重要方面[14-15]。本实验通过分析该试剂盒在不同温度下的保存时间,结果表明,当试剂盒在4℃条件下保存12个月,在37℃条件下保存7d,测定的最大光密度值(零标准)、50%抑制浓度、喹诺酮类药物添加回收率均在正常范围之内,验证了该试剂盒具有良好的稳定性。
[1]夏昆华,周 鲁,郝丽芬.喹诺酮类抗生素的研究进展[J].国外医药抗生素分册,2004,25(3):138-141.
[2]郑 晶,黄晓蓉,郑俊超,等.微生物抑制法与酶联免疫法检测鳗鱼中喹诺酮类药物残留的比较研究[J].中国卫生检验杂志,2006,16(1):79-81.
[3]刘 嫒,谢孟峡,丁 岗,等.高效液相色谱同时测定鸡蛋中4 种氟喹诺酮类药物残留.分析化学,2004,23(3):352-355.
[4]李剑男,鲁润华.动物用氟喹诺酮类药物的研究进展概况.中兽医医药杂志,2004(6):19-23.
[5]杨 方,庞国芳,刘正才,等.液相色谱-串联质谱法检测水产品中15种喹诺酮类药物残留量[J].分析试验室,2008,27(12):27-33.
[6]赵银丽,张改平,邓瑞广,等.恩诺沙星多克隆抗体制备及阻断ELISA检测方法的研究[J].河南工业大学学报:自然科学版,2008,29(5):63-70.
[7]何桂华,李晓明,张爱霞,等.动物产品中4 种喹诺酮药物残留同时测定的全自动固相萃取技术研究[J].现代科学仪器,2008(3):23-25.
[8]曹 鹏,田德金,李佩暖,等.UPLC/MS/MS 测定动物组织中4 种氟喹诺酮类药物残留量[J].检验检疫科学,2008,18(4):48-50.
[9]孙 雷,朱馨乐,刘 琪,等.猪肉组织中7 种氟喹诺酮类药物残留检测高效液相色谱-串联质谱法研究[J].中国兽药杂志,2008,42(3):12-15.
[10]郑宗林,唐 俊,喻文娟,等.RP-HPLC 法测定中华绒螯蟹主要组织中的恩诺沙星及其代谢产物[J].上海水产大学学报,2006,15(2):156-162.
[11]杜黎明,卫洪清,张俊燕,等.反相高效液相色谱法同时测定6 种氟喹诺酮类药物[J].色谱,2003,21(5):503-506.
[12]孙良娟,李红权,刘益锋,等.高效液相色谱-电喷雾串联质谱法测定水产品中14 种喹诺酮类与磺胺类药物残留[J].化学试剂,2012(7):633-636.
[13]李佐卿,倪梅林,俞雪钧,等.液相色谱-串联质谱法检测水产品中磺胺类和喹诺酮类药物残留[J].分析测试学报,2007,26(4):508-510.
[14]王永明,黄耀凌,王鹤佳,等.链霉素酶联免疫检测试剂盒的稳定性研究[J].中国兽药杂志,2007,41(7):23-24,31.
[15]唐伟国.医学检验诊断试剂的制备与应用[M].上海:上海科技文献出版社,1996.

