硫酸软骨素酶ABC-PLGA缓释微球处理去细胞同种异体神经移植修复大鼠坐骨神经
于光明,王 伟,张 力,张德龙
1辽宁医学院,辽宁锦州 121001;2锦州市中心医院,辽宁锦州 121013
硫酸软骨素酶ABC-PLGA缓释微球处理去细胞同种异体神经移植修复大鼠坐骨神经
于光明1,王 伟2,张 力2,张德龙1
1辽宁医学院,辽宁锦州 121001;2锦州市中心医院,辽宁锦州 121013
目的探讨硫酸软骨素酶ABC(chondroitinase ABC,ChABC)-聚乳酸-聚乙醇酸共聚物缓释微球处理改良化学法去细胞同种异体神经移植修复大鼠坐骨神经的可行性。方法用复乳法制备硫酸软骨素酶ABC-聚乳酸-聚乙醇酸共聚物缓释微球。取成年雄性SD大鼠40只,随机分为4组(n=10):硫酸软骨素酶ABC-聚乳酸-聚乙醇酸共聚物缓释微球处理改良化学法去细胞同种异体神经移植组(A组)、自体神经移植组(B组)、改良化学法去细胞同种异体神经浸泡ChABC神经移植对照组(C组)、改良化学法去细胞同种异体神经移植09%氯化钠注射液对照组(D组)。取A、C、D 3组动物人工切取右侧坐骨神经10 mm,用改良化学法制备移植神经段:A、C两组浸泡在PBS液中,D组浸泡在含2 U/ml ChABC的PBS液(pH 7.4)中。A组动物取C组制备神经行同种异体神经移植,外膜无张力缝合,并在移植神经段距近心端缝合处2 mm、4 mm、6 mm、8 mm处分别注入0.2 μl制备好的硫酸软骨素酶ABC-PLGA缓释微球。B组在右侧离断10 mm坐骨神经倒置后行外膜缝合。C组取D组制备神经行神经移植。D组取A组制备神经行神经移植后,按照A组的位置注入等量等渗0.9%氯化钠注射液。术后4、8、12周进行大体标本观察,术后12周行电生理检测、HE染色、镀银染色及电镜组织学检测、图像分析对比。结果制备所得硫酸软骨素酶ABC微球表面光滑,球体大小各异且均匀,无粘连及成簇等现象,Weibull方程曲线显示硫酸软骨素酶ABC微球体外释药稳定。采用硫酸软骨素酶ABC-聚乳酸-聚乙醇酸共聚物缓释微球处理改良化学法去细胞同种异体神经移植能够促进大鼠神经缺损处的轴突再生,提高神经修复的速度和质量,再生神经直径较粗,粘连较轻,电生理检测和组织学观察显示各项指标均优于两对照组,且较两对照组修复效果更接近于自体神经移植。结论硫酸软骨素酶ABC-聚乳酸-聚乙醇酸共聚物缓释微球处理改良化学法去细胞同种异体神经移植可以修复大鼠神经损伤。
周围神经损伤;硫酸软骨素酶ABC;化学去细胞异体神经;大鼠
周围神经损伤后的轴突再生和功能恢复一直是外科棘手问题。有研究表明硫酸软骨素酶ABC(chondroitinase ABC,ChABC)能够去除硫酸软骨素蛋白多糖(chondroitin sulfate proteoglycans,CSPG)对神经再生的抑制作用,而针对硫酸软骨素酶ABC在体内易失活的特点将其制备成缓释微球,可以更好地发挥作用。本实验采用改良化学法去细胞同种异体神经(freeze-thrawed combined optimized acellular nerve,FTOAN)作为神经再生的三维支架,硫酸软骨素酶ABC缓释微球去除神经再生的抑制因素,观察神经再生及修复情况。
材料和方法
1 实验动物 成年雄性SD大鼠40只,体质量(240±20) g。由辽宁医学院动物饲养中心提供(动物许可证号:SCXK[辽]2009-0004)。
2 主要试剂和仪器 聚乳酸-聚乙醇酸共聚物(50∶50,6046,光华伟业实业有限公司),硫酸软骨素酶ABC、超速离心机(美国Sigma公司),PBS缓冲液(珠海东大生物制品公司),Tritonx-200(上海谷研生物科技有限公司),聚乙烯醇(北京金鼎汉克科技发展有限公司),低速离心机(日本KUBOTA公司),分光光度计、扫描电镜(德国BECKMAN公司),AS 325多功能切片机、Histocetre 2包埋机(英国SHANDON公司),光学显微镜(日本NIKON公司)等。
3 硫酸软骨素酶ABC-聚乳酸-聚乙醇酸共聚物缓释微球的制备 参考张德盛等[1]方法,将聚乳酸-聚乙醇酸共聚物加入二氯甲烷(CH2Cl2)中,溶解后室温下匀化成油相。将硫酸软骨素酶ABC溶于双蒸水后成水相,将后者加入上述油相中超声匀化形成初乳。取聚乙烯醇和NaCl,加入双蒸水,50℃水浴溶解,冷却后加入初乳中,超声匀化形成复乳。加入5%聚乙烯醇溶液,高速搅拌至乳化完全后,继续在室温下低速搅拌至CH2Cl2挥发完全,高速离心分离微球,用冷无菌三蒸水洗涤-离心共5次,常规冻干保存。观测硫酸软骨素酶ABC微球的形态,硫酸软骨素酶ABC微球载药量与包封率,硫酸软骨素酶ABC微球的体外释药曲线。
4 实验分组 实验动物按随机原则分为4组,每组10只。A组为硫酸软骨素酶ABC-聚乳酸-聚乙醇酸共聚物缓释微球处理改良化学法去细胞同种异体神经移植组,B组为自体神经移植组,C组为改良化学法去细胞同种异体神经浸泡ChABC神经移植对照组,D组为改良化学法去细胞同种异体神经移植等渗0.9%氯化钠注射液对照组。
5 神经移植段的制备 参考秦长江等[2]改良化学去细胞方法处理坐骨神经。取A、C、D 3组30只动物,无菌、麻醉条件下在右侧股后部正中切口,手术显微镜下解剖坐骨神经,将坐骨神经锐性切断,长度为10 mm,将两断端神经外膜用9-0无损伤缝合线缝于周围组织防止回缩。将切取的神经用液氮反复冻融3次,随后使用含SB-10的PBS液和含SB-16、Tritonx-200的PBS液进行化学处理2次后,放入4℃无菌PBS液(pH 7.2),以组为单位分别暂时保存。D组制备神经浸泡在含2 U/ml ChABC的PBS液(pH 7.4)中。
6 动物模型建立 使用10%水合氯醛腹腔注射(30 mg/kg)麻醉后,在无菌操作下A组神经缺损处取C组制备神经行异体神经移植,端端无张力外膜缝合。并在移植神经段距近心端缝合处2 mm、4 mm、6 mm、8 mm处分别注入0.2 μl制备好的硫酸软骨素酶ABC-PLGA缓释微球,逐层关闭切口缝合。B组分离切断右侧坐骨神经10 mm,倒置后行外膜缝合。C组神经缺损处取D组制备神经行异体神经移植。D组神经缺损处取A组制备神经行异体神经移植,并按照A组的位置注入等量等渗0.9%氯化钠注射液。术后每天给予庆大霉素4×104U肌注,连续3 d预防感染。动物分笼饲养,不限制活动。
7 电生理检测 术后12周用肌电图仪进行检测,刺激电极置于吻合口近侧坐骨神经,记录电极置于胫前肌,记录神经肌肉动作电位,比较运动神经传导速度、潜伏期和波幅。在坐骨切迹插入刺激电极,在胫前肌插入记录电极。记录神经干动作电位波形,测定潜伏期、波幅、神经传导速度以及再生神经轴突面积(刺激参数:细电压、单刺激、波宽0.3 ms、延时0.5 ms、刺激强度1.5 V)。每隔1 min重复电刺激,3次取平均值。

8 组织学观察 术后观察各组动物神经吻合口有无膨大或神经瘤形成、移植体及近远端神经颜色光泽、与周围组织有无粘连等。术后12周各组行电镜组织学观察再生神经纤维情况。取两端神经移植段吻合口的组织,置于20%甲醛固定液中固定7 d后,脱水,石蜡包埋,4 ~ 6 μm半薄切片,行苏木精-伊红(HE)染色。
9 统计学分析 采用SPSS18.0统计软件进行统计处理,所有实验室据用表示,多组间比较用单因素χ2分析,两组间比较用LSD法进行显著性检测。P<0.05为差异有统计学意义。
结 果
1 微球制备情况 扫描电镜下观察,硫酸软骨素酶ABC微球表面光滑,球体大小各异且均匀,无粘连及成簇等现象(图1)。硫酸软骨素酶ABC微球的载药量、包封率及体外释药:共制得4批硫酸软骨素酶ABC微球,平均载药量(14.30±1.75)×10-3%,平均包封率(53.73±0.94)%,硫酸软骨素酶ABC微球在3周内的体外累积释药分数为0.863 5,释药平稳。见图2。
2 动物手术部位观察 术后12周观察手术部位。B组神经断端无明显神经瘤形成,移植段神经颜色接近正常,与周围组织基本无粘连。A、C、D 3组神经断端处均有再生神经纤维通过,A组较另外两组再生神经直径粗,其中D组与周围组织粘连较其他两组重,3组均未出现明显的免疫排斥反应。见图3。
3 电生理检测 B组传导速度、再生轴突横切面积等检测指标恢复均最明显。A组恢复较好,但相较于B组有一定差距。C、D两组恢复滞后,D组略好于C组。A、B两组较C、D两组再生神经恢复率、再生神经传导速度恢复率明显提高(P<0.05),见表1、表2。
4 组织学观察 术后12周4组神经移植段HE染色均只有少量的淋巴细胞浸润。结合镀银染色可见B组纵切片大量排列整齐的波浪状纤维,横切片可见再生神经轴突排列整齐、密集,呈中央或小束状分布,束间有少量疏松结缔组织充填,可见有微小血管分布。A组再生神经纤维排列规则,与B组相似,但较B组稀疏,其他表现基本相同。C、D两组再生神经轴突较少,银复染再生的神经纤维不如A、B两组丰富。见图4。
表1 各组动作电位的潜伏期、波幅和传导速度比较Tab. 1 Com parison of the incubation period, am plitude and conduction velocity of each group action potential (, n=10)

表1 各组动作电位的潜伏期、波幅和传导速度比较Tab. 1 Com parison of the incubation period, am plitude and conduction velocity of each group action potential (, n=10)
a P<0.05, vs Group A; b P<0.05, vs Group A
Group Latency (ms)Amplitude (mV)MCV (m/s) A 0.809±0.024 0.197±0.030 71.766±1.693 B 0.817±0.021 0.211±0.029 72.581±2.174 C 1.008±0.035a 0.138±0.027a 59.567±1.882a D 1.114±0.019b 0.122±0.013b 57.243±0.982b
表2 各组再生轴突横切面积、再生神经恢复率、再生神经传导速度恢复率比较Tab. 2 Com parison of regeneration of axons crosscutting area, regeneration of nerve recovery rate and recovery rate of regeneration of nerve conduction speed (, n=10)
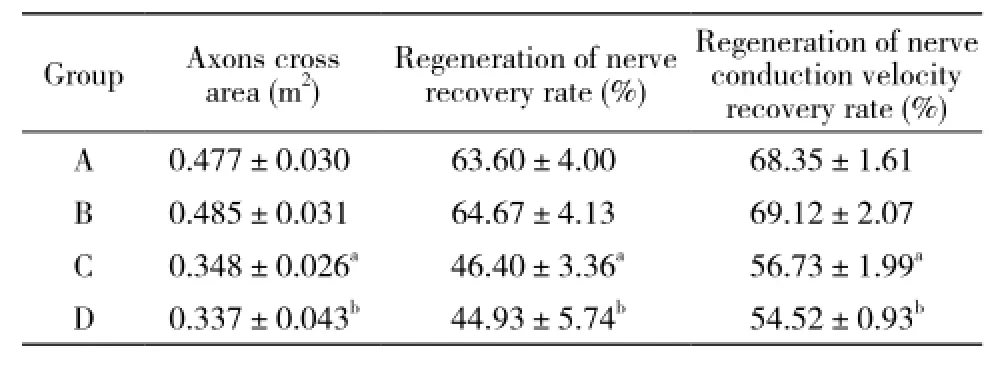
表2 各组再生轴突横切面积、再生神经恢复率、再生神经传导速度恢复率比较Tab. 2 Com parison of regeneration of axons crosscutting area, regeneration of nerve recovery rate and recovery rate of regeneration of nerve conduction speed (, n=10)
a P<0.05, vs Group A; b P<0.05, vs Group A
Group Axons cross area (m2)Regeneration of nerve recovery rate (%) Regeneration of nerve conduction velocity recovery rate (%) A 0.477±0.030 63.60±4.00 68.35±1.61 B 0.485±0.031 64.67±4.13 69.12±2.07 C 0.348±0.026a 46.40±3.36a 56.73±1.99a D 0.337±0.043b 44.93±5.74b 54.52±0.93b

图 1 扫描电镜下硫酸软骨素酶ABC微球形态Fig. 1 Scann ing electron m icroscope examination o f the chondroitinase ABC m icrospheres
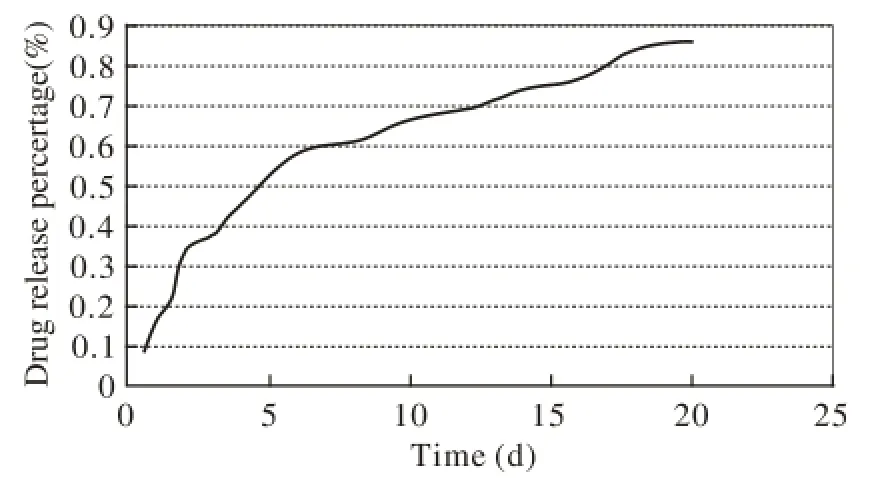
图 2 硫酸软骨素酶ABC微球累积释药分数的W eibull方程拟合曲线Fig. 2 Cu rve fitting o f cum u lative d rug release ratio o f chondroitinase ABC microspheres with Weibu ll equations

图 3 术后12周大鼠坐骨神经Fig. 3 Sciatic nerve of rats
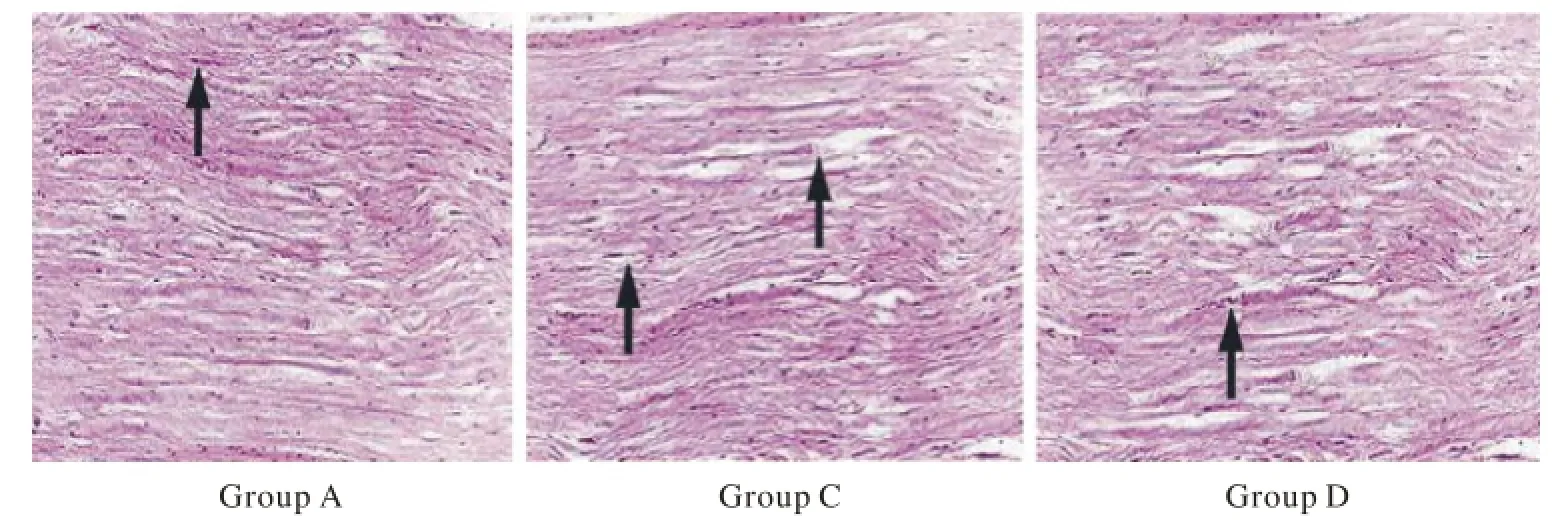
图 4 术后12周大鼠坐骨神经HE染色,箭头示郎飞结(×100)Fig. 4 Sciatic nerve HE staining of rats, arrow node of Ranvier(×100)
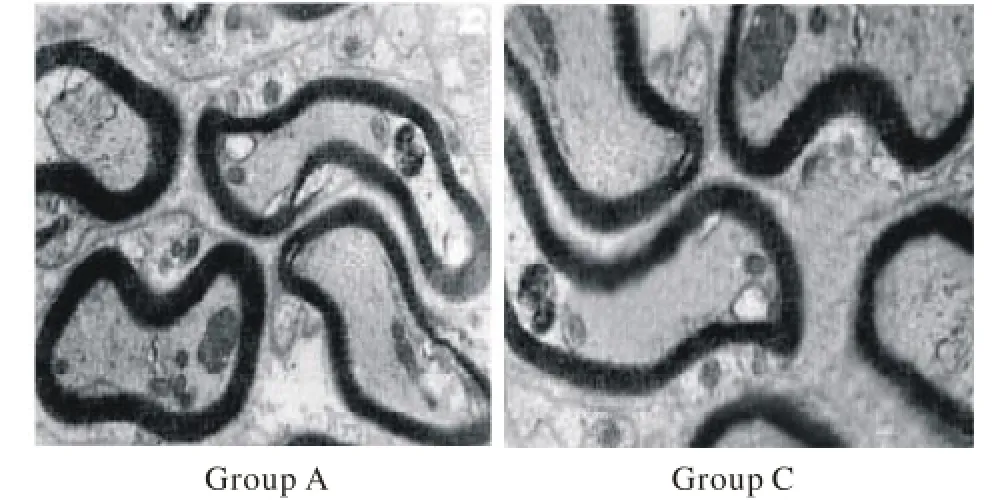
图 5 术后12周扫描电镜下大鼠坐骨神经雪旺细胞(×8 000)Fig. 5 Schwann cells in sciatic nerve in rats under the SEM (×8 000)
5 超微结构观察 术后12周A、B两组电镜下可见再生有髓轴突排列均匀密集,无髓神经轴突散在分布,雪旺细胞(Schwann cell,SC)胞核明显,轴突内有线粒体、突触小泡等细胞器,有突触间隙和突触皱襞形成,再生神经纤维聚集成束,外包有神经束膜。C、D两组再生神经轴突粗细不等,无髓纤维比有髓纤维多见,轴突之间可见一个或多个未成熟的雪旺细胞,髓鞘薄,线粒体不丰富。见图5。
讨 论
周围神经损伤后的治疗与康复,历来是创伤外科的重要研究课题。回顾周围神经损伤修复的发展历史,大致可以分为3个阶段:第1阶段是神经损伤处的机械与力学对合,强调神经缝合处不能有张力,以免在缝合处断端形成瘢痕,阻碍轴突的再生;第2阶段是显微外科技术在周围神经损伤修复中的应用,由于在手术显微镜下可以清楚地看到神经束的形态,从而使相同功能的神经束得以精确对合,即“神经束间缝合”;第3阶段由于神经生理学和神经分子生物学技术的发展、众多神经营养因子和神经趋化因子的发展与实验研究,阐明了上述各种因子在周围神经损伤后再生中的作用及神经损伤后再生的机制,从而使周围神经损伤的治疗与康复成为可能。
自体神经移植被认作周围神经损伤修复的“金标准”,虽然术后效果最佳,但不可避免的需要损伤自身其他相对次要神经支。同理,用相似方法比如吻合血管、肌肉的神经移植术也会损伤相应组织。故异体神经移植表现出强大的研究发展空间。异体神经移植的最大障碍就是异体组织的免疫排斥反应。所以20世纪以来,学者们采用各种方法来降低移植体的抗原性并一一做了深入研究,实验室效果令人满意。
降低异体神经抗原性方法较多,冷冻法、化学法、辐照法、药物处理以及甘油处理等方法,效果各有不同[3-6]。本实验参考秦长江等[2]、王伟等[1]的方法结合冻融和化学方法的优点制备去细胞异体神经,冻融处理后的神经其SC和髓鞘已破坏,降低了免疫原性,并完整保留了基底膜,再用化学试剂去除已崩解的SC及其髓鞘,进一步降低了免疫原性,并最大限度保留基底膜成分。实验结果表明没有明显的免疫排斥反应,效果较为理想。本实验应用此方法在操作过程及结果中均未出现明显的免疫排斥反应,神经移植段与周围组织粘连较轻,且仅有少量炎性细胞浸润。此方法在本实验中效果明显并达到预期效果,也进一步验证了此方法的可靠性。
研究表明利用化学法可有效去除同种异体神经中的雪旺细胞,降低移植宿主的免疫反应,同时保留较完整的细胞外基质,主要包括层粘连蛋白、纤维粘连蛋白、硫酸软骨素蛋白多糖等。虽然层粘连蛋白、纤维粘连蛋白有促进轴突再生的作用,但越来越多的证据表明CSPG能够抑制神经轴突生长,有抑制细胞外基质、促进神经再生的作用[7]。如何增加周围神经损伤后胞外基质中促进轴突再生的分子,去除抑制分子,对于神经的再生具有重要的意义。周围神经系统中含有丰富的CSPG,CSPG由多种核心蛋白和与核心蛋白相连的葡糖胺聚糖(glucosaminoglycan,GAG)侧链组成,当其结构完整时,才能抑制神经生长,因此分解其GAG侧链或溶解其核心蛋白都会消除这种抑制作用。硫酸软骨素酶ABC因其酶解作用部位的高度特异性和局限性,且生物相容性好、不良反应小,已用于脊柱等局部药物治疗的临床研究中[8]。
硫酸软骨素酶ABC是一种细菌胞外酶,它能特异性消化CSPG的GAG链,保留其蛋白核心。用ChABC消化GAG侧链后,体外培养的神经元在CSPG底物上延伸轴突的能力明显提高[9-10]。有学者通过实验证实ChABC可降解CSPG,促进神经再生。并有研究表明,神经套接实验中应用ChABC可以适当延长神经断端间隙长度[11]。硫酸软骨素酶ABC在体内容易失活,需局部长期用药,目前采用的用药方式均有不足之处。而缓释微球这种给药方式已经广泛应用于各种试验当中,是一种长期给药的良好途径。制备缓释微球的过程中,首先要考虑的是预期的微球释药时间。时间太短或太长都不能发挥药物效能,失去使用此方法的意义。针对神经损伤区CSPG其核心蛋白表达在14 d达峰值,糖胺多糖链持续时间达损伤后40 d以上的特点制备缓释微球,能够更好地去除掉胞外基质中的CSPG,有效地促进神经的再生和修复[12]。王红辉等[13]用甲壳素桥接神经断端后,在管内注入ChABC-PLGA,表明硫酸软骨素酶ABC具有促进周围神经再生的作用。本实验中应用ChABC缓释微球,体外检测药物释放的高峰值为3周左右,能够针对CSPG的特点发挥效力。A组应用硫酸软骨素酶ABC缓释微球处理移植神经段,去除CSPG程度最高、最彻底;而C组使用硫酸软骨素酶ABC浸泡移植神经段,虽部分去除CSPG,但程度不高且不够彻底。实验结果也表明应用ChABC缓释微球组神经生长速度、轴突再生能力均优于未使用的阴性对照组。实验证明了ChABC能够提高轴突的生长速度,有效地促进周围神经的再生修复和功能恢复。
综上所述,本实验采用改良化学法制备同种异体神经进行大鼠坐骨神经移植,未出现明显免疫排斥反应。应用硫酸软骨素酶ABC-聚乳酸-聚乙醇酸共聚物缓释微球组较未使用组,神经再生及修复的速度和质量均明显提高。
1 张德盛,钟德君,宋跃明,等.硫酸软骨素酶ABC-聚乳酸-聚乙醇酸共聚物缓释微球的制备及其体外性质[J].中国组织工程研究与临床康复,2008,12(32):6247-6250.
2 秦长江,王伟,李宏义,等.改良去细胞同种异体神经移植后免疫反应的观察[J].中国医学工程,2006,14(4):340-343.
3 Fox IK, Jaramillo A, Hunter DA,et al. Prolonged cold-preservation of nerve allografts[J]. Muscle Nerve, 2005, 31(1): 59-69.
4 Niapour A, Karamali F, Karbalaie K,et al. Novel method to obtain highly enriched cultures of adult rat Schwann cells[J]. Biotechnol Lett, 2010, 32(6): 781-786.
5 Zhang LX, Tong XJ, Sun XH,et al. Experimental study of low dose ultrashortwave promoting nerve regeneration after acellular nerve allografts repairing the sciatic nerve gap of rats[J]. Cell Mol Neurobiol, 2008, 28(4): 501-509.
6 连霄飞,王伟,张力,等.他克莫司与肌源性干细胞联合应用对去细胞异体神经支架移植后神经再生和修复作用的影响[J].中国组织工程研究与临床康复,2010,14(3):389-392.
7 Muir D. The potentiation of peripheral nerve sheaths in regeneration and repair[J]. Exp Neurol, 2010, 223(1): 102-111.
8 Chiba K, Masuda K, Andersson GB,et al. Matrix replenishment by intervertebral disc cells after chemonucleolysis in vitro with chondroitinase ABC and chymopapain[J]. Spine J, 2007, 7(6):694-700.
9 赵斌,王玉,彭江,等.软骨素酶ABC处理化学去细胞异体神经后的形态学观察[J].中国矫形外科杂志,2010,18(18):1547-1549.
10 于海龙,彭江,卢世璧,等.软骨素酶ABC去除化学去细胞神经中硫酸软骨素蛋白多糖[J].神经损伤与功能重建,2012,7(1):19-23.
11 于海龙,彭江,卢世璧,等.软骨素酶ABC 增加化学去细胞异体神经修复神经缺损长度的实验研究[J].中华临床医师杂志:电子版,2011,5(19):5604-5607.
12 Iaci JF, Vecchione AM, Zimber MP,et al. Chondroitin sulfate proteoglycans in spinal cord contusion injury and the effects of chondroitinase treatment[J]. J Neurotrauma, 2007, 24(11):1743-1759.
13 王红辉,陈清汉,杨延良.硫酸软骨素酶ABC(chABC)对大鼠坐骨神经损伤后神经再生功能的实验研究[J].中国实用神经疾病杂志,2011,14(3):21-23.
Repairing sciatic nerve in rats by acellular allogeneic nerve transplantation treated with chondroitinase ABC-PLGA microspheres
YU Guang-ming1, WANG Wei2, ZHANG Li2, ZHANG De-long1
1Liaoning Medical University, Jinzhou 121001, Liaoning Province, China;2Jinzhou Central Hospital, Jinzhou 121013, Liaoning Province, China
Corresponding author: WANG Wei. Email: W eiw ang_Ly@yahoo.com.cn
ObjectiveTo investigate the feasibility of repairing sciatic nerve in rats by acellular allogeneic nerve transp lantation treated with chondroitinase ABC-PLGA m icrospheres.MethodsChondroitinase ABC-PLGA m icrospheres w ere prepared by double emulsion methods. Forty adult male SD rats were randomly selected and divided into four groups (n=10): freeze-thrawed combined optim ized acellular nerve (FTOAN) group treated with chondroitinase ABC-PLGA m icrospheres (Group A), autologous nerve transp lantation group (Group B), FTOAN soaking chondroitinase ABC group (Group C), FTOAN treated with normal saline group (Group D). Ten m illimeters of nerve from the right sciatic nerve of animals in three groups (Group A, C, D) was artif cially cut and transp lanted with FTOAN. Group A and C w ere soaked in PBS, w hile group D w ere soaked in PBS solution containing 2 U/ml ChABC (pH 7.4). Preparation line nerve of group C was taken by animals in group A and allograft nerve grafts were taken in both two groups, the outer membrane was sutured without tension, and preparated chondroitinase ABC-PLGA m icrospheres accounting for 0.2 µl was injected in the transp lanted neural segments from the seam s of proximal part of 2 mm, 4 mm, 6 mm, 8 mm respectively.Outer membrane suture w as taken by group B on the right side of 10 mm broken sciatic nerve after inversion. Preparation line nerve of group D w as taken by animals in group C and nerve-grafting w as taken in both tw o groups. Group D made allograft nerve grafts with preparation line nerve of group A, and equal amount of isotonic saline w as injected according to the position of group A. Gross specimen was observed 4,8,12 w eeks after operation. Electrophysiological detection, HE staining, silver staining, electron m icroscope histological detection and image analysis w ere compared 12 w eeks after operation.ResultsThe preparated chondroitinase ABC m icrospheres had smooth surface and sphere uniform sizes, and no adhesion and clusters w ere found. W eibull equation curve show edthe stability of in vitro release of chondroitinase ABC-PLGA microspheres. The axonal regeneration of neural defect in rats could be promoted by freeze-thrawed combined optim ized acellular nerve group treated with chondroitinase ABC-PLGA microspheres, the quality and speed of nerve repairing were also improved. The regeneration nerve was thicker in diameter and lighter in adhesion.Electrophysiological detection and histology observation showed that all indicators were better than the two compared groups, and also the repair effect was much closer to autologous nerve grafts.ConclusionFreeze-thrawed combined optimized acellular nerve group treated with chondroitinase ABC-PLGA microspheres can repair the nerve injury in rats.
peripheral nerve injury; chondroitinase ABC; chem ically acellular nerve allograft; rats
R 617
A
2095-5227(2014)08-0858-05
10.3969/j.issn.2095-5227.2014.08.023
2014-04-25 08:34
http://www.cnki.net/kcms/detail/11.3275.R.20140425.0834.001.html
2013-11-25
于光明,男,在读硕士。研究方向:周围神经损伤修复。Email: 786741601@qq.com
王伟,男,博士,出站博士后,教授。Email: Weiwang_Ly@yahoo.com.cn

