鲜生地(冻干粉)对肝损伤模型大鼠肠生物屏障的影响*
李晨龙,贾建伟,李秋伟
(1.天津中医药大学,天津 300193;2.天津市第二人民医院中西医结合Ⅰ科,天津 300192)
鲜生地(冻干粉)对肝损伤模型大鼠肠生物屏障的影响*
李晨龙1,贾建伟2,李秋伟2
(1.天津中医药大学,天津 300193;2.天津市第二人民医院中西医结合Ⅰ科,天津 300192)
[目的]探讨鲜生地(冻干粉)对肝损伤模型大鼠肠生物屏障的影响。[方法]采用Pringle’s maneuver法制作大鼠肝缺血再灌注损伤模型。将64只实验大鼠随机分为假手术组、模型组、鲜生地(冻干粉)组及乳果糖组。观察大鼠粪便球杆菌比例、菌落培养,测定血清内毒素水平。[结果]鲜生地组、乳果糖组粪便中益生菌增加,大肠杆菌减少,血清内毒素水平降低。[结论]鲜生地能够调节肠道菌群,降低血内毒素水平,可能通过改善肠生物屏障,使肝细胞得到恢复。
鲜生地;肝损伤;生物屏障
中药生地具有清热凉血、养阴生津之功效。鲜生地质更润,清热凉血、养阴生津作用更强。在之前的鲜生地系列研究中发现,鲜生地能改善慢性重型肝炎早/中期(营分证)患者腹胀、口干、烦热等症状,降低患者血清内毒素(ET)水平,减轻内毒素血症对肝脏的“二次打击”[1],并对其降低内毒素血症的机制进行了探讨。本研究拟建立大鼠肝损伤模型,以乳果糖为对照,观察鲜生地(冻干粉)对肝损伤模型大鼠肠生物屏障的影响。
1 材料与方法
1.1 药品及试剂 鲜生地由河南武陟县采购,真空冻存保鲜,去皮后榨汁制备成冻干粉冷藏备用。乳果糖由北京韩美药品有限公司提供。内毒素测定试剂盒由上海医学实验所提供。双歧杆菌培养基(TPY)、乳酸杆菌培养基(MRSA)、大肠杆菌培养基(EMB)由北京奥博星生物技术有限责任公司提供。
1.2 实验动物与分组 清洁级SD大鼠64只(天津市山川红实验动物科技有限公司提供),体质量200~220 g,饲养环境温度20~25℃、湿度55%~65%,每日光照12 h。应用随机数字表法将大鼠随机分为假手术组、模型组、鲜生地(冻干粉)组(简称鲜生地组)和乳果糖组4组,每组16只,雌雄各半。给药3 d后造模,手术前禁食12 h,自由饮水。每日上午9:00和下午4:00,假手术组、模型组按7.5 mL/kg生理盐水灌胃,给药组分别给予7.5 mL/kg相应药物灌胃,处死前1 d停药。于24 h、48 h两个时点各组取8只大鼠,留取标本后处死。
1.3 模型制作 采用Pringle’s maneuver法[2]建立大鼠肝缺血再灌注损伤模型(HIRI)。腹腔注射10%水合氯醛(3 mL/kg)麻醉,经上腹正中斜切口,解剖肝—十二指肠韧带,除假手术组外,其余组用无创血管夹夹闭第一肝门部(包括肝动脉、门静脉和胆管)。夹闭期间,间断向腹腔注射总量约15~20 mL/kg等渗盐水,以预防或减轻在松开动脉夹后出现的一过性低血容量反应,30 min后取出血管夹,恢复血供。造模成功标志为夹闭后肝脏缺血颜色变深、肿胀,肠管瘀血,颜色变深;松开血管夹恢复血运,肝脏及肠管颜色逐渐恢复。腹部切口缝合。分别于再灌注后24 h、48 h麻醉下腹腔切开,收集结肠内粪便、采集门静脉血。
1.4 粪便涂片检测 采用无菌容器留取新鲜粪便,取无菌棉签挑取粪便以30°~40°角均匀速度推片,面积约1.0 cm×2 cm~1.5 cm×2 cm左右,待自然干燥后固定,行革兰染色,在100(物镜)×10(目镜)倍油镜下观察记录。观察革兰阳性杆菌(G+b)、革兰阴性杆菌(G-b)、革兰阳性球菌(G+c)、革兰阴性球菌(G-c)比例。
1.5 细菌培养 采集新鲜粪便标本2份分别置入无菌试管和无氧试管立即送细菌室,取新鲜粪便0.2 g加入0.9 mL的生理盐水,在振荡器上使之匀浆,标本按10倍连续稀释法至10-9,分别取10-1、10-3、10-5、10-7、10-9稀释液0.01 mL分别接种于用于选择性培养基上。选择具有代表性的大肠杆菌(E.coli)、乳酸杆菌(LB)及双歧杆菌(BB)的选择性培养基进行培养。每种稀释度接种3滴,计数时取其菌落的平均数。将MRSA、TPY培养基置入厌氧罐中,放入厌氧产气袋封闭,再放入37℃的孵育箱中培养48h,将EMB培养基直接放在37℃孵育箱中培养24 h,即可完成。结果以每克粪便湿质量中菌落形成单位的对数值表示(log CFU/g)。每mL标本中活菌集落单位即公式CFU/mL=(标本质量+稀释度)/标本质量×稀释度×菌落个数(或×10)(稀释度即稀释倍数)。
1.6 ET测定 由大鼠门静脉取血2mL,用干燥无热源肝素试管收集血液,1 h内分离血清,置于-70℃冻存待测定。采用终点显色法检测。
1.7 统计学处理 采用SPSS 18.0软件对数据进行处理,计量资料以均数±标准差(±s)表示。多组计量资料的组间比较采用单因素方差分析,多组率的比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 粪便球杆菌比例 一般情况下,大鼠球/杆比约为25∶75(即1∶3),将球/杆比≤1∶3定为比例正常,球/杆比>1∶3定为比例失调。实验结果显示,鲜生地组、乳果糖组与模型组比较,球/杆比例失调的大鼠减少,鲜生地组与乳果糖组比较,球/杆比例失调例数无明显差异。见表1。由于各组大鼠较少,各组间χ2检验结果无统计学差异。

表1 各组大鼠球/杆比例比较Tab.1 Comparison of the ratio between cocci and bacilli in rats’feces 只(%)
2.2 粪便双歧杆菌、乳酸杆菌及大肠杆菌菌落 与假手术组比较,模型组大肠杆菌明显升高,乳酸杆菌、双歧杆菌减少,差异具有统计学意义(P<0.01)。鲜生地组、乳果糖组与模型组比较,大肠杆菌、乳酸杆菌、双歧杆菌的差异具有统计学意义(P<0.05),鲜生地组与乳果糖组比较,差异无统计学意义(P> 0.05)。见表2。
表2 各组大鼠肠道3种细菌的菌落比较(±s)Tab.2 Comparison of three bacterial colonies in each group(±s) log CFU/g
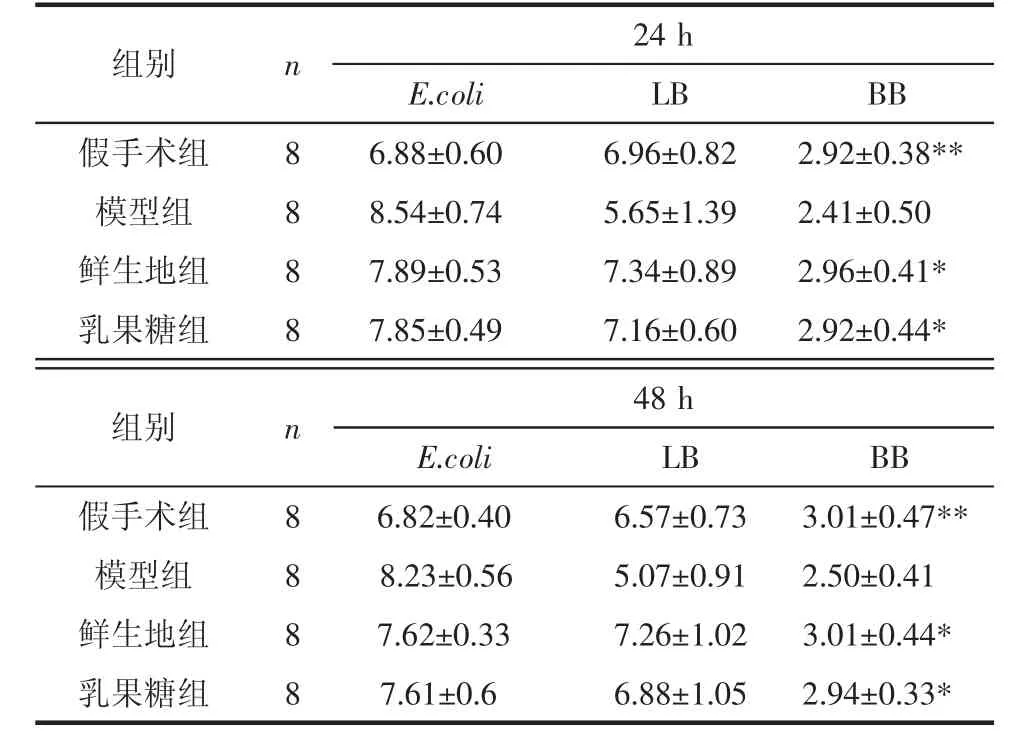
表2 各组大鼠肠道3种细菌的菌落比较(±s)Tab.2 Comparison of three bacterial colonies in each group(±s) log CFU/g
注:假手术组与模型组比较,**P<0.01;鲜生地组、乳果糖组与模型组比较,*P<0.05。
组别 n 24 h E.coli LB BB假手术组 8 6.88±0.60 6.96±0.82 2.92±0.38**模型组 8 8.54±0.74 5.65±1.39 2.41±0.50鲜生地组 8 7.89±0.53 7.34±0.89 2.96±0.41*乳果糖组 8 7.85±0.49 7.16±0.60 2.92±0.44*组别 n 48 h E.coli LB BB假手术组 8 6.82±0.40 6.57±0.73 3.01±0.47**模型组 8 8.23±0.56△5.07±0.91 2.50±0.41鲜生地组 8 7.62±0.33 7.26±1.02 3.01±0.44*乳果糖组 8 7.61±0.6 6.88±1.05 2.94±0.33*
2.3 各组大鼠内毒素检测结果 模型组大鼠门静脉血ET含量明显高于假手术组(P<0.01)。鲜生地组、乳果糖组与模型组比较,其含量明显降低,有统计学差异(P<0.05)。鲜生地组与乳果糖组比较,无统计学差异(P>0.05),见表3。
表3 各组大鼠ET含量比较(±s)Tab.3 Comparion of the ET level in each group(±s)EU/mL

表3 各组大鼠ET含量比较(±s)Tab.3 Comparion of the ET level in each group(±s)EU/mL
注:模型组与假手术组比较,**P<0.01;鲜生地组、乳果糖组与模型组相比,*P<0.05;鲜生地组与乳果糖组相比。
组别 n 24 h 48 h假手术组 8 0.056±0.013** 0.049±0.011**模型组 8 0.165±0.011 0.163±0.029鲜生地组 8 0.129±0.013* 0.103±0.007*乳果糖组 8 0.126±0.019* 0.113±0.015*
3 讨论
地黄为玄参科植物地黄新鲜或干燥的块根。现代药物成分研究表明[3]:水苏糖是地黄主要的有效活性成分之一,具有润肠通便、改善肠道微环境、增殖双歧杆菌、调节肠道微生态平衡、提高机体免疫力、调节内分泌等作用。生物屏障为对外来菌株有定植抵抗作用的肠内正常寄生菌群。肠道微生物为人体最大的细菌库,通常情况下,肠道内微生物群构成一个对抗病原体的重要的保护屏障。当微生态菌群的稳定性遭到破坏后,肠道定植抵抗力大为降低,可导致肠道中潜在性病原体(包括条件致病菌)的定植和入侵,亦可导致肠道内毒素大量生成。
慢性肝病时常伴有肠道菌群失调的发生,其原因可能与发病过程中肠蠕动减慢、内毒素血症、肠黏膜水肿、低蛋白血症等有关。吴仲文等[4]发现,慢性重型肝炎患者肠道菌群失调重于慢性肝炎患者,并认为肠道菌群失调的程度与肝炎病情严重程度相关。本实验中观察大鼠粪便标本中球/杆菌比例及重要菌株菌落计数等指标,一般不受粪便稀释或浓缩的影响,其结果具有较大临床意义,粪便标本直接涂片革兰氏染色观察细菌球/杆比是判断肠道细菌失调的一个重要指标[5]。本实验结果提示鲜生地、乳果糖在预防和治疗肠道菌群失调方面具有一定的作用。有研究表明,肠道菌群失调是肠道黏膜生物屏障受损的主要病因临床应用生地后可增加肠道益生菌,从而利于保护肠黏膜生物屏障改善[6]。
ET是G-细菌外层结构即磷脂双分子层结构,能够引发强烈炎性反应,它是革兰阴性杆菌致病的启动因子被认为是肝损伤发病机制的重要促进因素[7]。肝病患者长期持续存在的内毒素血症(ETM)[8-9],可加剧肝细胞损伤,促进肝纤维化过程,在肝炎重症化与慢性化中起着重要的作用[10-12]。本实验观察发现大鼠肝损伤后,门静脉血ET水平升高,并显著高于假手术组,鲜生地及乳果糖可改善内毒素血症。既往研究已证实鲜生地对肠道机械屏障有保护作用,可能通过机械屏障的保护改善了内毒素血症,本研究证实了鲜生地对生物屏障的调节作用,亦进一步表明了鲜生地改善内毒素血症的机制可能包括对肠生物屏障的调节。
[1]贾建伟,赵 洁,李秋伟,等.鲜生地对大鼠肠缺血再灌注损伤的防护作用[J].中西医结合肝病杂志,2008,18(6):362-364.
[2] Ito K,Ozasa H,Horikawa S.Effects of prior splenectomy on remnant liver after partial hepatectomy with Pringle maneuver in rat[J].Liver Int,2005,25(2):438-444.
[3]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2005:82-83.
[4]吴仲文,李兰娟,马伟杭,等.慢性重型肝炎患者肠道定植抗力变化的研究[J].中华肝脏病杂志,2001,9(6):329-331.
[5]Pardo A,Bartolf R,Lorenzo-Zuniga V,et al.Effect of eisapride on intestinalbacterialovergrowth and bacterialtranslocation in cirrhosis[J].Hepatology,2000,31(4):858-863.
[6] Schwiertz A,Jacobi M,Frick JS,et al.Microbiota in pediatric inflammatory bowel disease[J].J Pediatr,2010,7(15):67-74.
[7]高 敏,卢诚震,梁树人,等.血必净注射治疗肝硬化并发原发性腹膜炎疗效观察[J].天津中医药大学学报,2009,28(3):122-124.
[8]陈 鹏,曹武奎.热毒清对急性肝损伤大鼠内毒素血症的影响[J].天津中医药,2013,30(4):228-230.
[9]汪承柏.重视慢性干预内毒素血症的防治[J].中西医结合肝病杂志,2001,11(4):193-194.
[10]刘剑华.厚朴三物汤加味治疗慢性重型肝炎内毒素血症的疗效观察[J].天津中医药,2009,26(3):195-196.
[11]Bourlioux P,Koletzko B,Guarner F,et al.The intestine and its mieroflora are partners for the protection of the host:report on the Danone Symposium’The Intelligent Intestine’,held in Paris,June 14,2002[J].Am J Clin Nutr,2003,78(4):675-683.
[12]Ding LA,Li YS,Li YS,et al.Intestinal barrier damage caused by trauma and Lipopolysaeeharide[J].World J Gastmenterol,2004,10 (16):2373-2378.
Effect of fresh rehmannia(freeze-dried)on intestinal biological barrier in rats with liver injury
LI Chen-long1,JIA Jian-wei2,LI Qiu-wei2
(1.Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.Department of Integrated Chinese and Western Medicine(Division I),The Second People’s Hospital of Tianjin,Tianjin 300192,China)
[Objective]To explore the effect of fresh rehmannia (freeze-dried)on intestinal biological barrier in liver damaged rats.[Methods]According to the method of Pringle’s maneuver,hepatic ischemia reperfusion was induced in rats.The 64 rats were randomly divided into sham operation group,model group,fresh rehmannia (freeze-dried)group and the lactulose group.We observed the proportion ratio of coccobacillus in rats’feces,cultured the bacterial colony and measured the level of endotoxin.[Results]In fresh rehmannia group and lactulose group the probiotics was increased,escherichia coli was decreased and the level of endotoxin was decreased.[Conclusion]Fresh rehmannia can regulate the intestinal flora,and reduce blood endotoxin level.It may improve the intestinal biological barrier and recover the liver cells.
fresh rehmannia;liver injury;biological barrier
R285.5
:A
:1672-1519(2014)03-0165-03
2013-09-15)
(本文编辑:马 英,马晓辉)
10.11656/j.issn.1672-1519.2014.03.13
天津市卫生局科技基金项目(2010kz12)。
李晨龙(1988-),女,在读硕士,主要从事病毒性肝炎诊治研究。
李秋伟,E-mail:shddelqw@126.com。

