水飞蓟宾体外对人肝癌细胞株HepG2蛋白表达的影响及临床意义
宣丽杨 金 鑫 孟冠敏
(浙江省立同德医院,浙江杭州 310012)
·实验研究·
水飞蓟宾体外对人肝癌细胞株HepG2蛋白表达的影响及临床意义
宣丽杨 金 鑫 孟冠敏
(浙江省立同德医院,浙江杭州 310012)
目的探讨水飞蓟宾在体外对人肝癌细胞HepG2蛋白表达的影响及临床意义。方法采用MTT法检测不同浓度水飞蓟宾(Silibinin)对HepG2细胞增殖的影响;采用台盼蓝法检测不同浓度水飞蓟宾对HepG2细胞的杀伤活性;采用western blot免疫印迹法检测自噬标记蛋白LC3-Ⅱ的表达水平;利用基因沉默技术,转染BNIP3小RNA(siRNA)抑制BNIP3的表达,之后再用MTT法和Western blot法检测水飞蓟宾对HepG2细胞增殖和自体吞噬的影响。结果随着水飞蓟宾浓度的提高,水飞蓟宾在体外对HepG2细胞的增殖抑制率和杀伤活性逐渐提高;水飞蓟宾在体外可显著诱导HepG2细胞LC3-Ⅱ的表达;水飞蓟宾在体外可显著诱导HepG2细胞BNIP3的表达;转染BNIP3 siRNA后,水飞蓟宾对HepG2细胞的增殖抑制率25.3± 4.0和LC3-Ⅱ表达水平0.35±0.11相比于对照组的增殖抑制率63.1±7.0和LC3-Ⅱ表达水平0.70±0.19显著下降。结论水飞蓟宾通过上调BNIP3的表达诱导人肝癌细胞发生自噬性死亡。
水飞蓟宾;HepG2;自体吞噬;BNIP3
水飞蓟宾是从水飞蓟属植物奶蓟种子中提取的一种黄酮类化合物,临床上主要用来保护肝细胞,对黄疸、肝炎、胆囊疾病有良好的疗效[1]。近年来,水飞蓟宾还被发现具有抗肿瘤活性,对于多种肿瘤均具有良好的抑制作用[2-3],然而对肝肿瘤的抑制作用却很少报道,而且抗肿瘤作用的机制也不十分清楚,作者通过体外实验发现水飞蓟宾可以诱导肝肿瘤细胞发生自噬性死亡,报道如下。
1 材料与方法
1.1 仪器与试剂 本研究于2013年5月~2014年3月本院检验中心完成。人肝癌细胞株HepG2(A TCC,美国模式培养物保藏所,HB-8065),RPIM-1640培养基(美国Gibco公司,11875-085),胎牛血清(FBS,杭州四季青生物工程有限公司,HB0205),水飞蓟宾(Silibinin,美国Sigma公司,S0417),台盼蓝(美国Sigma公司,302643),噻唑蓝(MTT,美国Sigma公司,M2128),3-甲基腺嘌呤(3-MA,美国Sigma公司,M9281),细胞裂解液(美国cell signaling公司,#9803),LC3-Ⅱ多克隆抗体(美国cell signaling公司,#2775),β-actin单抗(美国cell signaling公司,#4967),BNIP3多克隆抗体(美国cell signaling公司,#3769),PVDF膜(美国Millipore公司,IPVH00010),转染试剂Lipofectamine 2000(美国Invitrogen公司,11668030),BNIP3 siRNA及无关对照siRNA由上海吉玛公司合成,BNIP3的siRNA序列为:正向:5′-CACGAGCGUCAUGAAGAAAUU-3′,反向:5′-UUUCUUCAUGACGCUCGUGUU-3′。
1.2 方法
1.2.1 细胞培养 人肝癌细胞株HepG2培养在含10%FBS的RPIM-1640培养基中,置于37℃含5%的CO2的培养箱中培养,每2~3天传代1次,实验选用对数生长期细胞。
1.2.2 MTT试验 将HepG2细胞按1000/孔接种于96孔板,设置3个复孔,加入200μL含10%FBS的RPIM-1640培养基并分别加入0、10、50、100μmol/L的silibinin于37℃、5%CO2培养箱内分别培养24小时,另设一组加入3mmol/L的3-MA培养2小时,然后再加入100μmol/L的Silibinin培养24小时之后加5g/L MTT 20μL,继续培养4小时。弃上清液,往孔中加150μL二甲亚砜(DMSO),震荡使紫色絮状物完全溶解,570nm波长下用酶标仪检测OD值,结果以3次实验的平均值表示。细胞生长的抑制率以以下公式计算:抑制率=1-实验组平均OD值/对照组平均OD值。
1.2.3 台盼蓝染色法检测HepG2细胞死亡率 将HepG2细胞按两组培养,一组为用含10%FBS的RPIM-1640培养基常规培养,另一组为用不含FBS的RPIM-1640饥饿培养(serum starved,SS)24小时。两组都取5000/孔接种于96孔板,两组分别加入0μmol/L或100μmol/L的Silibinin培养2、6、12、24小时,之后用台盼蓝对细胞进行染色,死亡细胞被染成蓝色,活细胞不着色,肿瘤细胞的死亡率=染色细胞数/总细胞数。
1.2.4 Western blot法检测LC3-II和BNIP3蛋白表达水平 在HepG2细胞培养瓶中分别加入0μmol/L,10μmol/L,50μmol/L,100μmol/L的Silibinin培养24小时,同时另设一组在培养瓶中先加入3mmol/L的3-MA培养2小时,然后再加入100μmol/L的Silibinin培养24小时,然后取细胞裂解液做Western blot实验,检测LC3-II和BNIP3的表达,蛋白表达量由胶片上的灰度值表示,灰度值计算使用ImageJ软件分析,目标蛋白相对表达量=目标蛋白灰度值/β-actin灰度值。
1.2.5 细胞转染 按照Lipofectamine 2000操作说明书在HepG2培养体系中分别加入100nmol/L的BNIP3 siRNA以及无关对照siRNA培养16小时,之后加100μmol/L的Silibinin再培养24小时,检测细胞的增殖和自噬程度。
1.3 统计学处理 实验数据使用SPSS 11.0统计分析软件进行处理,采用非配对双向t检验以及单因素方差分析。
2 结 果
2.1 水飞蓟宾对人肝癌细胞HepG2的抑制作用将HepG2细胞在不同剂量Silibinin下治疗24小时,结果发现各剂量组相比于未加Silibinin的对照组均呈现出抑制效应,且呈剂量依赖性,而HepG2细胞用自噬抑制剂3-MA预处理后,再加Silibinin培养,Silibinin对HepG2细胞的抑制作用相比于未用3-MA预处理组明显减弱,提示水飞蓟宾通过诱导肿瘤细胞过度的自体吞噬效应杀伤肿瘤细胞,见表1。在血清饥饿的环境下,水飞蓟宾(100μmol/L)在治疗HepG2细胞6小时后,HepG2细胞的死亡率为(48.5± 4.5)%,而在血清充足环境下,水飞蓟宾(100μmol/L)在治疗HepG2细胞6小时后,HepG2细胞的死亡率为(5.2±1.6)%,提示血清饥饿可增强HepG2对水飞蓟宾杀伤活性的敏感性,详见表2。
表1 不同剂量水飞蓟宾对HepG2细胞增殖抑制率的比较(±s)
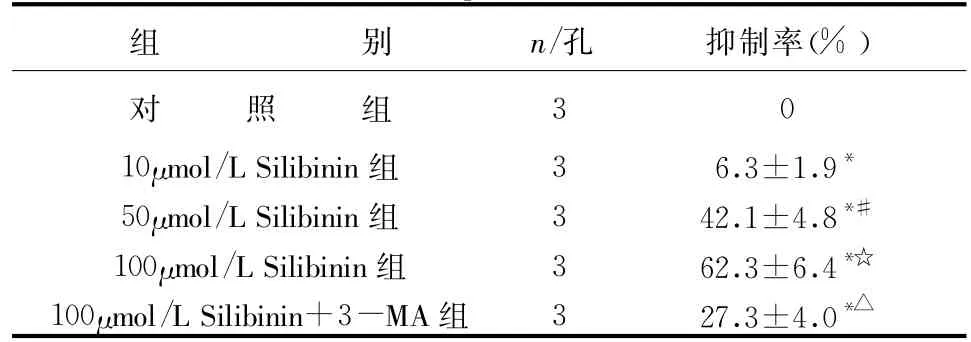
表1 不同剂量水飞蓟宾对HepG2细胞增殖抑制率的比较(±s)
与对照组比较*P<0.05,与10μmol/L Silibinin组比较#P<0.05,与50μmol/L Silibinin组比较☆P<0.05,与100μmol/L Silibinin组比较△P<0.05
组 别n/孔抑制率*△(%)对 照 组30 10μmol/L Silibinin组36.3±1.9*50μmol/L Silibinin组342.1±4.8*#100μmol/L Silibinin组362.3±6.4*☆100μmol/L Silibinin+3-MA组327.3±4.0
表2 血清缺乏或充足时水飞蓟宾对HepG2细胞死亡率的比较(±s ,%)

表2 血清缺乏或充足时水飞蓟宾对HepG2细胞死亡率的比较(±s ,%)
与对照组比较*P<0.05,与Silibinin组比较△P<0.05
小时对照组31.3±0.21.2±0.21.5±0.32.1±0.4 SS组31.1±0.31.9±0.42.7±0.63.8±0.8 Silibinin组31.8±0.45.2±1.6*23.6±4.1*64.2±6.1*SS+Silibinin组313.2±2.5*△48.5±4.5*△63.3±7.2*△70.4±6.6组 别n/孔2小时6小时12小时24 *△
2.2 水飞蓟宾诱导HepG2细胞发生自体吞噬HepG2细胞在不同浓度Silibinin的作用下相比于未加Silibinin的对照组LC3-Ⅱ和BNIP3的表达均明显升高,而HepG2细胞用3-MA预处理后再加Silibinin培养,LC3-Ⅱ的表达相比于未加3-MA组显著减少(P<0.05),而BNIP3的表达则不受影响(P>0.05)。这些结果进一步说明了水飞蓟宾能诱导人肝癌细胞发生自体吞噬且上调BNIP3的表达,详见表3、图1。
表3 不同剂量水飞蓟宾对HepG2细胞LC3-Ⅱ和BNIP3蛋白表达的比较(±s)
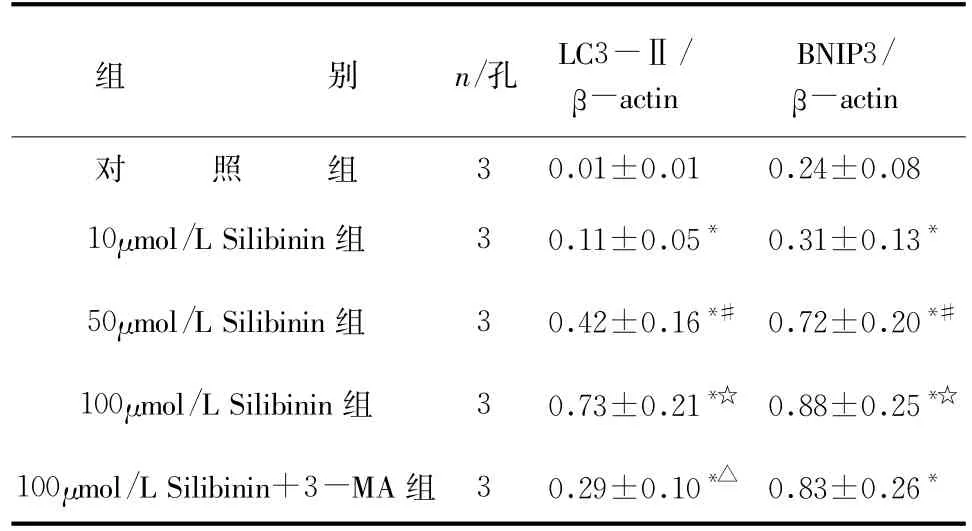
表3 不同剂量水飞蓟宾对HepG2细胞LC3-Ⅱ和BNIP3蛋白表达的比较(±s)
与对照组比较*P<0.05,与10μmol/L Silibinin组比较#P<0.05,与50μmol/L Silibinin组比较☆P<0.05,与100μmol/L Silibinin组比较△P<0.05
组 别n/孔LC3-Ⅱ/β-actin BNIP3/β-actin对 照 组30.01±0.010.24±0.08 10μmol/L Silibinin组30.11±0.05*0.31±0.13*50μmol/L Silibinin组30.42±0.16*#0.72±0.20*#100μmol/L Silibinin组30.73±0.21*☆0.88±0.25*☆100μmol/L Silibinin+3-MA组30.29±0.10*△0.83±0.26*
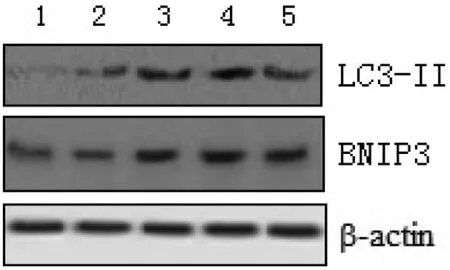
图1 不同剂量水飞蓟宾对HepG2细胞LC3-Ⅱ和BNIP3蛋白表达的比较。
2.3 BNIP3的表达对水飞蓟宾发挥抗肿瘤效应的影响 先将HepG2细胞转染100 nmol/L对照siRNA或100 nmol/L BNIP3 siRNA培养12小时,再分别加入100μmol/L水飞蓟宾培养24小时,用MTT法检测这两组的增殖抑制率和LC3-II及BNIP3的蛋白表达。结果如表4所示,BNIP3 siRNA组与对照siRNA的相比,水飞蓟宾对HepG2细胞的增殖抑制率明显降低(P<0.05),同时水飞蓟宾对自噬标记蛋白LC3-Ⅱ的诱导作用也明显降低(P<0.05)。表3、表4结果提示水飞蓟宾诱导HepG2细胞发生自体吞噬而导致肿瘤细胞死亡的机制依赖于BNIP3表达水平的上调。
表4 BNIP3 siRNA对水飞蓟宾发挥抗肿瘤效应的影响(±s)

表4 BNIP3 siRNA对水飞蓟宾发挥抗肿瘤效应的影响(±s)
与对照siRNA组比较*P<0.05
组 别n/孔BNIP3/β-actin LC3-Ⅱ/β-actin增殖抑制率(%)对照siRNA组30.84±0.250.70±0.1963.1±7.0 BNIP3siRNA组30.28±0.05*0.35±0.11*25.3±4.0*
3 讨 论
自体吞噬过程是一个吞噬自身细胞质蛋白并使其包被进入囊泡的过程,是正常细胞都会发生的一个过程,当细胞处于营养缺乏的“饥饿”状态时,细胞会加强自身的自体吞噬来分解一部分细胞蛋白,这一过程受许多自噬相关基因的调控,研究发现很多促自噬因子都能抑制癌症发生,肿瘤细胞过度的自噬会导致肿瘤细胞死亡[4]。本研究通过3-MA抑制了水飞蓟宾引起的HepG2细胞的自噬及杀伤活性,证实了水飞蓟宾能通过诱导人肝癌细胞发生高度自噬并诱导肿瘤细胞发生自噬性死亡。同时还发现当HepG2细胞处于营养缺乏的“饥饿”状态时,其对水飞蓟宾的敏感性大大增强,水飞蓟宾在短时间内就能形成对肝肿瘤细胞的杀伤,这可能是因为当肿瘤细胞处于“饥饿”状态时,其自身生理的自噬程度相对提高,且分解了一些自噬抵抗蛋白[5],从而对促自噬信号格外敏感。
BNIP3是Bcl-2家族成员中包含单BH3区的促凋亡成员,属于BH3-only亚家族,研究表明BNIP3在细胞死亡的传导途径中有十分重要的作用,它的高度表达能诱导非凋亡性的程序性死亡即自噬性死亡[6]。在本研究中,作者发现水飞蓟宾能显著上调HepG2细胞BNIP3的表达,而当用BNIP3特异性siRNA干扰BNIP3的上调时,水飞蓟宾对HepG2细胞自噬的诱导效应和杀伤活性显著下降,表明水飞蓟宾诱导HepG2细胞发生自体吞噬而导致肿瘤细胞死亡的机制依赖于BNIP3表达水平的上调。
[1]Milic′N,Milosevic′N,Abenavoli L,et al.New therapeutic potentials of milk thistle(Silybum marianum).Nat Prod Commun,2013,8(12):1801
[2]Akhtar R,Ali M,Mahmood S,Sanyal S N.Anti-proliferative action of silibinin on human colon adenomatous.cancer HT-29 cells.Nutr Hosp,2014,29(2):388
[3]Oh S J,Jung S P,Kim J H,et al.Silibinin inhibits TPA-induced cell migration and MMP-9 expression in thyroid and breast cancer cells.Oncol Rep,2013,29(4):1343
[4]Barth J M,Köhler K.How to Take Autophagy and Endocytosis Up a Notch.Biomed Res Int,2014,2014:960803
[5]Green D R,Levine B.To Be or Not to Be?How Selective Autophagy and Cell Death Govern Cell Fate.Cell,2014,157(1):65
[6]Gustafsson A B.Bnip3 as a dual regulator of mitochondrial turnover and cell death in the myocardium.Pediatr Cardiol,2011,32(3):267

