脑室旁结节状灰质异位:结节的位置与并发其他脑畸形的关系的MRI研究
刘 斋,何 丽,董强强,祁宇轩,任庆云
(河北医科大学第一医院放射科,河北 石家庄 050031)
灰质异位是由于神经元不能移行到正常的位置而形成的大脑皮质发育障碍。根据其发生的位置分为3类:脑室旁结节状灰质异位(Periventricular nodular heterotopia,PNH),皮质下灰质异位及带状灰质异位[1]。PNH是最常见的一种灰质异位,表现为大小不等的神经元结节衬于侧脑室的表面,常与中枢神经系统其它畸形并存。笔者收集我院2008年1月—2013年6月经MRI诊断的PNH 40例,分析PNH中结节的位置是否与合并其它脑发育畸形密切相关,旨在提高对本病的认识。
1 资料与方法
1.1 临床资料
MRI检查发现PNH患者40例,其中男25例,女15例,年龄3月~45岁,中位年龄18岁。主要临床表现为癫痫27例、精神运动发育迟缓11例,双足下垂1例,幻觉妄想状态1例。
1.2 检查方法
采用GE Signa Excite Twinspeed 1.5T磁共振扫描仪,颅脑MRI扫描包括轴位T1WI、T2WI、FLAIR及矢状面T1WI。扫描参数:T1WI(T1flair):TR 1750ms,TE 24ms,TI 750 ms;T2WI:TR 4 000 ms,TE 102 ms;FLAIR:TR 8 800 ms,TE 120 ms,TI 2 200 ms;层厚/间距:6 mm/1 mm,矢状面层厚/间距:5 mm/1 mm。15例行薄层快速扰相梯度回波序列扫描,扫描参数:TR 7.58 ms,TE 1.59 ms,TI 400 ms。
1.3 资料分析方法
每例病人均分析PNH结节的位置、数量及单双侧分布。根据结节在侧脑室的位置不同分为3组:第一组结节在侧脑室的前角和/或侧脑室体部称为前部型PNH,第二组结节仅位于侧脑室三角区、枕角或颞角称为后部型PNH,第三组结节位于侧脑室全段者称为弥漫型PNH。结节的位置与合并其他畸形的关系,使用χ2检验分析3组PNH合并其他脑发育畸形有无显著性差异,P<0.05为有显著性差异。
2 结果
2.1 PNH病变分布、结节数目及不同分型所占比例
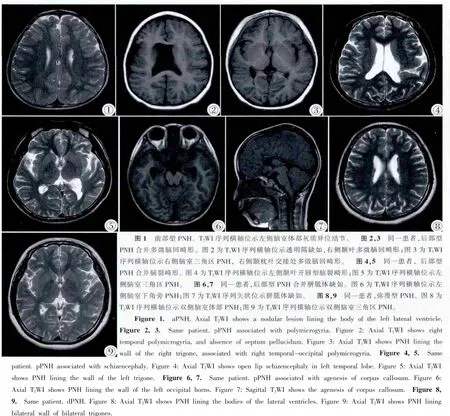
40例病人中,结节单侧分布24例(60%),双侧分布16例(40%)。15例(37.5%)结节数目<5个,5例(12.5%)结节数目5~10个,20例(50%)结节数目>10个。前部型PNH 12例(30%)(图1),后部型PNH 13例(32.5%)(图2~7),弥漫型15例(37.5%)(图8,9)。
2.2 PNH合并其它脑发育畸形的结果
40例PNH病人合并皮质发育畸形18例,其中合并多微脑回畸形12例,脑裂畸形3例,皮质下灰质异位3例。后部型PNH较弥漫型PNH及前部型PNH更容易合并大脑皮质发育异常,分别为12例(92.3%)、5例(33.3%)和1例(8.3%),3组间有显著性差异(3组比较P<0.001;表1)。PNH合并胼胝体发育异常9例,其中,弥漫型5例(33.3%),后部型3例(23.1%),前部型1例(8.3%),3组间有显著性差异(P<0.05;表2)。PNH合并脑白质减少17例,其中,前部型2例(16.7%),后部型7例(53.8%),弥漫型8例(53.3%),前部型明显低于后两组(P<0.05),而后部型与弥漫型间无显著性差异(P>0.05;表3)。PNH合并脑室扩张12例,其中,弥漫型6例,后部型5例,前部型1例,多数病人与胼胝体发育异常并存,其中7例与胼胝体发育不良并存,2例与胼胝体不发育并存。

表1 3种类型PNH合并大脑皮质发育畸形的比较

表2 3种类型PNH合并胼胝体发育异常的比较
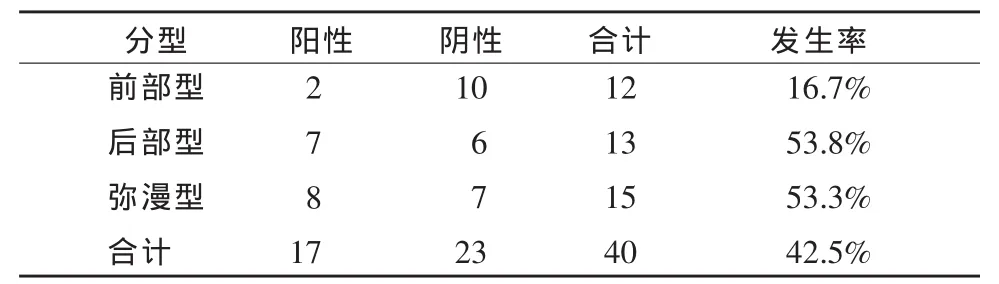
表3 3种类型PNH合并脑白质减少的比较
3 讨论
3.1 病因与发病机理
PNH是由于一簇神经元不能由胚胎性室管膜区移行到发育中的大脑皮质而导致的室管膜下灰质结节沿着侧脑室壁分布。从胚胎发育及致病基因方面PNH均与皮质下灰质异位及带状灰质异位有明显的不同[2]。组织学观察,异位的神经元形态大体正常,以孤立或成簇的状况存在,但缺乏适当的突触间联系[3]。不同类型的PNH的病因尚不清楚,传统观点认为是神经元移行异常,最新研究表明可能是由于神经室管膜的损伤,引起神经元在放射状神经胶质的附着中断,导致神经元不能移行到中间区和皮质区,而使神经元结节仍停留在脑室的表面。除了基因异常的原因外,在神经元增殖及移行前期,机械性神经室管膜破坏也可以引起PNH[4]。现已发现多数PNH都是由X染色体上的Xq28 FLNA基因突变导致的[5-6],FLNA基因表达损害引起放射状神经胶质支架的破坏,使神经元不能移行到大脑皮层[7]。这些病人异位结节的典型表现为双侧对称分布,主要位于侧脑室体前部及前角区,女性病人多见。ARFGEF2基因的突变会引发常染色体隐性PNH并伴有头小畸形。ARFGEF2是ADP核糖基化因子——鸟嘌呤核苷酸交换蛋白之一,负责ADP核糖基化因子的激活。ARFGEF2基因的突变导致大脑畸形的机制还未知,但在小鼠模型的研究中发现,该基因在小鼠早期的胚胎发育中至关重要。缺乏该基因的卵子和缺乏该基因的精子结合后的受精卵未发育到胚胎的四细胞时期就夭折了[8]。
3.2 PNH病变的部位及其与合并其他脑畸形的关系
Gonzalez等[4]根据异位结节的位置将PNH分为3类:在侧脑室的前角和/或侧脑室体部称为前部型PNH,结节仅位于侧脑室三角区、枕角或颞角称为后部型PNH,结节位于侧脑室全段者称为弥漫型PNH;其对200例PNH病例分析发现,后部型PNH并发大脑皮质发育异常,脑白质减少及中脑、小脑畸形明显多于其他两型。本组病例中,后部型PNH较弥漫型及前部型更容易合并大脑皮质发育异常,发生率分别为92.3%,33.3%和8.3%,3组间有显著性差异(3组比较P<0.001),与Gonzalez的结果基本一致。Mandelstam等[9]报道了50例双侧后部型PNH,其中有98%病人合并先天性脑发育异常,有超过74%病人出现后颅窝、胼胝体后部、海马及后部大脑皮层发育异常,认为后部型PNH更易合并其他脑结构的发育异常;后部型PNH不仅是单纯的神经元移行异常,而且是后部或外侧裂下方脑弥漫性发育性异常的一部分。后部型PNH易合并大脑皮质发育异常及中后脑发育异常的原因可能是,枕叶及颞叶位于大脑半球的后部,与大脑半球前部比较,可能与中/后脑基因表达有更多的重叠[4]。弥漫型PNH与大脑皮质发育异常及脑干发育异常没有明显关系,而与中后脑发育异常密切相关。在基因突变方面后部型PNH与前部型PNH及弥漫型PNH也存在明显区别,前者与FLNA基因突变没有关系,而后两者与FLNA基因突变密切相关[6,9]。本组病例中,后部型PNH脑白质体积明显减少发生率明显高于前部型PNH,而与弥漫型PNH无明显差异。文献报道,一些神经元移行疾病,如无脑回畸形,常常合并轴索的连接异常,因此推测调控神经元移行及轴索外生长的基因是密切相关联的;同理,也可以认为大脑皮层发育异常尤其是后部PNH也可以出现轴索的连接异常,而产生脑白质减少[10-11]。本组病例中有12例(30%)合并脑室扩张,多见于弥漫型PNH及后部型PNH,Parrini等[6]认为是脑积水导致脑室扩张,Mandelson等[9]认为是发育异常所致,笔者支持后者的观点,其一是因为这些病人没有颅内压增高的临床及其他影像学表现,其次,本组12例脑室扩张病人中9例合并胼胝体发育异常,后者也是脑室扩大的常见原因。
3.3 PNH与癫痫
PNH的主要临床表现是癫痫发作,本组病例中有27例表现为癫痫发作。病理研究显示脑室周围异位的结节与邻近其他异位结节及结节外的脑区多数情况下有疏松的连接,一些结节与其上方发育异常的大脑皮质较其他部位有更多的连接[12-13]。癫痫活动可能是由于结节本身的内源性致痫原及其与结节相连的大脑皮层共同形成的[12-14]。此外,PNH常常合并其他大脑皮层发育异常,如多微脑回畸形及脑裂畸形等,本组中占45%,这些皮层发育异常也是重要的致痫原之一[15]。
总之,PNH病人结节的位置与合并其他脑发育畸形密切相关,根据结节在侧脑室的位置分布,分为前部型PNH、后部型PNH和弥漫型PNH,后部型PNH较弥漫型PNH及前部型PNH更容易合并其他脑发育畸形。
[1]Guerrini R,Parrini E.Neuronal migration disorders[J].Neurobiol Dis,2010,38(2):154-166.
[2]Barkovich AJ,Guerrini R,Kuzniecky RI,et al.A developmental and genetic classification for malformations of cortical development:update 2012[J].Brain,2012,135(Pt 5):1348-1369.
[3]Sisodiya SM.Malformations of cortical development:Burdens and insights from important causes of human epilepsy[J].Lancet Neurol,2004,3(1):29-38.
[4]Gonzalez G,Vedolin L,Barry B,et al. Location of Periventricular Nodular Heterotopia Is Related to the Malformation Phenotype on MRI[J].AJNR,2013,34(4):877-883.
[5]Sheen VL,Dixon PH,Fox JW,et al.Mutations in the X-linked filamin 1 gene cause periventricular nodular heterotopia in males as well as in females[J].Hum Mol Genet,2001,10(17):1775-1783.
[6]Parrini E,Ramazzotti A,Dobyns WB,et al.Periventricular heterotopia:phenotypic heterogeneity and correlation with Filamin A mutations[J].Brain,2006,129(Pt 7):1892-1906.
[7]Carabalona A,Beguin S,Pallesi-Pocachard E,et al.A Glial origin for periventricular nodular heterotopias caused by impaired expression of filamin-A[J].Hum Mol Genet,2012,21(5):1004-1017.
[8]Grzmil P,Enkhbaatar Z,Gundsambuu B,et al.Early embryonic lethality in gene trap mice with disruption of the Arfgef2 gene[J]. Int J Dev Biol,2010,54(8/9):1259-1266.
[9]Mandelstam SA,Leventer RJ,Sandow A,et al.Bilateral Posterior Periventricular Nodular Heterotopia:A Recognizable Cortical Malformation with a Spectrum of Associated Brain Abnormalities [J].AJNR,2013,34(2):432-438.
[10]Kara S,Jissendi-Tchofo P,Barkovich AJ.Developmental differences of the major forebrain commissures in lissencephalies[J]. AJNR,2010,31(9):1602-1607.
[11]Liu JS.Molecular genetics of neuronal migration disorders[J]. Curr Neurol Neurosci Rep,2011,11(2):171-178.
[12]Hannan AJ,Servotte S,Katsnelson A,et al.Characterization of nodular neuronal heterotopia in children[J].Brain,1999,122(Pt 2):219-238.
[13]Battaglia G,Chiapparini L,Fraceschetti S,et al.Periventricular nodular heterotopia:classification,epileptic history,and genesis of epileptic discharges[J].Epilepsia,2006,47(1):86-97.
[14]Archer JS,Abbott DF,Masterton RA,et al.Functional MRI interactions between dysplastic nodules and overlying cortex in periventricular nodular heterotopia[J].Epilepsy Behav,2010,19 (4):631-634.
[15]Aghakhani A,Kinay D,Gotman J,et al.The role of periventricular nodular heterotopias in epileptogenesis[J].Brain,2005, 128(Pt 3):641-651.

