临床常用肺功能检查项目及合理选择
留永健,韩江娜
(中国医学科学院 北京协和医学院北京协和医院呼吸科,北京 100730)
肺功能检查包括肺量计测定、支气管舒张/激发试验、肺容积测定、弥散功能测定、气道阻力测定、呼吸肌力测定、血气分析和气体交换、心肺运动试验、代谢测定等(表1)。上述项目从不同角度反映了呼吸系统的功能状态,最常用的是上述前四项。各检查可以独立进行,但常以固定的组合方式进行检查[1]。合理选用肺功能项目和组合,可以帮助判断患者的气道病变及其可逆性,以及肺实质、肺血管、呼吸肌或心功能方面的异常。在临床实践中,通常根据临床需要解答的问题,有针对性地选择检查项目,如需确定患者是否有哮喘或评估原有基础肺疾病是否会增加麻醉和外科手术风险。这些临床问题或肺功能检查的理由就是肺功能检查的适应证。临床肺功能检查一般是安全的,绝对禁忌证少,主要包括新近出现的心脑血管疾病(心肌梗死、脑血管意外、夹层动脉瘤、严重心律失常)、急性肺栓塞和气胸。
通气功能
肺量计测定

表1 临床常用肺功能检查项目
肺量计测定是最基本、也是最常用的肺功能检查项目[2],通常是肺通气功能检查的第一步,可作为筛查手段。常用指标有肺活量(vital capacity,VC)或用力肺活量(forced vital capacity,FVC)、第1秒用力呼出容积(forced expiratory volume in one second,FEV1)和最大呼气中期流量(forced expiratory flow,FEF25%-75%)(表2)。如肺量计测定结果异常,应酌情考虑进一步进行其他肺功能项目。
肺量计直接测定经口吸入或呼出的气体容积和流量,通常按照容积(升)或流量(升/秒)记录。VC是最大吸气后所能呼出的最大气量,FVC为最大吸气后最大用力并以最快速度所能呼出的最大气量。FEV1也称1秒量,是在测定FVC时,第1秒钟所吹出的气体量。VC或FVC反映肺体积大小,FEV1既受肺体积影响又受气道内径影响,二者之比(FEV1/FVC)称为1秒率。1秒率消除了肺体积的影响,可作为气道阻塞的指标。

表2 肺量计测定适应证
用力肺活量测定主要用于发现气道阻塞。慢性阻塞性肺病的诊断统一采用吸入支气管舒张剂后的FEV1/FVC<70%为标准[3]。但应注意,1秒率的正常值本身会随着年龄增长而下降,70%的标准在高龄患者可能会过度诊断慢性阻塞性肺病[4-5]。反之,1秒率75%对老年人属于正常,而对于中学生则可能属于异常。
呼气峰流速值(peak expiratory flow,PEF)是呼出气流的最大即时流速。PEF测量相对简单,可用简易峰流速仪测量。PEF反映大气道的口径,但也受呼气肌的肌力和患者每次吹气用力程度的影响。PEF结果稳定性较差,即使同样的FVC和FEV1,PEF亦可能有很大差异,因此PEF多用于患者自我监测。
支气管舒张试验
使用支气管舒张剂前后分别做肺量计测定称为支气管舒张试验,是气道阻塞可逆性的重要检查。最常使用的支气管舒张剂是短效β2受体兴奋剂如沙丁胺醇,也可用异丙托溴铵,或者两种联用。支气管舒张试验阳性定义为FVC或FEV1增加12%或以上,且绝对值增加200 ml或以上[6-7]。由于FVC的大小会受呼气时间长短影响,一般多使用FEV1评价。若确定FVC的增加并非由呼气时间延长所致,则被视为真正的支气管舒张效应,说明呼气末困滞在肺内的气体减少。支气管舒张试验反应除了受支气管舒张剂种类和剂量的影响外,还与气道阻塞的严重程度有关[8]。部分支气管哮喘患者气道阻塞的可逆性只有在使用糖皮质激素后才能显现出来。因此,支气管舒张试验阴性结果不能完全排除哮喘。此外,还有一些患者气道功能处于正常值低限或表现为非特异性通气功能障碍,使用支气管舒张剂后明显改善,则反之说明存在隐匿性气道阻塞。慢性阻塞性肺病也有部分病例支气管舒张试验阳性,但即使在其最佳值,仍有气道阻塞。
支气管激发试验
若临床上怀疑患者存在哮喘但表现不典型,且基础肺量计测定正常,此时可用支气管激发试验。激发试验是采用一定的气道刺激因素,于患者接受刺激前后分别进行肺量计测定。激发刺激可以是非特异的组织胺和乙酰甲胆碱,也可以是致敏原(如过敏原或职业致敏原)和物理因素(如运动、冷空气、过度通气)。标准化的组织胺和乙酰甲胆碱激发试验使用广泛,安全性较好[9],且检测结果高度一致。对药物激发无反应者,有可能对物理因素有反应,对某些特殊病例可考虑使用不同的刺激方式。由于支气管激发试验存在一定风险,需有医师书面申请,必要时需要受检者知情同意。一旦患者出现严重症状,应立即中断试验。对激发试验阳性患者,应在试验结束后给予支气管扩张剂,直到诱发的支气管痉挛解除后才允许其离开实验室。
支气管激发试验阳性说明存在气道高反应性,是诊断哮喘的重要依据。但是,阳性结果并非哮喘患者特有,也可见于过敏性鼻炎及胃食管返流病。正常人在病毒性呼吸道感染后或暴露于严重空气污染后也可能出现短期阳性。所以,呼吸道感染后6周内不宜行支气管激发试验。另外,虽然阳性结果不能直接诊断哮喘,但至少说明症状可能与气道高反应有关,可以作为使用哮喘药物的客观依据。
同一患者对支气管激发试验的反应并非一成不变,哮喘患者在缓解期可以为阴性。但对于有症状者,其阴性结果对哮喘有很高的排除价值。
肺容积测定
肺容积检查的最主要目的是确定限制性肺疾病[10-11]。除了肺疾病外,胸膜、胸壁及神经肌肉疾病也可导致肺容积受限。在气道正常的情况下,VC或FVC降低可提示肺容积减少。但在,有气道阻塞疾病的患者往往也会出现FVC降低,肺容积却可能正常甚至增大。因此,要在测量肺总量(total lung capacity,TLC)后,才能确定是否同时存在限制性病变。
肺容积测定适应证:(1)诊断或评估限制性肺病及严重程度;(2)鉴别阻塞性和限制性疾病类型;(3)评估治疗干预效果,如支气管舒张剂或糖皮质激素,肺移植、肺切除术或肺减容术,放疗或化疗效果;(4)肺量计测定结果异常者麻醉手术风险综合评估;(5)慢性阻塞性肺病患者确定过度充气及其程度;(6)对比体描箱法和气体稀释法所测肺容积,评估气体困滞情况;(7)其他肺功能检查结果的标准化(比气道传导)。
肺总量是最大吸气时肺内的气体量。残气量(residual volume,RV)是指最大呼气末仍残留于肺内的气体量。肺总量等于残气量加肺活量。平静呼吸时,呼气末残留于肺内的气体量称为功能残气量(functional residual capacity,FRC)。TLC、RV或FRC均属于“静态肺容量”,不能用肺量计直接测定,需要其他间接方法,如气体稀释法和体描箱法。健康人群这两种方法测出结果相等,但阻塞性肺部疾病患者气体稀释法有可能会低估TLC。
气体稀释法要求肺内气体与肺量计内的氦气达到“完全混合”,即氦气浓度衡定,或者混合时间达到10 min[12]。对气道阻塞的患者来说,由于通气分布不均匀,实际上需要更长时间才能达到完全混合。因此,氦气稀释法会低估肺容积。混合时间越短,低估现象越显著。体描箱法测定的是可以被压缩的所有气体容积,除了与气道沟通,有通气的肺区外还包括无通气肺区的肺容积(如肺大泡)。因此,两种方法测定结果的差值实际上反映了肺内困滞气体含量。另外,气道阻力增高患者的口压变化在时间上滞后于肺泡压变化,结果低估了肺容量,遮断器关闭造成患者浅快呼吸频率低于1 Hz,这种误差可以避免[13]。
弥散功能检查
弥散功能体现气体交换单元功能,即把气体由肺泡腔转运至肺泡毛细血管的能力[14]。这一过程是通过气体的被动弥散实现的,影响因素包括驱动气体压力差、气体交换接触面积及气体跨膜阻力。肺内压力差是指肺泡和肺泡毛细血管红细胞之间的气体分压差。跨膜阻力主要与肺泡膜或肺泡间隔厚度有关。气体交换的面积主要取决于肺泡毛细血管床容量,后者还决定了参与气体交换的血液容积和血红蛋白含量。
弥散功能测定常用于肺间质性疾病、肺血管疾病和肺气肿的评估。适应证:(1)评估或随诊肺间质性疾病进展:特发性,结缔组织病的肺部受累,粉尘(石棉、硅质、金属),有机物(过敏性肺泡炎),药物(胺碘酮、博来霉素);(2)阻塞性肺疾病:判断肺气肿或肺泡结构是否破坏,预测慢性阻塞性肺疾病患者运动状态下动脉血氧饱和度有无下降;(3)评估心肺血管疾病:肺动脉高压,复发性或慢性肺血栓栓塞,肺静脉闭塞,肺水肿或充血性心力衰竭;(4)评估肺出血、红细胞增多症或左向右分流[一氧化碳弥散量(DLCO)增高]。
肺间质性疾病患者肺泡毛细血管总量减少、肺泡间隔增厚均导致弥散功能降低。特发性肺纤维化患者若DLCO低于正常预计值40%以下或半年内DLCO较基础水平下降超过15%,都提示预后不佳。肺气肿患者由于肺泡毛细血管床减少、结构破坏,弥散功能也会下降。
弥散功能的检测结果用ml/(min·mm Hg)或mmol/(min·kPa)表示,代表在单位时间内、一定压力梯度下所能扩散的气体量。临床上常用一氧化碳测定DLCO,通常与肺量计测定、肺容积测定组合进行。DLCO除了受到气体被动扩散的影响外,同时也受气体分子与血红蛋白化学结合速度的影响。有临床工作者建议,使用更通俗的术语——转移因子替代DLCO。转移因子实际上可以被看作是气体的传导,即气体所克服总阻力的倒数。总阻力由两个串联阻力组成,即气体通过肺泡-毛细血管膜的物理阻力、气体与血红蛋白结合的化学阻力。
弥散功能测定易受多种临床因素影响。运动状态下或充血性心力衰竭时,由于肺毛细血管血容量增加,DLCO明显增加;吸烟者DLCO降低;贫血时DLCO降低,血色素减半时DLCO可降低30%;红细胞增多症时DLCO增加;存在于血管外的血红蛋白(肺出血时)也能吸收结合一氧化碳,导致DLCO测定值升高。
按单位肺泡容积来衡量弥散功能(DL/VA),称为转移系数(KCO)。这是假定机械性的肺容积减损,其弥散功能也会按比例降低,希望使用KCO能去除这一因素的影响。但实际情况往往并不与此相符,如自主性吸气受限时容积减少,但肺泡毛细血管灌注并未减少,这反而会导致DL/VA升高;肺切除患者剩下的肺内毛细血管会代偿性增多,DL/VA也会升高。肺间质性疾病常有弥散功能降低,同时由于肺容积亦减少,故DL/VA仅轻度降低,甚至正常。肺气肿和肺血管疾病(如肺血管炎、肺栓塞和肺动脉高压)均有肺毛细血管表面积和血容量减少,但肺容积不减,故DLCO和DL/VA均降低。
临床判断弥散功能异常应当基于DLCO,而不是DL/VA。
呼吸肌力和气道阻力检查
许多神经肌肉疾病会影响呼吸肌群的肌力。最大吸气压(maximal inspiratory pressure,MIP)和最大呼气压(maximal expiratory pressure,MEP)是测定呼吸肌群的力量的常用方法[15-16],使用压力转换器或简单压力计即可测量。若MIP和MEP正常,则可以排除呼吸肌力量异常;但若MIP和MEP降低,并非均为呼吸肌力量下降导致,需结合其他临床资料综合判断。MIP和MEP测定值受测定时肺容量影响,处于容量较小状态时相对容易吸气,而容量较大时相对容易呼气,RV状态时MIP最大,TLC状态下MEP最大。慢性阻塞性肺疾病患者即使没有呼吸肌力减弱,由于其RV较大,也会导致MIP降低;而肺间质纤维化或胸廓畸形患者TLC减少,会导致MEP降低。另外,患者是否配合也会明显影响检查结果。
气道内有压力差才能驱使气体流动。在一定压力差下,气体流速取决于气道阻力(Raw)的大小,阻力越大,则流速越小。由于气管支气管树的结构特点,Raw主要反映上气道和胸内大气道阻力。根据定义,Raw可用维持单位时间内气体流量(V)所需肺泡压差(ΔPA)来表示,即Raw=ΔPA/V。体描箱法是测定气道阻力的技术,最初由Dubois等[17]发明,后来Mead[18]和其他学者进行改进。与强迫振荡技术相比[19],体描箱法测定的气道阻力不受胸壁和肺组织阻力影响。
动脉血气和气体交换检查
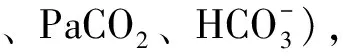
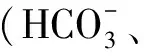
动脉血气分析存在一定创伤性,目前有许多无创技术(指氧仪,经皮监测,呼出气二氧化碳检测仪)[21-22]。然而,虽然无创技术操作简单且方便持续检测,但还需血气分析验证准确性。
心肺运动试验
心肺运动试验能够在代谢需求增加的情况下评价心肺功能并预测运动受限及其程度,这是任何1项静态肺功能检查所不能完全替代的[23]。心肺运动试验的主要指征是劳力性呼吸困难、胸痛(尤其是心绞痛)和乏力;其他指征包括运动诱发的支气管痉挛和运动低氧:(1)评估运动耐受性和日常运动的安全水平;(2)评估和鉴别因呼吸困难、乏力或疼痛导致的运动受限:心血管疾病,呼吸疾病,心血管和呼吸系统均患病,无法解释的呼吸困难;(3)康复治疗评估,运动时低氧血症及其程度,制定氧疗处方;(4)手术前风险评估,尤其是肺切除或减容手术;(5)伤残鉴定,尤其是职业病鉴定;(6)预测特殊治疗效果,如心脏或肺移植手术。多数情况下,通过运动负荷(即运动水平)与心肺运动生理(包括心血管参数、通气、耗氧量、二氧化碳产生量、呼吸商、运动中动脉血气)和呼吸困难/乏力症状三者之间的关系判断。
6 min步行试验(6MWT)是较为简单的运动试验。许多肺部疾病的临床转归都与6 min行走距离有较好的相关性。该试验还与复杂的心肺运动试验有较好的一致性,目前普遍应用于临床和研究中[24]。
小 结
肺通气功能最基础的检查是肺量计测定,常作为肺功能检查的第一步。肺量计所测定的FEV1/FVC是评价气道阻塞的主要标准。峰流速仪也能反映气道阻塞情况,但稳定性较差,主要作为哮喘患者日常自我监测的手段。
肺量计测定配合支气管舒张剂或支气管刺激因素,可分别做支气管舒张试验和激发试验,检测患者是否存在可逆性气道阻塞。通常基础肺功能FEV1<70%可以选择舒张试验,FEV1>70%则应该考虑激发试验。
肺容积测定主要用于评估限制性肺疾病,TLC是肺容积的主要指标。肺间质性疾病是限制性肺疾病的典型代表。此外,一些肺外因素,如肥胖、胸腔积液、神经肌肉疾病等也能导致限制性通气功能障碍。
弥散功能检测的是气体从肺泡腔到毛细血管的转运过程。弥散障碍主要与肺泡膜或肺泡间隔的增厚及肺泡毛细血管床的破坏有关。肺间质性疾病、肺血管病变、肺气肿是造成弥散功能降低的常见原因。弥散功能检查常用于评估肺间质性疾病的严重程度和预后。
通气、容积和弥散功能检查的合理组合对不同疾病有一定的鉴别作用。如哮喘、慢性支气管炎和肺气肿都可致阻塞性通气障碍,但肺气肿往往有弥散功能降低,而前两者通常没有。肺间质性疾病和肺外因素均能导致限制性通气障碍,但肺间质性疾病一般有弥散障碍,而肺外因素则不会有此异常。
血气分析可直接反映呼吸系统功能对机体影响的最终结果,获取氧气和排出二氧化碳情况。血气分析最常用于确定是否需要吸氧或通气支持,也用于监测通气支持的效果。
最后需要强调的是,任何疾病都不能仅凭肺功能检查诊断,因为许多不同疾病可有相似的肺功能损害。肺功能检查应该与临床症状、体征、其他实验室检查和影像学资料相结合,才能最大程度发挥其作用。
[1]Crapo RO. Pulmonary function testing[J].N Engl J Med, 1994, 331:25-30.
[2]Miller MR, Hankinson J, Brusasco V, et al. Standardisation of spirometry[J].Eur Resp J, 2005, 26:319-338.
[3]Qaseem A, Wilt TJ, Weinberger SE, et al. Diagnosis and management of stable chronic obstructive pulmonary disease:a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society[J].Ann Intern Med, 2011, 155:179-191.
[4]Roberts SD, Farber MO, Knox KS, et al. FEV1FVC ratio of 70% misclassifies patients with obstruction at the extremes of age[J].Chest, 2006, 130:200-206.
[5]Mannino DM, Diaz-Cuzman E. Interpreting lung function data using 80% predicted and fixed thresholds identifies patients at increased risk of mortality[J].Chest, 2012, 141:73-80.
[6]Pellegrino R, Viegi G, Brusasco V, et al. Interpretative strategies for lung function tests[J].Eur Respir J, 2005, 26:948-968.
[7]Global Initiative for Asthma (GINA). The Global Strategy for Asthma Management and Prevention (2011). http:www.ginasthma.org
[8]Tashkin DP, Celli B, Decramer M, et al. Bronchodilator responsiveness in patients with COPD[J].Eur Respir J, 2008, 31:742-750.
[9]American Thoracic Society. Guidelines for methacholine and exercise challenge testing—1999[J].Am J Respir Crit Care Med, 2000, 161:309-329.
[10] American Thoracic SocietyEuropean Respiratory Society. Idiopathic pulmonary fibrosis:diagnosis and treatment[J].Am J Respir Crit Care Med, 2000, 161:646-664.
[11] Wanger J, Clausen JL, Coates A, et al. Standardisation of the measurement of lung volumes[J].Eur Respir J, 2005, 26:511-522.
[12] Quanjer PhH, Tammeling GJ, Cotes JE, et al. Lung volumes and forced ventilatory flows. Report working party standardization of lung function tests. European Community for Steel and Coal. Official statement of the European Respiratory Society[J].Eur Respir J Suppl, 1993, 16:5-40.
[13] Rodenstein DO, Goncette L, Stanescu DC. Extrathoracic airway changes during plethysmographic measurements of lung volume[J].Respir Physiol, 1983, 52:217-222.
[14] Macintyre N, Crapo RO, Viegi G, et al. Standardization of the single-breath determination of carbon monoxide uptake in the lung[J].Eur Respir J, 2005, 26:720-735.
[15] Aldrick TK, Spiro P. Maximal inspiratory pressure:does reproducibility indicate full effort?[J].Thorax, 1995, 50:40-43.
[16] Karvonen J, Soarelainen S, Nieminen MM. Measurement of respiratory muscle forces based on maximal inspiratory and expiratory pressures[J].Respiration, 1994, 61:28-31.
[17] Dubois AB, Botelho SY, Comroe JH. A new method for measurng airway resistance in man using a body plethysmograph: values in normal subjects and in patients with respiratory disease[J].J Clin Invest, 1956, 35:327-335.
[18] Mead J. Volume displacement body plethysmograph for measurements on human subjects[J].J Appl Physiol, 1960, 15:736-740.
[19] Van Noord JA, Clement J, Van de Westijne KP, et al. Total respiratory resistance and reactance in patients with asthma, chronic bronchitis, and emphysema[J].Am Rev Respir Dis, 1991, 143:922-927.
[20] Breen PH. Arterial blood gas and pH analysis:clinical approach and interpretation[J].Anesthesiol Clin North Am, 2001, 19:885-906.
[21] Giuliano KK, Higgins TL. New-generation pulse oximetry in the care of critically ill patients[J].Am J Crit Care 2005, 14: 26-37.
[22] Koulouris NG, Latsi P, Dimitroulis J, et al. Noninvasive measurement of mean alveolar carbon dioxide tension and Bohr’s dead space during tidal breathing[J].Eur Respir J, 2001, 17: 1167-1174.
[24] ATS Statement: guidelines for the six-minute walk test[J].Am J Respir Crit Care Med, 2002, 166: 111-117.

