C反应蛋白与系统性红斑狼疮的相关性
张晓慧,张卓莉
(北京大学第一医院风湿免疫科,北京 100034)
C反应蛋白(C-reactive protein,CRP)作为一种重要的急性期反应物,在感染及多种自身免疫性疾病中均发挥重要作用,因此在临床工作中常常作为协助诊断、监测疾病活动度及判断预后的重要指标[1-3]。系统性红斑狼疮(systemic lupus erythemotosus,SLE)是一种以多种自身抗体阳性和多系统损伤为主要特征的自身免疫性疾病。多数研究表明,SLE患者血清CRP水平多不升高或仅轻度升高[4],但是合并浆膜炎的SLE患者血清CRP可中度甚至明显升高。另外,在合并感染时CRP也可以呈不同程度的升高,在多数情况下可以作为狼疮活动及感染的鉴别指标之一[5-6]。然而,上述研究结果多来源于欧美白种人,众所周知,亚洲国家SLE的发病率远高于欧美国家,但CRP在中国SLE患者中的意义尚缺乏大规模的临床研究,SLE患者CRP水平与器官受累和感染之间的关系也尚无一致结论。基于以上原因,本研究对我国SLE患者血清CRP水平变化进行研究,并对其临床重要性进行探讨。
对象和方法
研究对象
选取2009年1月至2011年5月北京大学第一医院住院且病历资料完整的SLE患者入组。入选标准:(1)符合1997年美国风湿病学会关于SLE分类标准,并不伴随其他结缔组织病。(2)入院前或入院后1周内,CRP测定前后3 d内有血尿常规、24 h尿蛋白定量(urine total protein,UTP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)(ESR≤20 mm/1h为正常范围)、血清肌酐、抗核抗体、抗双链DNA抗体及补体检查结果,并取最近的1次检验结果计算。(3)入组时可以明确区分是否合并感染。
感染诊断
(1)症状、体征:发热(体温>37℃);呼吸系统感染者存在咳嗽、咳痰、咽痛等表现,查体可见咽红、扁桃体充血肿大或脓点、肺部可闻及啰音等;消化系统感染者存在腹痛、腹泻、恶心、呕吐等表现,查体可见腹部压痛、肠鸣音亢进等;泌尿系统感染者存在尿频、尿急、尿痛症状;皮肤及软组织感染者局部有红、肿、热、痛等表现。(2)经口服或静脉应用抗生素治疗,上述症状或体征好转。(3)辅助检查:病原学检查如血、尿、粪等培养阳性,尿、粪检查中可见大量白细胞;病毒DNA水平升高或病毒IgM抗体阳性;X线胸片或胸部CT检查可见肺部斑片状渗出影。(1)+(2)是必备条件,除上呼吸道感染外均需要辅助检查中的1项或多项支持。
CRP测定方法
采取速率散射比浊法测定,1.0 mg/L≤血清CRP≤8.0 mg/L为正常。
疾病活动度评分
采用SLE疾病活动指数(systemic lupus erythematosus diease activity index,SLEDAI)对疾病活动度进行评价,分为4个等级:0~4分为疾病基本无活动;5~9分为并轻度活动;10~14分为疾病中度活动;≥15分为疾病重度活动。
统计学处理
应用SPSS 19.0软件进行统计学分析。计量资料若呈正态分布或近似正态分布采用均数±标准差表示,偏态分布的计数资料采用中位数(最小值,最大值)表示。组间比较采用两独立样本的非参数检验,治疗前后比较采用两相关样本的非参数检验,各指标之间的相关性采用偏相关分析。利用受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)判断CRP协助鉴别感染的敏感性和特异性。P<0.05认为差异有统计学意义。
结 果
一般资料
共入组283例SLE患者,男49例,女234例,男女之比为1∶4.8;中位年龄31岁(8~70岁),发病年龄中位值为28岁,中位病程1.5年(0.03~35年)。其中,合并感染者44例(15.5%),不合并感染者239例(84.5%)。感染者与非感染者性别、年龄、发病年龄、病程比较差异均无统计学意义(P>0.05)。
44例SLE合并感染者,肺部感染19例,上呼吸道感染10例,皮肤软组织感染5例,消化道感染5例,泌尿系感染4例;另外1例患者表现为发热、皮疹,病毒学检测证实为巨细胞病毒感染。感染发生前1周内,8例患者未应用糖皮质激素,36例应用激素(其中5例接受激素冲击治疗);12例患者未应用免疫抑制剂,32例患者应用了羟氯喹、环磷酰胺、硫唑嘌呤、吗替麦考酚酯、来氟米特、长春新碱等免疫抑制剂。
不合并感染SLE患者情况
不合并感染SLE患者血清CRP水平:239例不合并感染者血清CRP水平为1.0~103.0 mg/L,中位数为2.6 mg/L。其中,CRP正常者200例(83.7%),CRP水平为8.0~20.0 mg/L者26例(10.9%),40.0~60.0 mg/L者5例(2.1%),60.0~100.0 mg/L者5例(2.1%),>100.0 mg/L者1例(0.4%)。6例CRP>60.0 mg/L者均为女性,年龄为20~40岁,表现多见皮疹(4例次)、关节炎(4例次)、发热(3例次)、肾脏受累(3例次)、血液系统受累(3例次)。
不合并感染SLE患者ESR水平:239例不合并感染的SLE患者,219例ESR数据完整,ESR水平为2~145 mm/1h,中位数为31 mm/1h。ESR正常者75例(34.2%),ESR水平为20~40 mm/1h者59例(26.9%),40~60 mm/1h者30例(13.7%),60~80 mm/1h 者29例(13.2%),80~100 mm/1h者10例(4.6%),>100 mm/h者16例(7.3%)。
免疫抑制治疗前后CRP及ESR水平变化:239例不合并感染者均接受激素及免疫抑制剂治疗,其中有治疗前后CRP、ESR、补体C3、UTP测定值可对比分析、且治疗后SLE病情改善的患者共44例。这44例患者中男11例,女33例,年龄为14~60岁,中位年龄为31.5岁,中位病程1.25年(0.04~35年)。除糖皮质激素外,同时使用硫酸羟氯喹和(或)环磷酰胺、硫唑嘌呤、吗替麦考酚酯、环孢素等免疫抑制剂;免疫抑制治疗时间平均为27 d。治疗前后CRP、ESR、UTP及SLEDAI均呈下降趋势,且差异有统计学意义(均P<0.05);补体C3水平升高,差异有统计学意义(P<0.05)(表1、图1)。
SLE疾病活动度:239例不合并感染的SLE患者,235例根据SLEDAI评分对疾病活动度进行了评估。其中,病情稳定者25例,轻度活动者40例,中度活动者60例,重度活动者110例。不同疾病活动患者间血清CRP水平差异无统计学意义(P>0.05),而ESR随疾病活动度的增高有升高趋势,差异有统计学意义(P<0.05)(表1、图2)。CRP和ESR与SLEDAI相关系数分别为0.014、0.212。
合并感染SLE患者情况
合并感染与不合并感染SLE患者实验室指标比较:44例SLE合并感染者,血清CRP为1.0~222.0 mg/L,中位数为13.6 mg/L,显著高于不合并感染SLE者,差异有统计学意义(P<0.05)。合并感染SLE患者ESR、中性粒细胞百分数显著高于不合并感染SLE者,差异有统计学意义(均P<0.05),但UTP和SLEDAI间差异无统计意义(均P>0.05)(表3)。

表1 不合并感染的系统性红斑狼疮患者免疫抑制治疗前后相关指标对比
SLEDAI:系统性红斑狼疮疾病活动指数
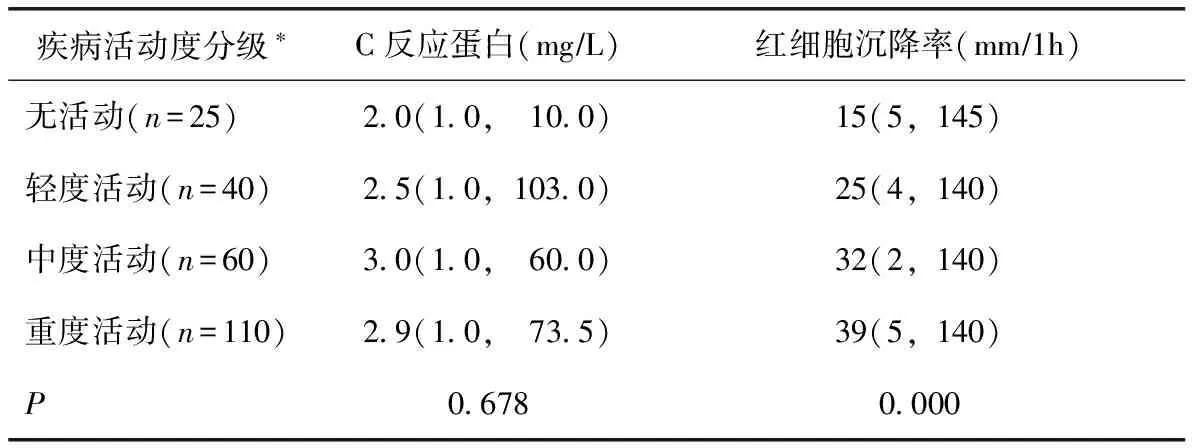
表2 不合并感染的系统性红斑狼疮患者不同疾病活动度时C反应蛋白及红细胞沉降率水平
*根据类风湿关节炎疾病活动指数分级

图2不同疾病活动度、不合并感染的系统性红斑狼疮患者C反应蛋白水平分布图
Fig2Distribution of C-reactive protein levels in systemic lupus erythemotosus patients with different disease activity

表3 系统性红斑狼疮合并感染者与不合并感染者实验室指标比较
CRP对诊断感染的敏感性和特异性:CRP判断SLE患者合并感染的敏感性及特异性ROC曲线显示,ROC曲线下面积为(0.811±0.040),CRP水平对于判断SLE患者是否合并感染有显著性意义(P=0.000)。CRP水平越大,感染可能性越大(95%可信区间:0.731~0.891)。当CRP=8.1 mg/L,判断感染的敏感性为69.8%;当CRP=21.3 mg/L,判断感染的敏感性为44.0%,特异性为95.0%(图3)。
实验室指标与SLE器官受累
浆膜炎:283例SLE患者中,可以明确判断有无浆膜炎者247例,无浆膜炎者187例,有浆膜炎者60例。有浆膜炎SLE患者与无浆膜炎者比较,病程短,ESR、UTP及SLEDAI高,差异均有统计学意义(均P<0.05);CRP水平差异无统计学意义(P>0.05)(表4)。
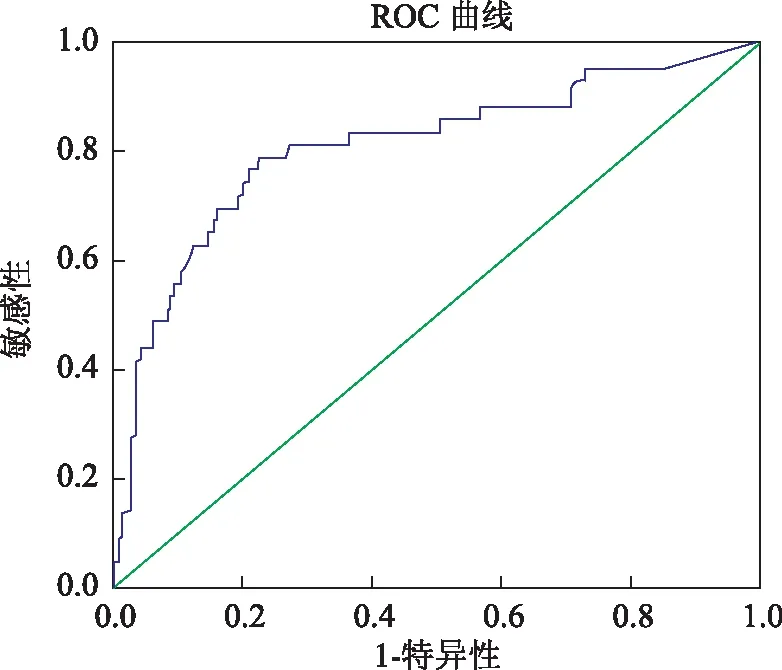
图3依据血清C反应蛋白水平判定系统性红斑狼疮合并感染敏感性和特异性ROC曲线
Fig3Application of ROC curve to evaluate C-reactive protein level to infection differential diagnosis in systemic lupus erythemotosus patients
肾脏病理改变:239例不合并感染的SLE患者中,有肾脏病理活检者70例,10例Ⅲ型狼疮肾炎中有2例为Ⅲ+Ⅴ型,44例Ⅳ型狼疮肾炎中有18例为Ⅳ+Ⅴ型(表5)。不同肾脏病理类型间,CRP及ESR水平差异无统计学意义(均P>0.05);Ⅱ、Ⅲ、Ⅳ、Ⅴ型狼疮肾炎患者UTP呈上升趋势,差异有统计学意义(P<0.05)(表5)。
其他器官受累:239例不合并感染的SLE患者,合并血液系统受累者CRP水平高于无血液系统受累者,差别有统计学意义(P<0.05);对外周血是否有白细胞、血小板、淋巴细胞减少或溶血性贫血患者CRP水平进行非参数检验时,差异未无统计学意义(均P>0.05)。此外,以性别和年龄为控制变量,对CRP与白细胞计数、血红蛋白含量、血小板计数、淋巴细胞计数分别进行偏相关分析,发现相关系数r波动于0.028~0.134,相关性较弱。而合并肾脏、皮肤黏膜、关节炎、神经系统、肺脏、消化系统受累者与不合并者比较,CRP水平差异均无统计学意义(均P>0.05)(表6)。

表4 浆膜炎与无浆膜炎系统性红斑狼疮患者临床指标比较
因Ⅰ型狼疮肾炎病例数少,非参数检验时未纳入Ⅰ型狼疮肾炎;组间比较,#P=0.083,△P=0.774,*P=0.011
表6 CRP水平与SLE患者器官受累的关系
Table 6 Relationship between CRP level and organ involvement in SLE patients [中位数(最小值,最大值),mgL]
组别血液系统肾脏皮肤黏膜关节炎例数CRP例数CRP例数CRP例数CRP不合并器官受累962 0(1 0,73 5)461 8(1 0,60 0)1112 8(1 0,103 0)1732 8(1 0,103 0)合并器官受累1393 2(1 0,103 0)1722 9(1 0,103 0)992 5(1 0,67 4)432 6(1 0,60 0)P0 0040 0870 4760 825组别血液系统肾脏皮肤黏膜例数CRP例数CRP例数CRP水平不合并器官受累1912 8(1 0,103 0)1942 6(1 0,103 0)2012 6(1 0,103 0)合并器官受累171 7(1 0,8 6)103 6(1 0,21 0)134 6(1 0,73 5)P0 1180 6710 158
CRP:C反应蛋白;SLE:系统性红班狼疮;*肺脏受累不包括浆膜炎
讨 论
CRP是急性时相反应蛋白之一,在1930年由美国洛克菲勒研究院发现,因可以和肺炎双球菌细胞壁上的C多糖发生沉淀反应而得名[7]。在发生炎性反应、感染及组织损伤时,肝脏受到炎性细胞因子(如白细胞介素6、肿瘤坏死因子等)的刺激而产生。CRP结构稳定,在血中半衰期大约为19 h,其浓度主要依赖于肝脏的生成量[8]。CRP具有多种生物学功能,参与多种自身生理及病理生理过程,在抵抗细菌感染、调节免疫及动脉粥样硬化过程中发挥重要作用,并且具有促炎和抗炎双重作用,但目前机制尚不明确[9]。
大多数结缔组织病(如风湿热、类风湿关节炎、幼年特发性关节炎、系统性血管炎等)在活动期时均可以导致血清CRP升高,因此CRP常被用作判断疾病活动度及预后的重要指标之一[3]。但是,SLE患者即使疾病处于活动期,血清CRP水平也并无显著升高[8]。目前其机制尚不完全明确,可能与CRP基因启动子区多态性[10]、CRP生成减少[4],抗体产生[9]、CRP血浆清除加快[11]等因素有关[12]。然而,SLE合并感染时CRP水平常表现为中度甚至重度升高,且CRP水平越高患者存在感染的可能性越大[5]。也有研究表明,不论是否合并感染,SLE合并浆膜炎时CRP可以呈现中度以上升高[13]。
本研究结果表明,不合并感染的239例SLE患者血清CRP水平多正常或轻度升高,中位数为2.6 mg/L,94.56%的患者血清CRP<20.0 mg/L。在协助判断SLE疾病活动及感染方面,ESR作为重要炎性指标之一,不论疾病活动、浆膜炎、感染时均可中度甚至重度升高,特异性较差;而CRP多在SLE合并感染时呈中重度升高,为临床中鉴别SLE疾病活动及感染提供了良好的指导,并且对于判断感染有较好的敏感性及特异性。既往对于CRP与SLE疾病活动度之间关系的相关研究较少,本研究以SLEDAI作为判断SLE疾病活动度的指标,结果发现,不同疾病活动度组之间患者的血清CRP水平差异无统计学意义,且CRP与SLEDAI相关性较弱。但经激素及免疫抑制剂治疗,随病情好转,血清CRP水平却可呈现下降趋势。导致这种现象的原因可能有以下几个方面:(1)SLEDAI评分系统中各个项目并非全部与全身炎性反应有关,所以采用SLEDAI评分来反映疾病活动度也完全可能与反映全身炎性反应程度的CRP水平不一致。(2)SLEDAI评分作为评价SLE疾病活动度的重要指标,对临床工作起重要的指导意义,但并非尽善尽美,一些SLE的重要表现,如胃肠道受累,并未被纳入SLEDAI评分系统中,故SLEDAI不是能够准确反映所有SLE患者的疾病活动度。(3)激素与免疫抑制剂可以有效减轻炎性反应,改善SLE患者的疾病活动性,因此在治疗过程中观察到两个指标同时下降也非常容易理解。另外,CRP参与多种生理与病理过程,发挥抗炎及促炎双重作用,在特定条件下可能某种作用占主导,免疫抑制治疗也可能对其起到抑制作用。
与本研究结果类似,既往多数研究表明血清CRP水平与SLE器官受累无明显相关性[14-15]。但近年来也有研究提示,CRP水平与SLE肌肉骨骼系统、肺动脉高压、肺间质病变、肾脏受累、心脏受累、胃肠道受累等相关[16-19]。然而,各报道之间一致性较差,目前尚存在争议。本研究仅发现血液系统受累与血清CRP水平之间存在相关性,但无论是否合并血液系统受累,其CRP水平的中位数均处于正常范围,并且差别不大,其临床指导意义可能有限。我们没有在SLE合并与不合并浆膜炎患者之间发现血清CRP水平存在差异,这一点与国外报道不相一致[12],结果差异可能与患者种族、病例数、病例选择偏移等因素有关。值得提出的是,有关CRP与狼疮合并浆膜炎方面,本研究是到目前为止在亚洲人群最大样本量的研究。此外,本研究首次较大样本量研究了血清CRP与狼疮病理类型之间的关系,发现CRP与狼疮病理类型无显著相关性。当然,为了进一步了解CRP水平与肾脏活动性指数之间的关系尚需更大样本量的研究。
综上所述,单纯SLE患者血清CRP水平多正常或轻度升高,然而,SLE合并感染时其血清CRP水平则可以显著升高,故CRP可以作为临床鉴别狼疮活动抑或感染的指标之一。血清CRP与狼疮疾病活动度无关,血液系统受累患者CRP水平高于无血液系统受累患者,但CRP与浆膜、肾脏、关节等器官受累无相关性,也与肾脏不同的病理改变无关。
(本文图1见封3)
[1]Clyne B, Olshaker JS. The C-reactive protein[J].J Emerg Med, 1999, 17:1019-1025.
[2]Mallya RK, de Beer FC, Berry H,et al. Correlation of clinical parameters of disease activity in rheumatoid arthritis with serum concentration of C-reactive protein and erythrocyte sedimentation rate[J].J Rheumatol, 1982, 9:224-228.
[3]Scott DL. Prognostic factors in early rheumatoid arthritis[J].Rheumatology (Oxford), 2000, 39:24-29.
[4]Gaitonde S, Samols D, Kushner I. C-reactive protein and systemic lupus erythematosus[J].Arthritis Rheum, 2008, 59:1814-1820.
[5]Roy S, Tan KT. Pyrexia and normal C-reactive protein (CRP) in patients with systemic lupus erythematosus:always consider the possibility of infection in febrile patients with systemic lupus erythematosus regardless of CRP levels[J].Rheumatology (Oxford), 2001, 40:349-350.
[6]de Carvalho JF, Hanaoka B,Szyper-Kravitz M,et al. C-Reactive protein and its implications in systemic lupus erythematosus[J].Acta Reumatol Port,2007, 32:317-322.
[7]Pepys MB, Baltz ML. Acute phase proteins with special reference to C-reactive protein and related proteins (pentaxins) and serum amyloid A protein[J].Adv Immunol, 1983,34:141-212.
[8]Pepys MB, Hirschfield GM. C-reactive protein:a critical update[J].J Clin Invest, 2003,111:1805-1812.
[9]Batuca J, Delgado Alves J. C-reactive protein in systemic lupus erythematosus[J].Autoimmunity, 2009,42:282-285.
[10] Russell AI, Cunninghame Graham DS, Shepherd C, et al. Polymorphism at the C-reactive protein locus influences gene expression and predisposes to systemic lupus erythematosus[J].Hum Mol Genet, 2004, 13:137-147.
[11] Figueredo MA, Rodriguez A, Ruiz-Yague M, et al. Autoantibodies against C-reactive protein:clinical associations in systemic lupus erythematosus and primary antiphospholipid syndrome[J].J Rheumatol, 2006,33:1980-1986.
[12] 张晓慧,李光韬,张卓莉. C反应蛋白与超敏C反应蛋白的监测及其临床意义[J].中华临床免疫和变态反应杂志, 2011,5:74-79.
[13] ter Borg EJ, Horst G, Limburg PC,et al. C-reactive protein levels during disease exacerbations and infections in systemic lupus erythematosus:a prospective longitudinal study[J].J Rheumatol, 1990, 17:1642-1648.
[14] Honig S, Gorevic P, Weissmann G. C-reactive protein in systemic lupus erythematosus[J].Arthritis Rheum, 1977, 20:1065-1070.
[15] Morrow WJ, Isenberg DA, Parry HF,et al. C-reactive protein in sera from patients with systemic lupus erythematosus[J].J Rheumatol, 1981,8:599-604.
[16] Spronk PE, ter Borg EJ, Kallenberg CG. Patients with systemic lupus erythematosus and Jaccoud’s arthropathy:a clinical subset with an increased C reactive protein response?[J].Ann Rheum Dis. 1992. 51:358-361.
[17] Mochizuki T, Aotsuka S, Satoh T. Clinical and laboratory features of lupus patients with complicating pulmonary disease[J].Respir Med,1999,93:95-101.
[18] Zuniga R, Markowitz GS, Arkachaisri T,et al. Identification of IgG subclasses and C-reactive protein in lupus nephritis:the relationship between the composition of immune deposits and FCgamma receptor type ⅡA alleles[J].Arthritis Rheum, 2003,48:460-470.
[19] Lee SS, Singh S, Link K,et al. High-sensitivity C-reactive protein as an associate of clinical subsets and organ damage in systemic lupus erythematosus[J].Semin Arthritis Rheum,2008,38:41-54.

