阴干对枫香脂中挥发油成分的影响
李建明, 宋清宏, 耿洪亚, 陈 川*
(1.上海市中医老年医学研究所,上海 201203;2.上海大学,上海 201900)
枫香脂为金缕梅科植物枫香LiquidambarformosanaHance的干燥树脂。枫香脂味辛、微苦,性平,归肺、脾经,具有活血止痛、解毒、生肌的功效,用于跌扑损伤、痈疽肿痛、吐血、衄血等[1]。枫香脂目前在医药、香料、蜡染、卫生、有机合成中间体等方面均有广泛的应用[2-6]。枫香脂经过水蒸汽蒸馏提取可以得到固体树脂和液体精油两部分,枫香脂饮片的主要成分即为固体树脂和少量的精油成分[7-8],《中国药典》2010年版一部规定枫香脂在7、8月间割裂树干,使树脂流出,10月至次年4月采收,阴干[1],阴干过程中挥发油成分也随之大幅度减少,而枫香脂挥发油具有活血化瘀、抑制癌细胞生长等功效[9-11]。中药加工必须尽可能在保留有效活性成分的前提下进行。对于枫香脂饮片炮制方法对药材本身的有效成分含有量及药效的影响目前尚未见报道。因此,本实验考察《中国药典》2010年版一部规定的阴干处理操作对于枫香脂有效成分挥发油的影响,按照《中国药典》2010年版一部描述的水蒸汽蒸馏法提取阴干前后枫香脂的挥发油,采用正交试验法考察浸泡时间、药材粉碎度、料液比和提取时间对枫香脂挥发油提取率的影响,以得油率为指标,通过直观分析和方差分析,得出最佳提取工艺,并利用气相色谱仪和气质联用仪对阴干前后枫香脂挥发油的成分和含有量进行分析。
1 仪器与试剂
1.1 仪器 调温电热套(DRT-TW型,郑州长城科工贸有限公司)、圆底烧瓶、球形冷凝管、蛇形冷凝管、集水管、圆底烧瓶、油水分离器、离心机(LXJ-ⅡB型,上海安亭科学仪器厂)、气相色谱仪(Agilent,GC6890N)、色谱柱(Agilent,HP-5),二苯基聚硅氧烷共聚物色谱柱,顶空进样皿(Agilent,7694E),美国 Agilent7890A-5975C 型气相色谱-质谱联用仪。
1.2 试剂 无水硫酸钠(Na2SO4,分析纯,购自国药集团),枫香脂购自云南省文山州,经由上海中医药大学魏莉教授鉴定为金缕梅科植物枫香树LiquidambarformosanaHance的树脂。枫香脂阴干样品为按照《中国药典》2010年版一部规定的枫香脂饮片制备方法,阴干所得。乙酸乙酯(EtOAc,分析纯,购自国药集团),二甲亚砜(DMSO,分析纯,购自国药集团)。
2 方法与结果
2.1 正交试验设计 按照正交试验法,根据《中国药典》2010年版一部规定的挥发油提取方法提取枫香脂挥发油,考察浸泡时间、粉碎程度、料液比和提取时间(未阴干枫香脂为具有流动性胶状物,因此仅选择干燥样品作为考察对象)对枫香脂挥发油提取率的影响,因素水平见表1。

表1 正交试验因素水平
取枫香脂饮片100 g,按L9(34)正交试验设计表确定的条件提取挥发油,冷却至室温,测定挥发油体积。
根据正交试验因素水平表,设计如下9组试验,并将结果列于表2中。
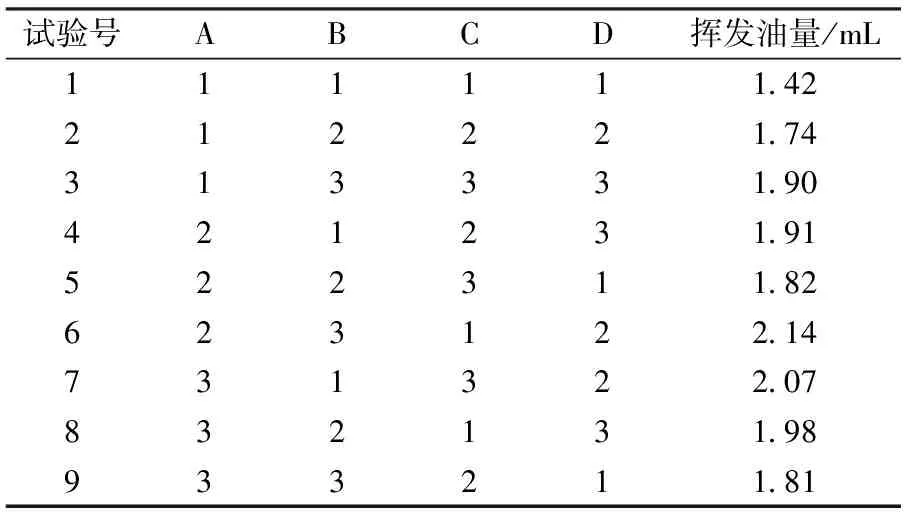
表2 正交试验设计(阴干样品)
以挥发油量为指标,将表2以直观数据的形式展出,如表3所示。
直观分析表明,以挥发油得率为指标,提取时间影响最大,其余因素按影响大小排序依次为:浸泡时间、粉碎度、料液比。选取最优的水平组合为A2B3C3D2。方差分析见表4。
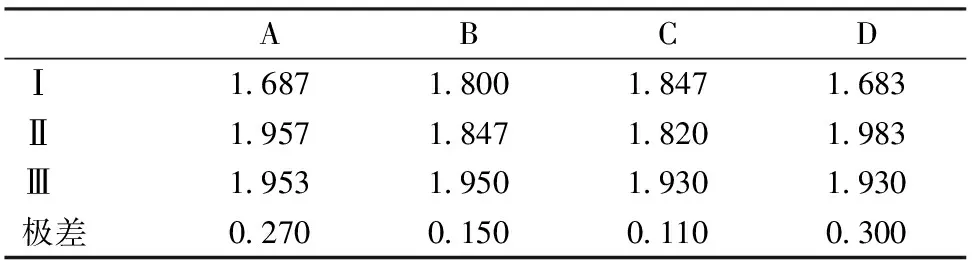
表3 正交试验直观分析(以挥发油得率为指标)
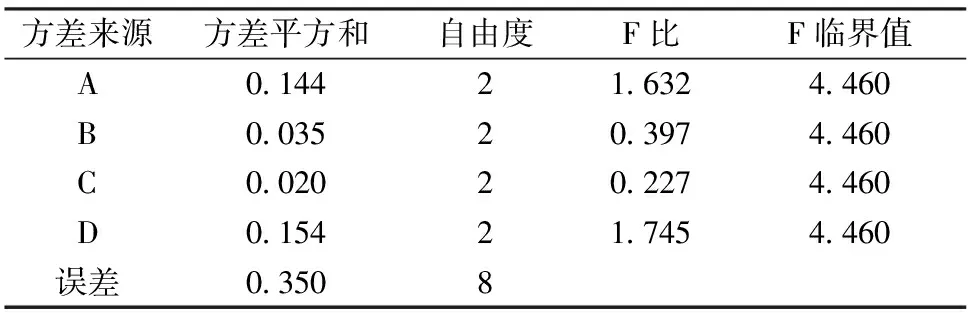
表4 正交试验方差分析(以挥发油得率为指标)
方差分析表明:提取时间、浸泡时间、粉碎目数、料液比对挥发油的提取量均没有显著性影响;但提取时间和浸泡时间影响远大于粉碎目数、料液比的影响。
综上,阴干后枫香脂挥发油的提取工艺定为:取一定量枫香脂,粉碎过40目筛,加9倍量水,浸泡12 h,水蒸汽提取5 h。按照相同的提取条件,取相同质量的新鲜枫香脂,无需粉碎加9倍量水浸泡12 h,采用水蒸汽蒸馏提取5 h。将收集得到的枫香脂挥发油离心去水,加入适量的无水硫酸钠静置过夜,充分去除其中的水分,量取体积,精确到0.01 mL,重复5次,按照公式(1)对提取率进行计算,并将所得结果列于表5。
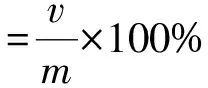
(1)
式中:v——所得枫香脂精油体积,单位mL;
m——加入枫香脂的质量,单位g。
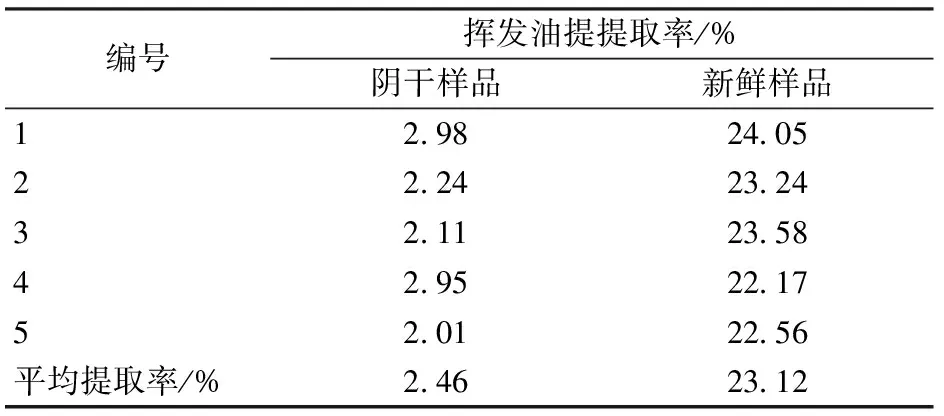
表5 正交试验结果
从表5中可以看到,按照正交试验结果得出的提取工艺重复性好,方法可靠。
考虑到枫香脂中含有的水分对提取率的影响,因此本实验在正交试验的基础上,对阴干前后枫香脂中含水量进行测定。参照中国人民共和国国标中(国标号HG 5-1341-1980)酚醛树脂水分测定方法,利用苯和水的共沸点为69.13 ℃的性质,在低温下测定阴干前后枫香脂中的含水量。具体方法如下,准确称取新鲜枫香脂和阴干后的枫香脂各5 g,转入500 mL的圆底烧瓶中,按照国标描述的方法搭建装置,在圆底烧瓶中加入无水苯200 mL,并加入少量沸石。水浴加热,保证冷凝管下部液滴的滴速为每秒3~4滴。待集水管中的水分不再增加时记录读数,按照式(2)计算含水量,重复5次,并将结果列于表6。

(2)
式中:V——集水管中水分读数,单位是mL;
G——样品质量,单位是g。

表6 水分测定结果
由表6可知, 阴干前后样品中的含水量相差不大,均在10%左右,因此阴干处理过程主要损失的是枫香脂中的挥发油成分。
2.2 气相色谱分析 将枫香脂精油用DMSO稀释100倍,温度梯度70 ℃保持10 min,5 ℃/min至200 ℃,20 ℃/min升温至300 ℃,保持10 min。顶空进样,进样器温度100 ℃,平衡时间45 min,平衡温度100 ℃,检测器温度FID250 ℃,载气(氮气)体积流量3 mL/min,柱温0~10 min保持80 ℃,随后12 ℃/min升至200 ℃。
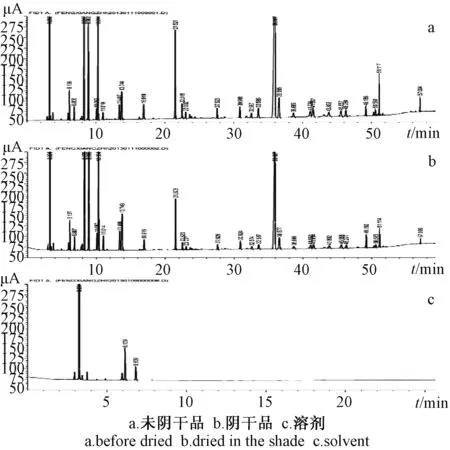
图1 枫香脂挥发油的气相图谱
根据图1可知阴干前后枫香脂挥发油所含有的成分种类无明显的差别,但由图谱中峰面积的比较可知,阴干处理对于枫香脂中所含的挥发油相对含有量具有很大影响。结合表7的数据可以得出,经过阴干处理,枫香脂挥发油中保留时间短的组分的相对含有量明显降低,结合提取率结果来看,在整体挥发油大幅度损失的情况下,挥发油中的低沸点组分降低幅度更大。
为进一步明确《中国药典》2010年版一部规定的枫香脂饮片加工方法对于枫香脂精油中的具体成分的影响,本实验在气色色谱分析的基础上,对阴干前后样品进行了GC-MS分析。
2.3 产物GC-MS分析
2.3.1 GC-MS条件 在文献[12]基础上稍加修改。气相色谱条件:HP -5MS 毛细管柱(30 m ×250 μm × 0.25 μm);起始柱温60 ℃,保持1 min,然后以10 ℃/min升温至250 ℃时保留10 min,以20 ℃/min升温,至280 ℃时保留9 min,以4 ℃/min升温至240 ℃;进样器温度310 ℃;载气为He;分流比10∶1;进样量1 μL。
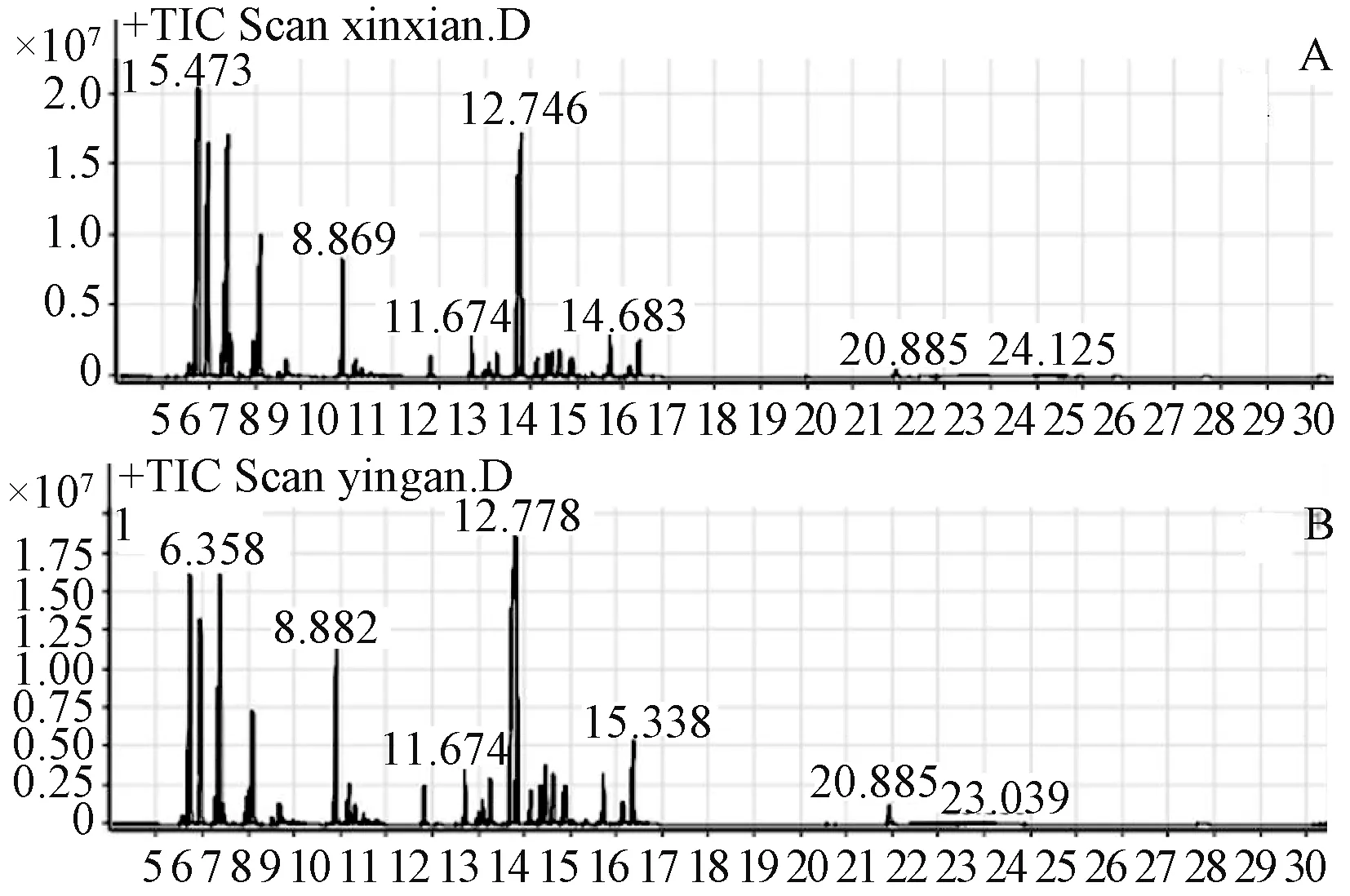
图2 阴干前后枫香脂挥发油总离子图

表7 气相数据
2.3.2 GC-MS测定结果 见表8。

表8 鲜品、干品枫香脂挥发油的化学成分分析结果
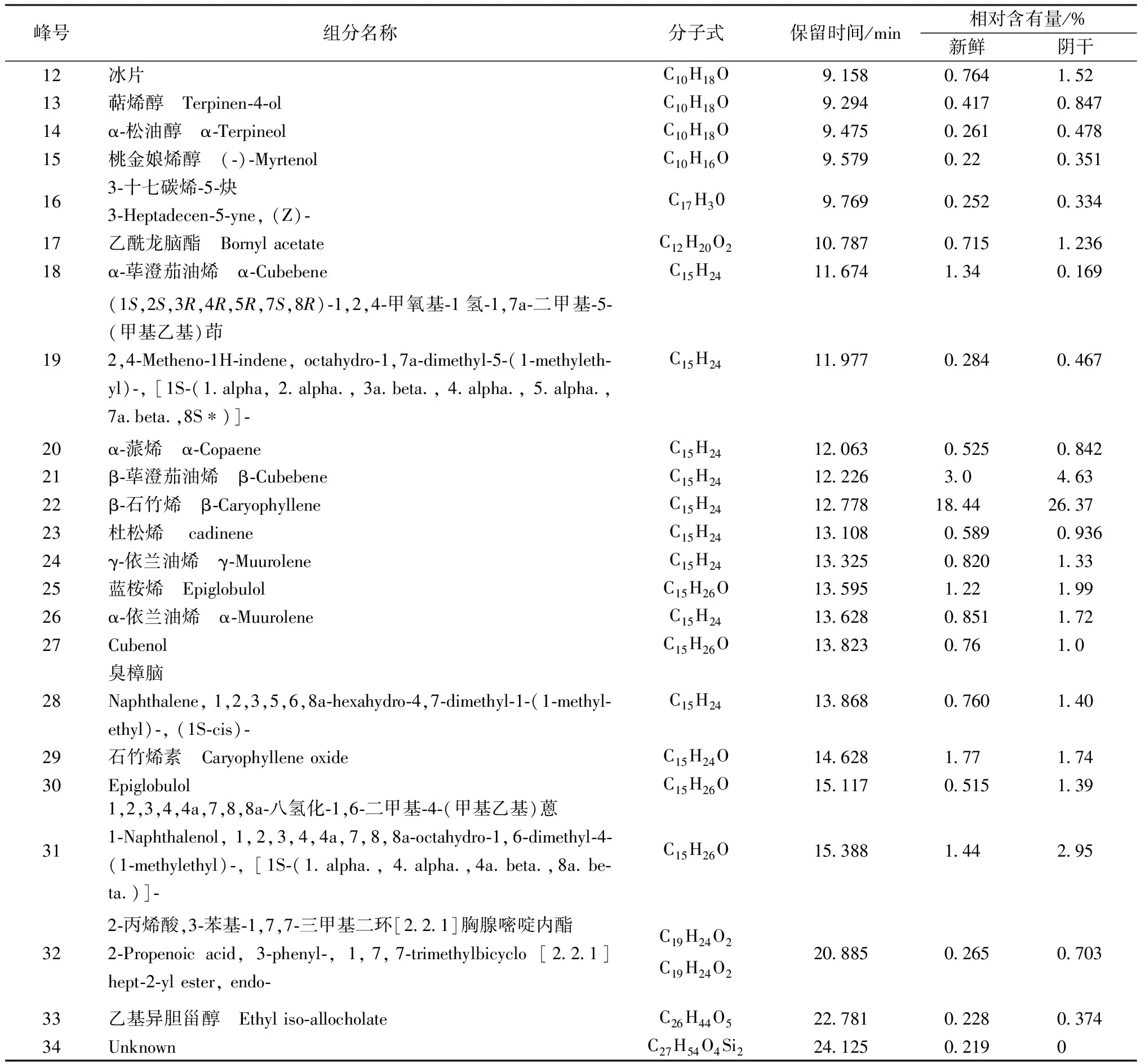
续表8
新鲜枫香脂和阴干后的枫香脂的主要成分相同,都是2,6,6-三甲基双环[3.1.1]庚-2-烯、蒎烯和莰烯(见表8),但是其相对含有量相差很大,新鲜枫香脂中3种组分的含有量分别为21.48%、11.35%和13.75%,对样品进行阴干处理后其相对含有量下降为11.97%、6.70%和9.47%,这与气相色谱中的结果相符,即保留时间短的组分相对含有量在阴干后降低。在枫香脂精油中莰烯、β-月桂烯[13-15]是合成医药,以及合成樟脑、香料等的重要原料。β-水芹烯是天然的杀虫剂[16-18]。α-蒎烯能够作用在白念珠菌的细胞壁上,作用后其形态和超微结构发生明显的变化,菌体中的物质露出,细胞破裂死亡[19-20]。而α-荜澄茄油烯、杜松烯、γ-依兰油烯、石竹烯素、桃金娘烯醇、樟脑、冰片等组分在医药领域也有广泛的,具有较高的医药价值,但是在阴干处理过程中其含有量大大降低。
此外,在阴干的样品中不含(Z,Z)-2,5-十五烯醇。同样的,保留时间为24.125的未知组分在阴干的样品中也不存在。
3 结论
本实验考察了阴干处理对于枫香脂饮片中挥发油的影响,结果表明阴干前后枫香脂中所含有的挥发油成分的相对组成和成分含有量有较大差异,枫香脂经过阴干处理后,其挥发油提取率仅为2.46%,而未经处理的新鲜枫香脂所提取的挥发油含有量为23.12%。新鲜枫香脂具有较好的流动性,阴干后失去流动性,其性状类似于新鲜枫香脂提取挥发油后所剩残渣。根据气相色谱仪分析结果,阴干处理对于枫香脂挥发油中所含有的成分种类没有太大影响,然而其中保留时间较短的成分相对含有量大幅降低,这一点也在GC-MS中得到验证,而枫香脂精油中的萜类化合物都属于保留时间较短的组分,已有文献报道植物中的单帖、三萜类化合物都属于植物活性成分[21-22]。GC-MS分析结果显示,枫香脂中的主要成分2,6,6-三甲基双环[3.1.1]庚-2-烯、蒎烯和莰烯的相对含有量均大幅下降,多种有效成分的量显著降低,且相对含有量都发生了较大的改变。
参考文献:
[1] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社, 2010:192.
[2] 宋 晓,曾 韬. 枫脂精油的化学组成[J]. 林产化学与工业,2010,30(5):40-44.
[3] 刘 虹,沈美英,何正洪.枫香树脂化学成分研究[J].林产化学与工业,1995,15(3):61-66.
[4] 周根大,陈友地.枫香脂提取芸香浸膏的工艺[J].林产化工通讯,1994,28(1):14-15.
[5] 刘 驰.枫香树脂化学成分[J].有机化学,1991,11(5):508-510.
[6] 陈友地,胡志东,顾 姻.枫香属黄酮类及萜类化合物研究[J].林产化学与工业,1991,11(2):157-164.
[7] 刘志林,倪士峰,刘 惠,等.枫香成分及其生物学活性研究进展[J].西北药学杂志,2009,24(6): 513-515.
[8] 李 蓓,车镇涛,郭济贤.胶束电动毛细管电泳色谱法测定苏合香和枫香脂中总桂皮酸的含量[J].上海医科大学学报,1999,26(5):380-381.
[9] 王立青,江荣高.枫香树中对激活的T-细胞核因子具抑制活性的齐墩果烷型三萜类化合物[J].国外医药植物药分册,2005,29(3):119-121.
[10] 福田优子.从胶皮枫香树果实中分离得到新的三萜化合物的结构及其抑癌作用[J].国外医学中医中药分册,2005,27(6):370-372.
[11] 程再兴,陈卫琳,陈锡铖,等.枫香脂挥发油及乙酸乙酯部位对小鼠血管活性因子的影响[J].中国医药导报,2011,8(36):37-38.
[12] 蔡爱华,赵志国,陈海珊,等.枫香与缺萼枫香果实挥发性成分的 GC-MS 分析[J].桂林理工大学学报,2012,32(2):245-249.
[13] 赵海泉,倪 峰,张金忠,等.莰烯酯化连续化工艺的研究[J].安徽化工,2011,37(1):43-45.
[14] 伍征华,张洁辉.用离子交换树脂催化莰烯和醋酸的加成酯化反应[J].高分子材料科学与工程,1987,1:012.
[15] 卢 奎,刘延奇.天然杀虫剂 β-水芹烯的合成[J].天然产物研究与开发,1996,8(4):28-32.
[16] 陆占国,小林直,张亚丽,等.以 β-月桂烯为原料的新单萜衍生物合成及构造解析[J]. 化学与黏合,2005,27(3):131-134.
[17] 赵英杰,姜永嘉.人工合成储粮保护剂-β-水芹烯对几种储粮害虫作用的研究[J]. 中国粮油学报,1997,12(6):1-4.
[18] 夏克坚,任宇红,聂丽娟,等. β-水芹烯的合成与应用[J]. 南昌大学学报:理科版,2001,25(4):380-382.
[19] 夏忠弟,毛学政,罗映辉.α-蒎烯抗真菌机制的研究[J].湖南医科大学学报,1999,24(6):507-509.
[20] 夏忠弟,余俊龙.α-蒎烯对白色念珠菌生物合成的影响[J].中国现代医学杂志,2000,10(1):44-46.
[21] 赵丹丹,李丹毅,华会明,等.文冠果花中一个新的单萜类化合物[J].中草药,2013,44(1):11-15.
[22] 许 枬,张宏达,谢 雪.泽泻中的新三萜成分[J].中草药,2012,43(5):841-843.