促红细胞生成素对急性心肌缺血再灌注后大鼠心肌凋亡基因表达影响的实验研究
康利鸽 何雪辉 田春凤 李昕 刘兰英
研究表明,促红细胞生成素(EPO)可对心肌损伤产生保护作用,并可抑制心室重构,但其确切的机制尚不清除[1,2]。本实验建立大鼠心肌缺血再灌注模型,观察EPO对急性心肌缺血再灌注心肌凋忘基因表达的影响,探讨EPO的心脏保护机制。
1 材料与方法
1.1 实验动物 健康雄性Sprague Dawley大鼠36只,清洁极,12~15周龄,体重210~260 g,由河北医科大学实验动物中心提供,按清洁极大鼠的要求饲养,自由进食水。
1.2 方法 通过阻断左冠状动脉前降支血流建立缺血再灌注模型。大鼠称重,经10%水合氯醛麻醉(3.0 ml/kg腹腔内注射)。经口气管插管接小动物呼吸机,潮气量约为30 ml,通气频率90次/min。去前胸正中切口,在3~4肋间进入胸腔,分离心包,从剑突下方向胸腔方向从两侧胸壁后方向上方适度挤压,使心脏跳出胸腔,在右心室流出道与左心房之间,据主动脉根部2 mm处用丝线(6-0)穿过左冠状动脉前降支,用线管法阻断冠脉血流。阻断后显示左心室壁变白,并出现室壁变白,心电图I、avL导联S-T段明显抬高(>1 mV),表明阻断成功,45 min后,松开丝线实施再灌注,保留丝线,逐层缝合,自主呼吸平稳后,撤掉呼吸机,拔出气管插管。假手术组(Sham组)只穿线绕过冠状动脉前降支而不阻断血流。术后大鼠保温,单笼放置,待清醒后再次称重,编号,按组分笼饲养。
1.3 分组36只大鼠随即分为3组,每组12只:(1)假手术组(Sham组):0.9%氯化钠溶液1 ml,直接腹腔注射,1次/d,共3 d。(2)缺血再灌注组(IR组):0.9%氯化钠溶液腹腔注射,1次/d,手术前连续3 d。(3)EOP组:EPO以3 000 U/kg直接腹腔注射,1次/d,手术前连续前3 d(济脉欣,河北省石家庄市华北制药厂生产)。
1.4 取材
1.4.1 染色:大鼠麻醉后迅速开胸,结扎保留丝线后,从下腔静脉注入伊文氏蓝2 ml。并静脉注射10%氯化钾溶液使心脏停跳于舒张末期,取出心脏,在4℃经高压处理的DEPC水中洗去残余血液,剪除多余血管及心房组织,分割左右心室(左心室包括室间隔部分)。蓝染区为正常灌注区,非蓝染区为缺血梗死期,非蓝染区中的淡染区为边缘区。
1.4.2 测定心肌梗死面积:自心尖部到结扎线沿心脏长轴将心肌组织分为5片,每片厚度1~2 mm,取第3片行TTC染色。将心肌组织切片放于2%TTC染色中,37℃温浴30 min,取出后清水冲洗,白色部分为梗死区域。梗死面积(%)=TTC染色梗死区面积∕伊文氏蓝染色的缺血梗死区面积。
1.4.3 TTC染色:取材完毕后边缘区心肌组织约100 mg,冰上操作。立即放入液氮速冻,于-80℃冰箱中保存,用于mRNA基因检测,另取边缘梗死区为150 mg左右两块,放入10%甲醛溶液中,4℃冰箱保存,用于HE染色及免疫组化染色。
1.4.4 免疫组化染色:Bcl-2、Bax、血管内皮生长因子(VEGF)蛋白在细胞浆及细胞核内表达,阳性反应均呈棕黄色或黄色。数据采集应用Motic Med 6.0数码医学图像分析系统,在相同的放大倍数下,每个切片计数10个视野,计算阳性染色算占面积。Bcl-2、Bax、VEGF以阳性细胞染色的平均光密度值(OD)表示抗原表达量。
1.5 用RT-PCR方法测定Bcl-2mRNA、BaxmRNA流程
1.5.1 主要仪器:美国PE公司Geneamp 9600型PCR仪,德国贺利氏公司RS-28高速低温离心机,德国Gilson微量移液器,美国UVP公司UVP凝胶扫描系统,国产DYY-Ⅲ桥式电泳仪等。
1.5.2 主要试剂:RNA提取试剂Trizol Reagent(Invitrogen公司),逆转录酶(AMV-RT),核糖核酸酶抑制剂(RNasin),dNTP、Taq DNA聚合酶(Taq DNA polymerase)、随机引物、琼脂糖(agarose)均购自美国Promega公司。逆转录多聚酶链反应(RT-PCR)流程如下。
1.5.3 目的基因引物的合成:引物序列依据文献报道设计,由北京赛百盛基因技术有限公司合成。大鼠Bcl-2引物序列:PCR 7.02 bp上游引物:5’-CAAGAATGCAAAGCACATCC-3’编号1106-371;下游引物:5’-ATCCCAGCCTCCGTTATCC-3’编号1106-372;大鼠Bax引物序列:PCR 407 bp;上游引物:5’-GGCTGGCAAGGTCACTGTCT-3’编号1106-373;下游引物:5’-AGCCACAAAGATGGTCACTGTCT-3’编号1106-374;大鼠心肌组织总RNA提取:取组织100 mg,严格按说明书规定步骤提取总RNA英语Qyant一步法RT-PCR试剂盒进行目的基因PCR扩增。见表1。
PCR热循环参数:β-actin和Bcl-2、Bax基因扩增条件为:50℃30 s,94℃2 min,然后94℃60 s,58℃60 s,65℃90 s(33个循环),65℃延伸10 min。扩增目的片段长同时扩增鼠β-actin用作内参照。
1.5.4 RT-PCR产物半定量:取RT-PCR产物4 μl,加上样缓冲液1 μl,在1.5%琼脂糖凝胶(含EB)上电泳,80 V,45 min,用UVP凝胶图像成像系统拍摄打印实验结果,用凝胶图像分析系统(Gel-Pro Analyzer Version 3.0)分析后果。以样本显示的灰度值与β-actin的灰度值之比作为样本mRNA的相对表达量。
1.6 统计学分析 应用SPSS 10.0统计软件,计量资料以±s表示,采用单因素方差分析,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 心肌组织边缘区HE染色形态学观察 与Sham组比较,IR组48 h、2周可见结构被明显破坏,心肌纤维水肿、溶解断裂、坏死甚至融合成大片状,胶原网络破坏,心肌细胞间结缔组织大量增多,可见炎性细胞浸润和心肌纤维化等。与IR组比较,EPO组在48 h、2周时上述形态学改变均明显减轻。
2.2 心肌梗死面积比较 与IR组比较,手术后24 h心肌梗死减少27.9%(43%对31%,P<0.01)。
2.3 边缘区Bcl-2、Bax和VEGF的表达 与IR组比较,EPO组Bcl-2蛋白表达在48 h、2周分别为27.7%、31.4%;Bax蛋白表达在48 h、2周均降低,分别降低为20.9%、18.0%(P<0.01)。Bcl-2/Bax比值在个时间点均显著增高(P<0.05);与IR组比较,EPO组Bcl-2mRNA各时间点均显著增高,BaxRNA各时间点均显著下降(P<0.01)。。EPO组VEGF蛋白表达在48 h、2周均增高,分别增高22.1%、21.4%(P<0.05或 <0.01)。见表1~3。
表1 边缘区Bcl-2与Bax的蛋白表达n=6,±s
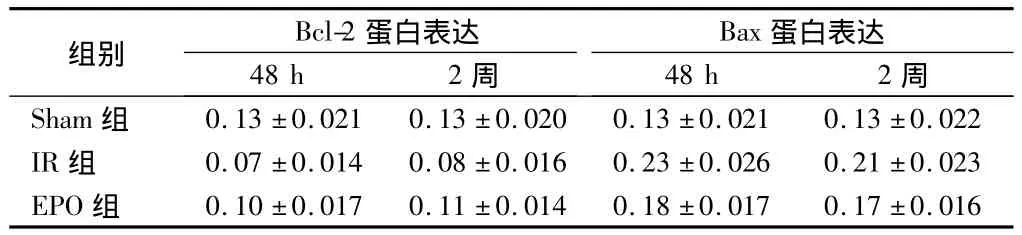
表1 边缘区Bcl-2与Bax的蛋白表达n=6,±s
组别Bcl-2蛋白表达48 h2周蛋白表达48 h2 Bax周Sham组0.13±0.0210.13±0.0200.13±0.0210.13±0.022 IR组0.07±0.0140.08±0.0160.23±0.0260.21±0.023 EPO组0.10±0.0170.11±0.0140.18±0.0170.17±0.016
表2 边缘区Bcl-2与BaxmRNA的相对表达n=6,±s

表2 边缘区Bcl-2与BaxmRNA的相对表达n=6,±s
组别Bcl-2mRNA 表达48 h2周表达48 h2 BaxmRNA周Sham组0.086±0.0110.87±0.0130.33±0.0260.32±0.024 IR组0.31±0.0210.50±0.0340.81±0.0220.67±0.021 EPO组0.51±0.0260.65±0.0340.72±0.390.62±0.020
表3 边缘区VEGF的蛋白表达n=6,±s
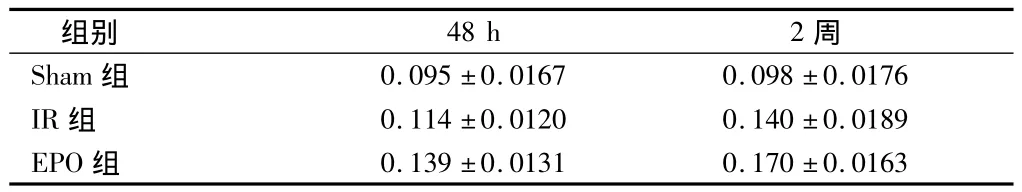
表3 边缘区VEGF的蛋白表达n=6,±s
组别48 h2周Sham组0.095±0.01670.098±0.0176 IR组0.114±0.01200.140±0.0189 EPO组0.139±0.01310.170±0.0163
3 讨论
研究发现,EPO除了促进造血功能以外,还具有保护心血管内皮功能,如抗心肌细胞凋亡的作用。在培养的大鼠心肌细胞缺氧损伤试验中发现,加入rhEPO的细胞凋亡率降低50%,证实EPO具有抗心肌细胞凋亡的作用[3,4]。本研究采用在体实验的方法,腹腔注射EPO,观察其抗凋亡的作用,其结果是EPO可在心肌损伤的早期和后期显著抑制促凋亡基因的表达,并减少损伤后在其心肌梗死的面积。
心肌组织中,抗凋亡基因Bcl-2及促凋亡基因Bax是影响细胞凋亡非常重要的基因,抗凋亡基因与促凋亡基因的相对比较在决定存亡中起关键作用[5]。本研究显示EPO对2个基因的影响从缺血再灌注损伤后24 h就发挥了明显的调节作用,并一直持续到第2周,而且Bcl-2和Bax的蛋白表达也发生了相应变化。
VEGF是一种与血管生长有关的特异性生长因子。VEGF生理功能为诱导血管内皮细胞的增殖和迁徙等作用[6]。Yockman等[7]通过VEGF基因治疗兔心肌梗死后发现能减少梗死面积,VEGF保护机制就是抑制细胞凋亡的同时,还可抑制p53、Fas、Bax蛋白的表达和增加Bcl-2的表达。本研究提示EPO可增加VEGF蛋白的表达,可能是EPO抗细胞凋亡的机制之一。
细胞凋亡在心肌缺血再灌注中起非常重要的作用,抑制缺血的边缘区心肌组织的凋亡可有效减少心肌梗死面积,并影响以后心室重构的过程[8],EPO可能通过抑制边缘区心肌细胞凋亡,或(和)促进心肌血管新生减少心肌梗死面积。
1 刘焱,张文亮,李增新.氯沙坦和螺内酯及联合应用对心肌梗死大鼠早期新生血管的影响.河北医药,2012,34:1455-1457.
2 Dong S,Cheng Y,Yang J,et al.MicroRNA Expression Signature and the Rolerof MicroRNA-21 in the Early Phase of Acute Myocardial Infarction.J Biol chem,2009,284:29514-29525.
3 Patel NS,Sharples EJ,Cuzzocrrea S,et al.Pretreatment with EPO reduces the injury and dysfunction caused by ischemia/reperfusion in the mouse kidney in vivo.Kidney Int,2004,66:983-989.
4 Calvillo L,Latini R,Kajstura J,et al.Recombinant human erythropoietin pretects the myocardium from ischemia-reperfusion injury and promotes beneficial renmodeling.Proc Natl Acad Sci USA,2003,100:4802-4806.
5 Danial NN,Korsmeyer SJ.Cell death:Critical control points.C cell,2004,116:205-219.
6 Vincenti V,Cassano C,Rocchi M,et al.Assignment of the vascuar endothelial growth factor gene to human chromosome 6p21.3.Circulation,1996,93:1493-1495.
7 Yockman JW,Choi D,Whitten MG,et al.Polymeric gene delivery of ischemia-inducible VEGF significantly attenuates infarct size and apoptosis following myocardial infarct.Gene Therapy,2009,16:127-135.
8 Ruixing Y,Jiaquan L,JIE C,et al.Intravenous administration of vascular endothelial growth factor improves caediac performance and inhibits cardiomyocyte apoptosis.Growth Factors,2006,24:209-217.

