双酶法小米黄酒酿造新工艺研究
王正元,惠 明*,尚小利,田 青,侯银臣
(1.河南工业大学 生物工程学院,河南 郑州 450001;2.郑州市中食农产品加工研究院,河南 郑州 450001)
0 引言
小米是我国主要谷物食粮之一,种植面积和产量均居世界首位.小米中富含人体所需的多种营养成分,其蛋白质、脂肪、维生素和矿物质含量均高于大米和玉米[1],且各组分比例适中,易于消化.黄酒主要是以稻米为原料,酿造而成的酒性醇和、酒精度低、营养丰富的原汁酒,是国家提倡发展的饮料酒之一[2].以小米为黄酒酿造原料,增加了小米资源的利用开发.目前,大多数黄酒企业仍采用传统的酿造工艺,成品酒批次间质量不稳定等因素严重影响了黄酒产业的发展[3].笔者采用α-淀粉酶、糖化酶进行蒸煮后小米淀粉的液化和糖化代替传统酿造工艺中不稳定的拌曲阶段,可明显缩短发酵周期,减少发酵阶段的杂菌生长,降低成品酒批次间的不稳定因素.
1 材料与方法
1.1 材料
酿酒酵母:安琪酿酒活性干酵母;小米:市售;α-淀粉酶:北京奥博星生物技术有限责任公司,固体,3 700 U/g;糖化酶:北京奥博星生物技术有限责任公司,固体,10 000 U/g;3,5-二硝基水杨酸:国药集团化学试剂有限公司,化学纯.
1.2 主要设备
723N 可见光分光光度计、PHS-3E 型pH 计:上海精密科学仪器有限公司;HH-4 型数显恒温水浴锅:河南智诚科技发展有限公司;SW-CJ-1G 型单人净化工作台:苏州净化设备有限公司;THZ-300C 恒温培养摇床、DHP-9052 型电热恒温培养箱:上海一恒科技有限公司;酒精度计:北京石景山玻璃仪器厂.
1.3 工艺流程
洗米→浸米→蒸煮→α-淀粉酶液化→糖化酶糖化→发酵→压榨过滤→杀菌→灌装→杀菌→成品.
1.4 测定方法
还原糖的测定:3,5-二硝基水杨酸比色定糖(DNS)法[4].
总酸的测定[5]:酸碱滴定法,指示剂为酚酞.
酒精度的测定方法[6]:容量法.
干基的测定[7]:直接恒质量法.
1.5 工艺操作要点及试验设计
1.5.1 浸米[8]与蒸饭[9]
小米浸泡24 h,浸米温度为20.0 ℃.蒸煮前,先将空甑蒸5~6 min,然后倾入浸泡过的小米,待冒汽后,加盖蒸煮,开始计算蒸米时间.
1.5.2 液化条件的选择
称取定量的蒸煮过的小米,按20 U/g 加入α-淀粉酶(酶活力3 700 U/g),混合均匀,每隔40 min 取样测定还原糖含量,以确定最佳液化时间.
按8、16、24、32、40 U/g 的添加量添加α-淀粉酶,在最佳液化时间时取样检测还原糖的含量以确定最佳酶添加量.
将蒸煮过的小米分别在75 ℃、80 ℃、85 ℃、90 ℃下保温后,添加α-淀粉酶以考察温度对液化液还原糖含量的影响.
将蒸煮后的小米保温至最佳液化温度,用HCl和NaOH 分别调整pH 值为3、4、5、6、7,添加α-淀粉酶混合均匀,检测还原糖含量以确定最佳液化pH 值.
1.5.3 糖化条件的选择
按照最佳液化条件液化结束后,添加适量的糖化酶在65 ℃条件下糖化35 h,每隔5 h 取样一次,并测定其还原糖含量,确定最佳糖化时间.
按110、130、150、170、190 U/g 的酶添加量往液化后的小米中添加糖化酶(酶活力10 000 U/g),考察糖化酶添加量对糖化结果的影响.
取样分别保温至50、55、60、65、70 ℃后,添加糖化酶以考察温度对糖化结果的影响.
用HCl 和NaOH 将pH 值调整为3、4、5、6、7,添加糖化酶并混匀,通过检测还原糖含量确定最佳糖化pH 值.
1.5.4 酒母的制备
将小米糖化后过滤,取其滤液分装于三角瓶中,加入盐酸调pH 至4.5,蒸汽灭菌20 min,冷却至28 ℃,用于活性干酵母活化,活化时间为15 min.
1.5.5 发酵条件的优化
采用单因素试验的方法分别考察发酵时间、发酵温度,活性干酵母添加量和蒸米时间对发酵完成后压榨过滤的滤液中还原糖含量、总酸含量、酒精度的影响,然后采用正交试验设计法进行发酵条件的优化.
2 结果与分析
2.1 小米淀粉液化糖化工艺条件的确定
由图1 可知,在液化和糖化过程中,随着酶解时间的延长,水解液DE 值逐渐增大,之后趋于稳定.在小米淀粉液化和糖化过程中,液化180 min和糖化25 h 内,酶解液DE 值增加较快,之后增加缓慢趋于稳定.为了节约时间以提高效率,确定液化时间为180 min,此时液化DE 值为18.61%;糖化时间为25 h,此时糖化DE 值为43.01%.

图1 液化时间对小米液化和糖化的影响
由图2 可知,随着α-淀粉酶和糖化酶添加量的增加,DE 值迅速升高;但当α-淀粉酶添加量大于32 U/g,糖化酶添加量大于150 U/g 时,DE 值基本趋于稳定.这是由于加酶量较小时,底物质量浓度大于酶的质量浓度,加酶量对反应速率的影响较大,DE 值随着加酶量的增加而快速增大;随着加酶浓度逐渐增大,酶促反应速率受底物浓度的制约,致使水解液DE 值基本不变.考虑到成本因素,32 U/g 为α-淀粉酶较优的加酶量,150 U/g 为糖化酶较优的加酶量.
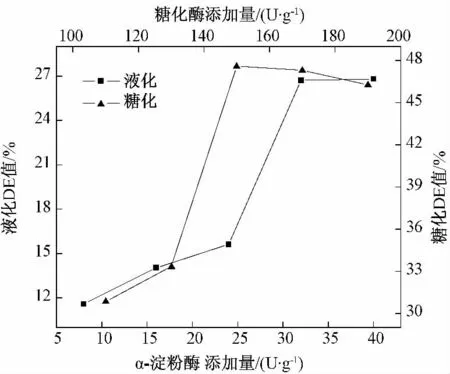
图2 酶添加量对小米液化和糖化的影响
由图3 可知,水解液DE 值随温度升高先增大后减少,液化温度为80 ℃时液化液DE 值最大,可达17.38%;糖化温度为60 ℃时最终糖化液DE 值最高,可达45.6%.酶解温度同时影响酶促反应速率和酶的活性,当温度较低时,随酶解温度的升高,酶促反应速率加快;而当温度超过最适温度时,随温度的继续升高,酶变性失活,酶促反应速率迅速下降.因此,液化的较优温度在80 ℃左右,糖化的较优温度在60 ℃左右.
由图4 可知,水解液DE 值随着pH 值的增大而先升高后降低,液化和糖化阶段最适pH 值都在6 左右,即蒸煮后小米在自然状态下酶解液DE 值最大,液化时DE 值达到16.81%,糖化时DE 值达到39.6%.pH 值会影响极性基团和酶分子构象的稳定性,从而影响酶分子中活性基团的构象以及与底物的结合力和催化能力.α-淀粉酶和糖化酶在最适作用pH 值范围内才能很好地发挥作用.水解液过碱或过酸都会影响其稳定性,导致酶活性降低,影响酶解速率.
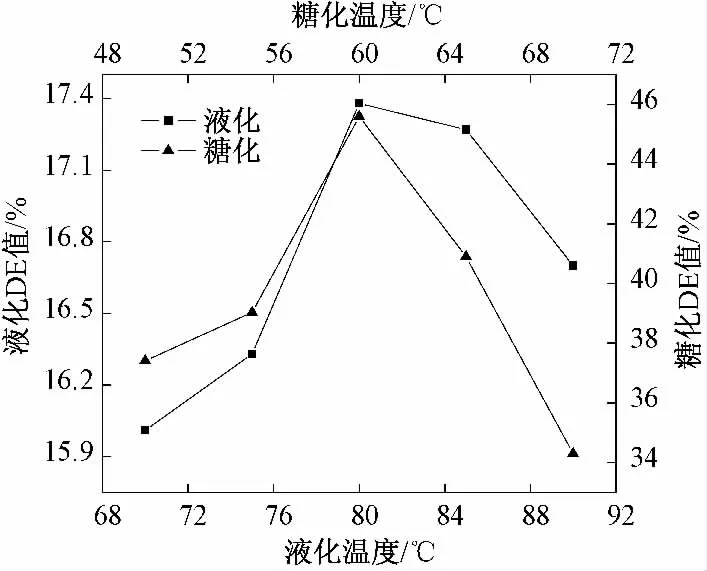
图3 温度对小米液化和糖化的影响
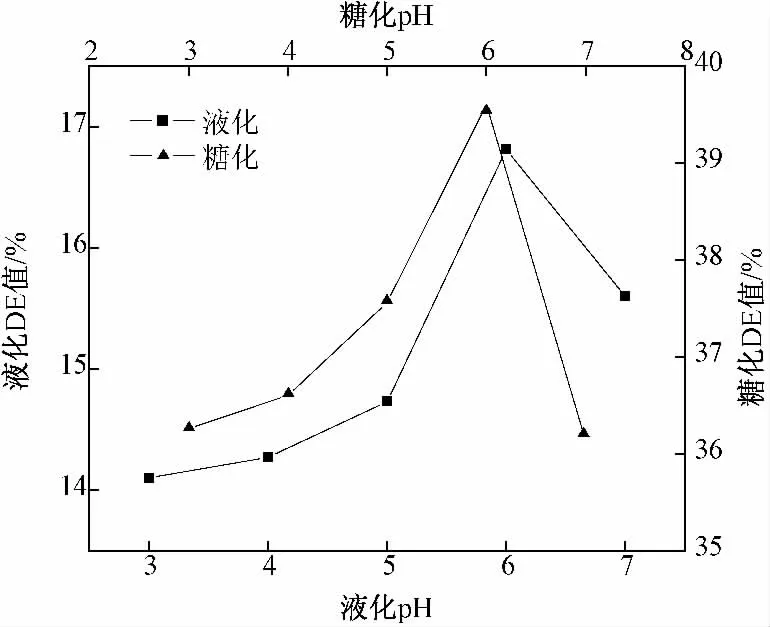
图4 pH 对小米液化和糖化的影响
2.2 发酵工艺参数的确定
2.2.1 发酵过程单因素试验结果与分析
由图5 可知,随蒸米时间的增加,发酵结束后滤液的酸度、酒精度和还原糖含量都呈现先增加后趋于稳定的趋势.蒸米时间过短,则造成液化糖化后还原糖含量低,影响后续酵母的繁殖,蒸米时间过长则造成能源资源的浪费,因此确定小米的蒸煮时间为40 min.
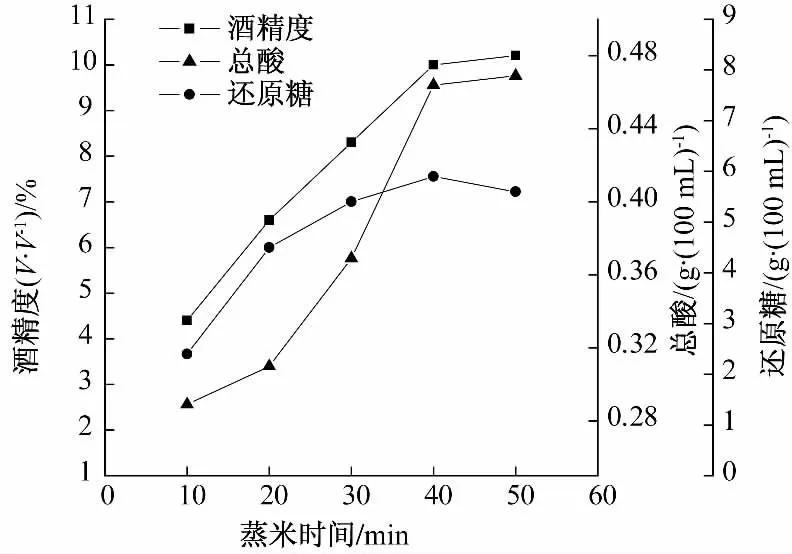
图5 蒸米时间对酒质的影响
由图6 可知,发酵温度过高,发酵结束时,其滤液的总酸含量较高,当发酵温度为32 ℃,滤液的总酸含量为0.6 g/100 mL.发酵温度较低时,酵母新陈代谢减慢,增殖缓慢,酵母消耗还原糖和产酒精量较少.因此,确定发酵温度为28 ℃.
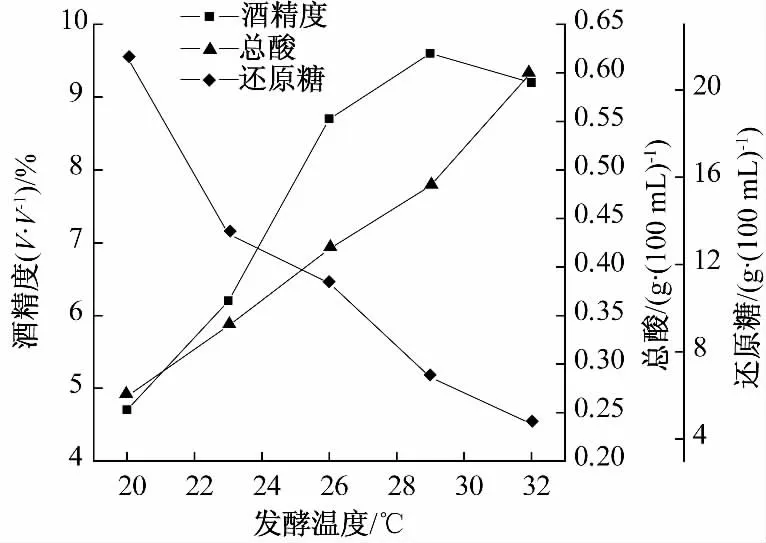
图6 发酵温度对酒质的影响
由图7 可知,随发酵时间的延长,在4 d 内滤液中的总酸含量和酒精度都增加较快,当发酵时间为5 d 时,酒精度含量有所降低,总酸含量增加.从黄酒酒质要求酒精度较高、酸度和还原糖含量适宜的角度,确定黄酒发酵时间为4 d.
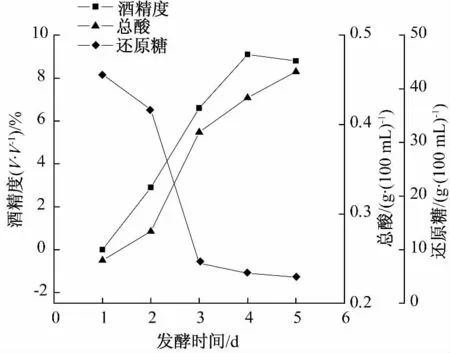
图7 发酵时间对酒质的影响
由图8 可知,酵母添加量较少时,发酵缓慢,滤液中酒精度较低,随酵母添加量的增加,滤液中酒精含量逐渐增高,从图8 可知,当酵母添加量超过0.2‰,由于酵母添加量较多,其繁殖消耗的还原糖含量增加,造成还原糖转化为酒精含量减少,所以酒精度有所降低.因此,确定活性干酵母的添加量为0.2‰.
2.2.2 发酵条件的优化(表1、表2)
试验表明:影响黄酒发酵质量的主要因素是发酵温度和发酵时间.各因素对还原糖含量影响的主次顺序为:A>B>D>C;各因素对总酸含量影响的主次顺序为:B>A>D>C;各因素对酒精度影响的主次顺序为A>D>B>C.温度对还原糖含量、总酸含量和酒精度的影响均显著,发酵时间对酸度含量的影响显著.因此,从还原糖含量、总酸含量、酒精度及节能方面考虑,确定小米黄酒的最佳工艺参数为发酵时间4 d,发酵温度28 ℃,酵母添加量0.2‰,最佳蒸米时间40 min.

图8 酵母添加量对酒质的影响
3 结论
在传统工艺制曲拌曲过程中,若制曲不当,生曲、烧曲的现象可能导致黄酒发酵“酸败”,拌曲时不只有糖化菌的存在还可引入其他腐败类产酸菌,影响酒质和口感[10-11].试验中用α-淀粉酶液化淀粉、糖化酶糖化淀粉明显减少了杂菌的生长,同时也消除了杂菌带给黄酒批次间的不稳定因素.控制合适的蒸米时间,是发酵原料处理的关键,若蒸米时间过短,有硬心现象的出现,则造成后续液化糖化阶段酶解困难,从而影响后续的酵母发酵.在小米液化过程中选择合适的温度和酶添加量对还原糖总量的影响较为重要,糖化过程中除了选择合适的温度外还应注意选择合适的糖化时间,以满足后续酵母的发酵所需的总还原糖含量.因此,确定蒸米时间为40 min,小米的液化时间为180 min,液化温度为80 ℃,液化pH 为6.0,α-淀粉酶添加量为32 U/g;糖化时间为25 h,糖化温度为60 ℃,糖化pH 为6.0,糖化酶添加量为150 U/g.在酵母发酵过程中,发酵温度和时间是形成酒质口感的关键因素,温度过高黄酒酸败的可能性增加,发酵时间过长也将导致总酸含量的增加、酒精度的降低.因此,确定最佳发酵时间为4 d,发酵温度为28 ℃.

表1 正交试验设计与结果

表2 正交试验方差分析
[1]康晓军,王贞强,淑英.小米黄酒中的芳香化合物[J].酿酒科技,2013(3):65-66.
[2]刘敬科,赵巍,付会期,等.小米黄酒酿造工艺的研究[J].粮食与饲料工业,2009(12):22-23.
[3]尚小利.黍米黄酒酿造新技术及功能成分研究[D].郑州:河南工业大学,2012.
[4]孙淑琴,邵冬梅.比色法快速测定糖化酶活力新方法[J].河北省科学院学报,1997(2):36-40.
[5]何凤云,朱子丰,汤丽丽.啤酒总酸测定方法的改进[J].酿酒科技,2008(3):93-94.
[6]张晓磊.啤酒酒精度测定方法探讨[J].酿酒科技,2004(4):93-94.
[7]王虹,秦维.105 ℃恒重法与两次烘干法对于玉米水分测定的定量研究[J].粮食加工,2008(2):82-83.
[8]毛青钟,俞关松.黄酒生产中不同品种米浸米特性的研究[J].酿酒,2010(4):70-73.
[9]陈艳,罗玮,顾秋亚,等.红曲糯米酒酿造工艺优化[J].酿酒科技,2012(11):20-24.
[10]毛青钟,鲁瑞刚,陈宝良,等.传统黄酒发酵醪的酸败及防止措施[J].酿酒科技,2006(7):73-77.
[11]谢广发,蔡国林,张健,等.成品黄酒的污染微生物研究进展[J].酿酒,2012(1):92-93.

