双亲性两嵌段共聚物膜与胶束融合机制的研究
王 玲,张海珍,刘天成,杨 恺
(1.苏州大学 软凝聚态物理及交叉研究中心,江苏 苏州 215006;2.云南民族大学 云南省生物高分子功能材料工程技术研究中心, 云南 昆明 650500)
嵌段共聚物的自组装是制备聚合物纳米材料的重要途径.嵌段共聚物各链段的结构和排列方式具有多样性,典型的有两嵌段、三嵌段和接枝等.其中,两嵌段共聚物由于其合成方法简单,尤其受到人们的重视.双亲性两嵌段共聚物是指共聚物的两个嵌段分别具有亲水性和疏水性.因此,双亲性两嵌段共聚物可以在水溶液中自发地形成各种有序的纳米结构,如胶束、平面双层膜和囊泡等[1].这些结构在生物、医学等许多方面都有着重要的研究价值和应用前景.
当共聚物的浓度达到临界胶束浓度(CMC)后[2],两嵌段共聚物会自组装成胶束.此时,聚合物上的疏水段和亲水段会发生微相分离,自发地形成疏水段向内,亲水段向外的核-壳结构.人们可以依据聚合物疏水链段的不同性质,通过化学、物理以及静电作用等方法将药物进行包裹.而且,聚合物胶束具有较低的临界胶束浓度,稀释后不易发生分离.因此,胶束被认为是一种重要的纳米尺度的药物输运载体[3-6].
当共聚物的浓度进一步增大后,双亲性两嵌段共聚物的聚集结构会再次发生变化而形成双分子层结构.这种奇特的结构与细胞中某些重要的生命现象联系紧密.例如,磷脂是一类重要的生物大分子,它所形成的双分子层正是细胞膜的基本骨架.从结构上来看,磷脂正属于双亲性两嵌段共聚物,同时具有疏水性尾部和亲水性头部.因此,对双亲性两嵌段共聚物的聚集结构进行研究,对于人们认识细胞膜的生物功能也具有重要意义.
嵌段共聚物不同聚集结构之间的融合现象具有重要的研究价值,如胶束之间的融合被视为共聚物聚集结构发生变化的一个重要途径.此外,胶束与磷脂双分子层的融合是利用胶束向细胞输送药物过程中的一个关键步骤,对于人们理解和控制胶束的药物输运特性具有十分重要的意义.但由于这些融合现象发生的时间尺度和空间尺度都非常小,在目前的实验手段下,很难直接通过实验观察来揭示融合现象的分子细节.因此,我们采用分子动力学模拟方法,对由PEG链形成的胶束与胶束、特别是胶束与双分子层之间的相互作用机制进行了研究.
1 实验部分
1.1 粗粒化模型和模拟参数
图1显示了模拟中采用的双亲性两嵌段共聚物的粗粒化模型.这一模型主要基于PEG表面活性剂而构造得到[7-9].Klein等[10]的工作表明,这个模型能形成与实验结果相吻合的双分子层膜和胶束结构,以及双分子层结构中的侧向对称性等特性[11].模拟中有2类PEG链,一类是中性的PEG模型链,由OA,EO,CM,CT 4种类型的珠子组成.根据珠子的亲疏水性质,这些珠子也可分为亲水的头部(OA,EO)和疏水的尾巴(CM,CT).另一类是带电模型,其中,亲水的头部由OA ,EC,EO组成,尾巴的结构与中性的PEG链相同.
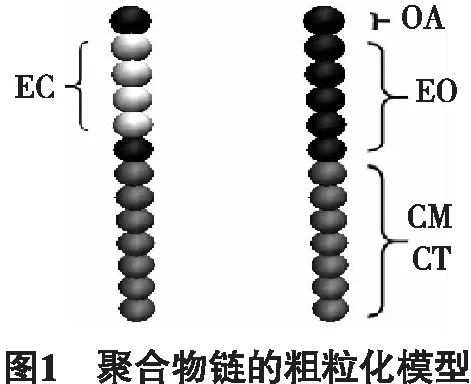
胶束和双分子层均是由PEG链自组装而成.此外,为了得到稳定的胶束结构,胶束中还会含有部分带电的PEG链.水(W)作为溶剂是显含在系统中的.在模拟过程中,两种不同类型的LJ势被用于珠子之间不同的相互作用:
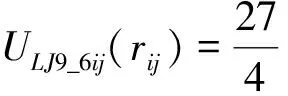

式中,rij为分子对间的距离,ε与σ为势能参数,因分子的种类而异.
模型上所有分子内的势能包括键的拉伸和角的扭转都用弹簧作用势来表示:
式中,ka,kb为弹性常数,r0、θ0分别为平衡位置和平衡角度.
1.2 模拟系统和条件
所有的模拟都采用Lammps软件包[12],在NPT系综中进行,系统的温度为T=298 K,p=10.325 kPa.模拟采用的盒子大小为10 nm×10 nm×15 nm.体系3个方向的边界上均采用周期性边界条件.
在模拟中,胶束可通过PEG链的自组装由、最初的随机分布状态而形成.模拟中发现,随着PEG链数目的变化,胶束的形状会由球形变成柱状(见图2).而对于双分子层膜,由于模拟中采用的嵌段共聚物分子中亲水基团与疏水基团的比例接近于1,因此,当PEG链的浓度较高时,它能进一步形成平面双分子层结构(厚度约为5.4 nm,其中疏水层厚度约为2.9 nm).在本文中,我们将这种平面双分子层结构简称为共聚物膜.

所有的模拟均进行至少3次,每次不少于 20 000 000 步(100 ns)的运算.
2 结果与讨论
2.1 胶束融合的模拟
当2个胶束接近时,它们可能会发生融合现象.在这一过程中,2个胶束会先靠近以形成胶束的局部接触.此时,接触区域的2个胶束的某些组成共聚物链段会纠缠变形,形成半融合结构.最后,2个胶束会完全融合成一个胶束(见图3).胶束的形状会影响它们之间的融合过程.模拟发现,球形胶束除了可以与球形胶束发生融合外,还可以与柱状胶束融合直接形成一个新的柱状胶束,见图3(b).但是,柱状胶束却很难与柱状胶束进行融合,见图4.这可能与不同形状的胶束在接触点附近的曲率特征不同有关.



2.2 双亲性两嵌段共聚物双层膜和胶束融合的模拟
球形胶束与聚合物膜也会发生融合(见图5).我们发现胶束在与膜接触后,胶束上PEG链段的亲水部分会与膜上的亲水头部相互缠绕,吸引在一起,然后形成一个半融合的状态.最终,随着PEG链的不断运动,胶束最终会完全融合在共聚物膜中,形成一个稳定的膜结构.
通过模拟,我们发现胶束与共聚物膜之间的距离(D)、组成胶束的聚合物的数目(N)等因素会强烈影响共聚物膜与胶束的融合.随着这些因素的变化,两者发生融合的可能性也随着发生变化(见图6).
对于由20个磷脂链组成的较小的胶束来说,胶束与聚合物膜之间的距离是影响两者融合的一个关键因素.当它们之间的初始距离很小时,胶束不会与膜发生融合;但随着胶束与膜的距离适当增加时,两者发生融合反应的可能性却会随之增加,见图6(a).
随着PEG链的数目增加(从20增加到50),胶束与聚合物膜之间距离的影响却发生变化.在所研究的间隔范围内(胶束离膜的距离从0~20 nm),无论胶束放在聚合物上方的何处,最终两者都很容易发生融合现象,见图6(b).
但当PEG链的数目进一步增加到100时,距离的影响又会再次改变.此时,只有当胶束距离膜较近时,胶束才会与膜发生融合现象;当胶束远离膜时,融合现象便不再发生,见图6(c).
融合过程总是伴随着能量的变化(见图7).若胶束与膜分离,则两者的相互作用能量为0;而当胶束与膜发生融合过程,能量则会发生显著变化.模拟发现,从胶束与共聚物膜接触开始,两者的相互作用能量就会有明显的变化,半融合结构的形成也对应有一个较小的能量壁垒;只有两者完全融合后,能量才会保持不变.

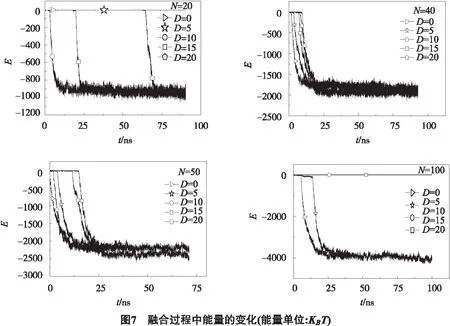
这些结果表明,对于胶束与共聚物膜的融合来说,两者之间的距离与胶束的大小的影响是相互耦合在一起的.融合需要胶束与共聚物膜的接触.因此,对于较大胶束来说,距离较小时有利于两者的融合.但胶束与共聚物膜在融合时,两者的相互作用还与组成胶束的聚合物链段的形变有关.对于不同大小的胶束,共聚物的构型也有所不同.因而共聚物链形变的程度和影响也不尽相同.对于小的胶束来说,由于组成的共聚物链数目较少,结构也更为松散,因此链段形变的影响程度也会更大,这可能是会阻碍两者的进一步融合的关键原因.结果还表明,控制胶束的大小可以对其药物输运的效率产生重要的影响.
3 结语
我们采用分子动力学方法对双亲性嵌段共聚物双层膜与胶束的融合机制进行研究.结果发现,胶束与共聚物膜之间的距离、组成胶束的聚合物的数目等因素会强烈影响两者的融合.当组成胶束的数目较少时,两者之间的距离强烈地影响膜与胶束的融合:当胶束离膜很近时,两者不会发生作用.而适当增加胶束与膜的距离时,胶束才会与膜发生融合现象.但随着胶束中PEG链的数目增加,两者的相互作用情况会随之发生变化.此时,距离将不再是影响其融合的主要因素.在调查的距离范围内,胶束都会与膜发生融合.如果进一步增加PEG链的数目,发现两者之间距离的影响又会发生变化.在这种情况下,只有胶束距离膜较近时,胶束才会与膜发生融合现象.我们的结果不仅有助于深入理解真实细胞中的融合现象,还对纳米尺度基因、药物载体的设计和开发具有一定的指导意义.
参考文献:
[1] DISCHER D E, EISENBERG A.Polymer vesicles[J].Science, 2002, 297(5583): 967-973.
[2] LEBARD D N, LEVINE B G, DEVANE R, et al.Premicelles and monomer exchange in aqueous surfactant solutions above and below the critical micelle concentration[J].Chemical Physics Letters,2012,522:38-42.
[3] RÖSLER A, VANDERMEULEN G W M, KLOK H A.Advanced drug delivery devices via self-assembly of amphiphilic block copolymers[J].Advancer drug delivery reviews,2012,64:270-279.
[4] MIYATA K, CHRISTIE R J,KATAOKA K.Polymeric micelles for mano-scale drug delivery[J].Reactive and Functional Polymers,2011,71(3):227-234.
[5] TORCHILIN V.Tumor delivery of macromolecular drugs based on the EPR effect[J].Advanced drug delivery reviews,2011,63(3):131-135.
[6] BAE Y, NISHIYAMA N, FUKUSHIMA S, et al.Preparation and biological characterization of polymeric micelle drug carriers with intracellular pH-triggered drug release property: tumor permeability, controlled subcellular drug distribution, and enhanced in vivo antitumor efficacy[J].Bioconjugate Chemistry, 2005, 16(1): 122-130.
[7] AYTON G S, VOTH G A.Systematic multiscale simulation of membrane protein systems[J].Current Opinion in Structural Biology, 2009, 19(2): 138-144.
[8] VARNIK F, BINDER K.Multiscale modeling of polymers at interfaces[J].International Journal of Materials Research, 2009, 100(11): 1494-1502.
[9] SHINODA W, DEVANE R, KLEIN M L.Multi-property fitting and parameterization of a coarse grained model for aqueous surfactants[J].Molecular Simulation, 2007, 33(1-2): 27-36.
[10] PANTANO D A, KLEIN M L, DISCHER D E, et al.Morphologies of charged diblock copolymers simulated with a neutral coarse-grained model[J].The Journal of Physical Chemistry B, 2011, 115(16): 4689-4695.
[11] PANTANO D A, MOORE P B, KLEIN M L, et al.Raft registration across bilayers in a molecularly detailed model[J].Soft Matter, 2011, 7(18): 8182-8191.
[12] PLIMPTON S.Fast parallel algorithms for short-range molecular dynamics[J].Journal of Computational Physics, 1995, 117(1): 1-19.

