肾小球电荷屏障研究的新进展
潘锡正(综述),林 芳(审校)
(1.桂林医学院,广西 桂林541001; 2.桂林市第二人民医院内分泌科,广西 桂林541001)
肾小球滤过是肾脏完成各种代谢产物排泄的主要形式,肾小球滤过膜损伤被普遍认为是导致肾病综合征,甚至是终末期肾衰竭的重要原因。美国2012年度肾脏病数据系统报告,终末期肾衰竭患者达594 374例,医疗费用占总医疗保险支出的6.3%[1];中国的终末期肾衰竭登记尚不完整,Zhang等[2]根据相关参数推测,在未来的10年中国终末期肾衰竭患者将达到650例/百万人口,肾脏替代治疗花费将占国家医药费用的10%。肾小球滤过屏障进展机制的了解对于解决肾脏疾病相关问题很有必要。
1 肾小球滤过膜屏障模型构成
经典的肾小球滤过屏障模型从里向外由三层构成。内层是毛细血管的内皮细胞。内皮细胞上有许多直径为60~100 nm的小孔,是白蛋白分子直径(3.6 nm)的15倍以上,称为窗孔[3]。中层是非细胞性的基膜,呈微纤维网状结构。基膜上有直径为2~8 nm的多角形网孔,是肾小球防止大分子蛋白质滤过的主要屏障。外层是肾小球的上皮细胞。上皮细胞具有足突,相互交错的足突之间形成裂隙。裂隙上有一层滤过裂隙隔膜,膜上有直径为4~14 nm的孔,是滤过的最后一道屏障[4]。滤过膜的电荷可由其表面的化学基团的解离、化学键、电解质溶液中物理吸附的离子所决定。肾小球滤过膜上的孔径大小决定了其分子屏障,一般来说,分子有效半径<2.0 nm的中性物质可自由滤过,有效半径>4.2 nm的物质则不能滤过,有效半径在2.0~4.2 nm之间的各种物质随有效半径的增加,其滤过量逐渐减少。Bohrer等[5]用不同带电荷的右旋糖酐进行实验观察到,即使有效半径相同,由于其带不同电荷导致右旋糖酐的清除率呈现指数级的升降变化,表明滤过膜电荷屏障在决定滤过物质通透性方面具有重要作用。
2 流动电位理论
2.1流动电位理论的提出 Hausmann等[6]提出了流动电位影响肾小球滤过屏障的通透性,他们用显微穿刺术,在两栖动物斑泥螈肾脏内直接测量到滤液穿过肾小球滤过膜时产生的电场,这个电场在肾小囊内为负,在肾脏毛细血管腔内为正,且与肾小球滤过压成正比,其测量的平均值为每-0.045 mV/10 cm H2O(1 cm H2O=0.098 kPa)有效滤过压,在正常人体,靠近入球小动脉端有效滤过压约为10 mm Hg(1 mm Hg=0.133 kPa),出球小动脉端有效滤过压接近0 mm Hg,平均有效滤过压约为5 mm Hg,则推测其电位差的范围为0.1~0.5 mV,假如肾小球滤过膜厚度为600 nm,那么跨过肾小球滤过膜的场强可达到800 V/m。Hausmann等[6]提出了滤过压相关的电场产生的机制,即流动电位。因此,推测小的阴离子(如Cl-、HCO3-等)相对于阳离子(如Na+、K+等)更多地聚集在肾小囊内,从而产生了一个在肾小球囊内为负的电场。
2.2流动电位的产生机制 流动电位是液体沿着带电的微血管或者孔径切线运动时,带电荷粒子由于受到滑面电位(zeta电位)的影响,导致下游电荷积累,在上下游之间产生电位差,即产生流动电位[7]。结合斯特恩双电层的理论模型(如图1A)来进一步阐述这一机制:肾小球滤过膜主要含有负电荷,当在滤过压作用时流体穿过狭窄的滤过通道,由于摩擦作用,在液层中部流速最大,而滤过膜孔壁处流速为0,因此存在一个固定液相与流动液相之间的分界面,称为滑移面;滑移面以内是滤过膜静电引力作用下紧紧吸附的阳离子构成的斯特恩层(即固定层),实质上是一个位移界面,该界面上的电位称为界面动电位,或者称zeta电位,其导致扩散层(即可移动层)中特定区域内(如图A中a区)带电离子的分布不均一,主要表现为正电荷的离子多于负电荷离子,其电位的影响随着离滤过膜表面的距离增加而减弱,在电位为0的部位正负离子的浓度相同,液体流动时靠近滤过膜表面的双电层中的扩散层将带着更多的正电荷离子一起向滤过膜的另一端流动,这样就出现了电流,这种因流体流动而引发的电流称为流动电流,其在滤过膜孔隙两端产生的电位差则称为流动电位[8-10]。
上述双电层理论模型预测的滤过膜产生了动电效应,在离子流的末端即肾小囊内为正电荷离子聚集,与Hausmann等[6]实验观察到的动电效应模型相反。
Delgado等[7]认为,任何带电滤过膜的具体电性质均由其周围的离子空间分布所决定,且将斯特恩层中被吸附离子分成普通离子和特定吸附离子。普通离子仅通过静电引力吸附,特定吸附的离子(通常是二价离子)具有除了静电引力之外附加的化学的或者特有的表面吸附力。这种特定吸附的离子可能导致滤过膜过分充电而表现为带正电荷的效应,这将会改变滑动面电位,颠倒zeta电位的极性,从而改变肾小球滤过膜上扩散层电荷分布(如图1B)。结果使更多的阴离子在滤过膜孔隙另一端为聚集,即形成肾小球囊内为负,在肾脏毛细血管腔内为正的电场。可见,在上述斑泥螈的肾小球滤过膜过度吸附而颠倒zeta电位发挥了重要作用。
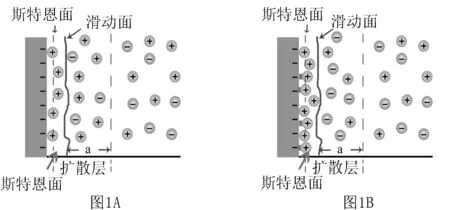
图1 斯特恩双电层理论模型[11]
2.3肾小球流动电位的功能 最接近肾小球滤过膜的是持续静-静脉血液滤过,且已被广泛用于终末肾病患者的替代治疗。任何持续静-静脉血液滤过最终会被堵塞,但是肾小球滤过膜在生理情况下从没有显示出任何堵塞的迹象。在持续静-静脉血液滤过系统,仅考虑了对流和扩散两种力量的影响[12]。
Akilesh等[13]的实验观察到肾小球足细胞是内吞活跃细胞,具有清除滤过膜功能。人类的肾脏每日从血浆中滤过180 L的原尿,假设肾小球滤过面积是1 m2,约10 kg/m2的蛋白被从肾小球滤过膜移走。阻塞在滤过膜中的分子会迅速被足细胞,甚至是内皮细胞、系膜细胞所吞噬。研究表明内皮细胞层厚度为200~400 nm,然而假设细胞层(内皮细胞、足细胞,不包括肾小球基膜) 总共厚约600 nm,滤过膜面积1 m2,约600 mg/m2细胞(内皮细胞和足细胞),假如它们每日最多能处理其自身容积的蛋白,总量仍少于总共滤过负荷的0.006%[14]。这对于清除血浆蛋白的溶液是不足够的。许多研究中将滤过膜看成是一个凝胶,产生一个跨越类似凝胶的滤过膜的电场对于避免滤过膜堵塞是一个简单且有效的解决方案[15-16]。因为血浆中大分子往往产生固定的负电荷,近中性、正电荷的大分子生理情况下在血浆中很少存在,因此大分子阴离子穿过滤过膜时受电场影响回到血液中。
Ciarimboli等[17]用含白蛋白的灌注液在离体小鼠肾脏的实验,从三个不同方面证明动电效应在肾小球滤过中的重要性,其一,用不同pH(4.0、5.3、7.4、8.75)的灌注液进行实验时,观察到白蛋白的滤过系数随着灌注液的pH增加而减少,其原因是白蛋白在其等电点(isoelectric point PI 4-5)附近,即pH=4.0时,所带净电荷趋于0,呈电中性,因此白蛋白受跨过滤过膜的电场影响最小,白蛋白的滤过系数最大,当其升高灌注液的pH时,白蛋白所带负电荷不断增加,受跨过滤过膜的电场影响逐渐增加,则白蛋白的滤过系数逐渐减小;其二,用鱼精蛋白去中和肾小球滤过膜上的负电荷观察到白蛋白的通透性增加;其三,用阳离子化的方法使白蛋白带正电荷,观察到白蛋白的通透性亦增加。
Rennke等[18]用追踪法在离体灌注的小鼠肾脏中电镜下观察带有不同电荷的铁蛋白(等电点为6~8)被阻止情况,当用带负电荷的铁蛋白时,观察到其大部分被阻止在肾小球滤过膜的内皮细胞和基膜层;当用带中性电的铁蛋白时,较多的铁蛋白进入滤过膜,被阻止在肾小球基膜和裂隙膈膜层;当用带正电荷的铁蛋白时(等电点>8.8),铁蛋白被吸附到带负电荷的内皮多糖上,此外相对最多的带正电荷的铁蛋白阻止在滤液中。从以上实验中可以得出三个结论:①内皮细胞和它的多糖不太可能起到主要的机械屏障作用,因为内皮细胞窗孔为白蛋白分子直径的15倍以上,最可能的阻止负电荷铁蛋白进入滤过膜的是电场[1];②当电荷效应不存在时,肾小球基膜和裂隙膈膜相当于一个被动的滤过膜的大小选择器(从中性铁蛋白中可以观察到);③阻止和聚集在滤液中最多的是带正电荷的铁蛋白,其原因是:带正电铁蛋白改变了电泳方向,与对流和扩散起到了协同作用,从而使正电铁蛋白更容易通过滤过液,更少被阻止,反而导致铁蛋白堵塞了滤过膜,大量的铁蛋白被阻止进入到滤过膜。这些发现再次证明了跨过滤过膜电场的重要性。
2.4肾小球静电作用力与流动电位的区别与联系 肾小球静电作用力描述的是滤过膜的固定电荷对具有通透性的带电颗粒之间的影响,肾小球静电作用力是一个静止的因素。流动电位描述的是液体沿着带电的滤过膜运动时,带电荷粒子在上下游之间产生电位差。从上述流动电位双电层模型中可见,肾小球静电作用力是其流动电位产生的必要条件。因此很难将两者的效应区分开,两者共同构成肾小球滤过的电荷屏障,当疾病损伤滤过膜上的固定电荷时,流动电位的产生亦受影响。
3 肾小球电荷屏障损伤与蛋白尿
研究证实,内皮细胞窗孔和窗孔之间存在一层多糖包被,称为“糖萼”,由蛋白多糖、糖蛋白、糖胺多糖和血浆蛋白等物质构成,是参与维持肾小球滤过膜电荷选择屏障的物质基础[19]。糖尿病肾病患者内皮细胞糖萼减少,其程度与蛋白尿的形成相关[20]。另外有研究发现,降解或破坏内皮细胞糖萼,虽然基膜结构正常,但肾小球对血白蛋白的通透性显著增加[19]。内皮细胞和它的多糖不太可能起到主要的机械屏障作用[3]。因此,内皮细胞的特殊结构糖萼是阻止血浆白蛋白滤过起到重要电荷屏障作用,其减少和结构破坏将导致蛋白尿。肾小球基膜为凝胶状的细胞外基质,主要由Ⅳ型胶原、层粘连蛋白、巢蛋白以及硫酸类肝素(heparan sulfate,HS)等构成带负电荷的电荷屏障[21]。研究发现,选择性敲除层粘连蛋白β2基因的小鼠肾小球基膜超微结构似乎完整,但层粘连蛋白阴电荷分布异常,出生后早期即产生白蛋白尿,而后出现足突融合和裂孔膜缺失,表现为先天性肾病综合征伴视网膜、神经肌肉接头病变[22]。HS作为肾小球基膜中的主要带负电荷物质,在糖尿病肾病中的含量减少导致肾小球基膜对白蛋白的通透性增加,进而发生蛋白尿[23]。
足细胞表面覆盖有一层带负电荷的唾液酸糖蛋白,是参与维持肾小球滤过膜电荷选择屏障的物质基础[24]。文献证实,无论1型还是2型糖尿病肾病,均存在肾小球足细胞数目减少[ 25-27]。在糖尿病的微量白蛋白尿期,足细胞的密度已经减少,到中大量蛋白尿期足细胞密度下降更加明显,这与足细胞数目丢失情况的研究相一致。可见,糖尿病肾病患者肾小球足细胞损伤、脱落和数目减少将导致电荷屏障和分子屏障均受损,而产生蛋白尿。
4 肝素治疗肾小球疾病的研究
近年来,肝素因其带有大量负电荷,有利于保护肾小球基膜负电荷屏障,防止白蛋白漏出,在临床上用于肾脏疾病的治疗,已经得到普遍认同。Rops等[28]在狼疮性肾炎患者及小鼠的研究中发现,肾小球基膜上HS的表达下降,导致固定负电荷丢失,应用肝素治疗后,肾小球基膜上HS恢复正常,且有助于阻止免疫球蛋白在肾小球沉积。电荷屏障的改变在肾病综合征的致病过程中起着非常重要的作用,使用肝素后,能促进蛋白尿转阴,减低蛋白尿排出,有利于血浆白蛋白恢复,减少长期蛋白尿对肾脏的损害[29]。在糖尿病肾病临床蛋白尿期,应用肝素后,患者尿白蛋白明显减少,提示肝素针对糖尿病肾病的滤过膜有类似改善电荷屏障损害的现象[30]。
5 小 结
从实验动物斑泥螈研究中提出的肾小球流动电位模型,完善了肾脏滤过膜电荷屏障的理论,其产生机制同样适用于人类,这对于正确理解肾小球滤过膜在生理情况下是如何阻止血浆蛋白进入滤过膜及避免滤过膜堵塞的,以及在病理情况下的蛋白尿的发生、发展方面具有重要作用。肾小球疾病发病率逐年上升,已成为严重危害人们健康的世界卫生问题,该病在临床上涉及多个学科,如肾内科、内分泌科(如糖尿病肾病)、心内科(如高血压肾病)等。肾脏滤过膜电荷屏障新理论的提出,或能为肾小球疾病的早期诊断、有效治疗等提供新的靶点及研究方向。
[1] Collins AJ,Foley RN,Herzog C,etal.US Renal Data System 2012 Annual Data Report[J].Am J Kidney Dis,2013,61(1 Suppl 1):A7,e1-e476.
[2] Zhang L,Wang H.Chronic kidney disease epidemic:cost and health care implications in China[J].Semin Nephrol,2009,29(5):483-486.
[3] Satchell SC,Braet F.Glomerular endothelial cell fenestrations:an integral component of the glomerular filtration barrier[J].Am J Physiol Renal Physiol,2009,296(5):F947-F956.
[4] Rodewald R,Karnovsky MJ.Porous substructure of the glomerular slit diaphragm in the rat and mouse[J].J Cell Biol,1974,60(2):423-433.
[5] Bohrer MP,Baylis C,Humes HD,etal.Permselectivity of the glomerular capillary wall.Facilitated filtration of circulating polycations[J].J Clin Invest,1978,61(1):72-78.
[6] Hausmann R,Kuppe C,Egger H,etal.Electrical forces determine glomerular permeability[J].J Am Soc Nephrol,2010,21(12):2053-2058.
[7] Delgado AV,González-Caballero F,Hunter RJ,etal.Measurement and interpretation of electrokinetic phenomena[J].J Colloid Interface Sci,2007,309(2):194-224.
[8] Haraldsson B,Nyström J,Deen WM.Properties of the glomerular barrier and mechanisms of proteinuria[J].Physiol Rev,2008,88(2):451-487.
[9] Jarad G,Miner JH.Update on the glomerular filtration barrier[J].Curr Opin Nephrol Hypertens,2009,18(3):226-232.
[10] Moeller MJ.Streaming potentials as novel driving force for capillary permeability[J].Biophys J,2013,104(7):1395-1396.
[13] Akilesh S,Huber TB,Wu H,etal.Podocytes use FcRn to clear IgG from the glomerular basement membrane[J].Proc Natl Acad Sci U S A,2008,105(3):967-972.
[14] Hjalmarsson C,Johansson BR,Haraldsson B.Electron microscopic evaluation of the endothelial surface layer of glomerular capillaries[J].Microvasc Research,2004,67(1):9-17.
[15] Menzel S,Moeller MJ.Role of the podocyte in proteinuria[J].Pediatr Nephrol,2011,26(10):1775-1780.
[16] Deen WM,Lazzara MJ,Myers BD.Structural determinants of glomerular permeability[J].Am J Physiol Renal Physiol,2001,281(4):F579-F596.
[17] Ciarimboli G,Schurek HJ,Zeh M,etal.Role of albumin and glomerular capillary wall charge distribution on glomerular permselectivity:studies on the perfused-fixed rat kidney model[J].Pflugers Arch,1999,438(6):883-891.
[18] Rennke HG,Cotran RS,Venkatachalam MA.Role of molecular charge in glomerular permeability.Tracer studies with cationized ferritins[J].J Cell Biol,1975,67(3):638-646.
[19] Jeansson M,Haraldsson B.Morphological and functional evidence for an important role of the endothelial cell glycocalyx in the glomerular barrier[J].Am J Physiol Renal Physiol,2006,290(1):F111-F116.
[20] Singh A,Satchell SC,Neal CR,etal.Glomerular endothelial glycocalyx constitutes a barrier to protein permeability[J].J Am Soci Nephrol,2007,18(11):2885-2893.
[21] Miner JH.Developmental biology of glomerular basement membrane components[J].Curr Opin Nephrol Hypertens,1998,7(1):13-19.
[22] Jeansson M,Haraldsson B.Glomerular size and charge selectivity in the mouse after exposure to glucosaminoglycan-degrading enzymes[J].J Am Soc Nephrol,2003,14(7):1756-1765.
[23] van den Hoven MJ,Rops AL,Bakker MA,etal.Increased expression of heparanase in overt diabetic nephropathy[J].Kidney Int,2006,70(12):2100-2108.
[24] Koop K,Eikmans M,Baelde HJ,etal.Expression of podocyte-associated molecules in acquired human kidney diseases[J].J Am Soc Nephrol,2003,14(8):2063-2071.
[25] Steffes MW,Schmidt D,Mccrery R,etal.Glomerular cell number in normal subjects and in type 1 diabetic patients[J].Kidney Int,2001,59(6):2104-2113.
[26] White KE,Bilous RW,Marshall SM,etal.Podocyte number in normotensive type 1 diabetic patients with albuminuria[J].Diabetes,2002,51(10):3083-3089.
[27] Meyer TW,Bennett PH,Nelson RG.Podocyte number predicts long-term urinary albumin excretion in Pima Indians with type II diabetes and microalbuminuria[J].Diabetologia,1999,42(11):1341-1344.
[28] Rops AL,van den Hoven MJ,Bakker MA,etal.Expression of glomerular heparan sulphate domains in murine and human lupus nephritis[J].Nephrol Dial Transplant,2007,22(7):1891-1902.
[29] Guasch A,Deen WM,Myers BD.Charge selectivity of the glomerular filtration barrier in healthy and nephrotic humans[J].J Clin Invest,1993,92(5):2274-2282.
[30] Benck U,Haeckel S,Clorius JH,etal.Proteinuria-lowering effect of heparin therapy in diabetic nephropathy without affecting the renin-angiotensin-aldosterone system[J].Clin J Am Soc Nephrol,2007,2(1):58-67.

