日本蟳高血糖激素基因的克隆与表达分析
汤 洁, 朱冬发, 崔晓雨, 谢 熙, 邱锡尔
(宁波大学 海洋学院, 浙江 宁波 315211)
高血糖激素(crustacean hyperglycemic hormone, CHH)是由X器官-窦腺复合体(X-organ-sinus gland complex, XO-SG)合成分泌的一种肽类激素[1-3]。在甲壳动物中,CHH调节血糖水平,参与蜕皮、繁殖等生理过程[2, 4, 5]。XO-SG是甲壳动物内分泌的调控中心,其合成分泌的肽类激素统称为CHH家族神经肽,根据基因结构不同,可分为I型神经肽和II型神经肽[6]。I型神经肽仅有CHH,II型神经肽有蜕皮抑制激素(MIH)、大颚器官抑制激素(MOIH)和性腺抑制激素(GIH)[1-3]。区别在于:CHH的信号肽与成熟肽之间存在着一段特有的CHH前体相关肽(CHH precursor-related peptid, CPRP),而MIH、MOIH和GIH的信号肽直接与成熟肽相连[7]。近来,CHH在甲壳动物生长、发育、繁殖中的调控作用越来越受到重视[7-9]。
目前,已从多种甲壳动物中克隆获得了CHH全长cDNA序列[10,11]。对CHH的组织差异性表达研究发现,除了眼柄,CHH还在甲壳动物的其它组织中广泛表达[10]。但是,不同物种间的CHH组织表达情况存在差异。例如:榄绿青蟹(Scyllaolivacea)的CHH在脑中有表达,在肝胰腺、心脏、肌肉和鳃中不表达[12];拟穴青蟹(S.paramamosain)的CHH在肝胰腺、心脏和肠中表达量较高,在鳃和胃中的表达量较低[13];日本沼虾(Macrobrachiumnipponens)的CHH在精巢中表达量较高,在肝胰腺和心脏中的表达量较低[14]。
随着海洋经济的快速发展,日本蟳(Charybdisjaponica)已成为中国重要的海产经济蟹类之一。本研究以日本蟳为实验材料,运用RACE技术首次克隆得到日本蟳CHH基因(CjCHH)的全长cDNA 序列;通过实时荧光定量PCR(qRT-PCR)分析CjCHH的组织差异性表达情况;并且利用原核表达技术构建了CjCHH的重组表达质粒pET-CHH。本研究结果为进一步阐明CHH的生理功能,丰富和完善甲壳动物内分泌的调控理论提供了基础材料。
1 材料与方法
1.1 实验材料
日本蟳购自宁波镇海水产品市场。解剖,取其眼柄、脑、胸神经节、Y-器、精巢、卵巢、心脏、肝胰腺、肌肉、鳃10种组织快速冷冻于液氮中,放于-80 ℃冰箱保存备用。
Trizol、UNIQ-10柱式PAGE胶DNA回收试剂盒、质粒DNA提取试剂盒、IPTG购自Sangon公司;SMARTerTMRACE cDNA Amplification Kit 购自Clontech公司;PrimeScript® RT reagent Kit (Perfect Real Time)、SYBR® PremixExTaqTM II、pMD18-T载体、EscherichiacoliDH5α、E.coliBL21(DE3)、pET-28α质粒、NdeI和Hind III限制性内切酶、T4 DNA 连接酶及其它试剂均购自Takara公司。引物合成及测序均由Sangon公司完成。
1.2 CjCHH全长cDNA序列克隆
1.2.1 RNA的提取和cDNA的制备
解剖获得日本蟳眼柄组织,采用Trizol方法提取眼柄总RNA,并且通过电泳及紫外分光光度计对其进行检测。
用于3′ RACE的cDNA以AP(表1)为接头引物,用PrimeScript® RT reagent Kit (Perfect Real Time)反转录得到第一链cDNA;用于5′ RACE的cDNA按照SMARTerTMRACE cDNA Amplification Kit说明书合成。所有cDNA放于-20 ℃冰箱保存备用。
1.2.2 3′ RACE和5′ RACE
根据已经公布的CHH氨基酸序列,设计引物CHH3-F和CHH3-R(表1)。以3′RACE-cDNA为模板,CHH3-F和CHH3-R为上下游引物进行PCR。
根据3′ RACE测序结果,设计下游特异性引物GSP1和GSP2(表1)用于5′ RACE,以SMARTerTMRACE cDNA Amplification Kit提供的5′ outer和5′ inner(表1)为上游引物,按说明进行两轮PCR。
1.2.3 PCR产物的克隆与测序
PCR产物经琼脂糖电泳后,用琼脂糖凝胶DNA回收试剂盒回收纯化,连入pMD18-T载体,转化至E.coliDH5α感受态细胞,所获得的阳性克隆由Sangon公司完成测序。
1.3 序列分析
测序结果用Vector NTI 7进行拼接,获得CjCHH全长cDNA序列;BLAST程序分析CjCHHcDNA和氨基酸序列;ORF Finder确定开放阅读框(ORF)。ProtParam tool 预测氨基酸物理参数;SignalP 4.1 Server 预测信号肽;SMART程序分析氨基酸结构。ClustalX进行多序列比对;MEGA 4.1构建系统进化树。
1.4 组织表达分析
提取日本蟳各组织RNA,反转录合成cDNA。根据CjCHH和日本蟳β-actin(JN033202)[15]序列分别设计特异性引物CHH-ZF、CHH-ZR和内参引物actin-F、actin-R(表1),运用qRT-PCR检测不同组织中CjCHH的相对表达量;SPSS 17.0进行统计分析,P<0.05 表示差异显著。
1.5 原核表达分析
1.5.1 原核表达载体的构建
以反转录得到的cDNA为模板,用含NdeI和Hind III酶切位点的引物CHH-F-NdeI和CHH-R-Hind III(表 1)进行PCR。扩增产物与pMD18-T载体连接后转化至感受态E.coliDH5α进行培养。提取含CHH的pMD18-T载体进行NdeI和Hind III双酶切,酶切产物通过T4连接酶与经同样内切酶双酶切的pET-28α质粒连接,构建重组质粒pET-CHH。将其转化至E.coliDH5α进行培养,通过PCR验证获得阳性菌落。
1.5.2 pET-CHH蛋白的诱导表达
提取重组质粒pET-CHH,转化至E.coliBL21(DE3)感受态细胞,在含有卡那霉素的LB固体培养基中培养,菌液PCR筛选含有重组质粒pET-CHH的菌落。将筛选的菌落接种于含卡那霉素LB液体培养基,37oC震荡培养12 h。菌液经终浓度为1 mM的IPTG诱导,以诱导前样品为对照组,每隔1 h取出1组实验组,共5组。诱导结束后进行SDS-PAGE电泳分析,考马斯亮蓝G-250染色检测蛋白表达情况。

表1 引物序列
2 结果
2.1 CjCHH全长cDNA序列
将测序结果进行拼接,获得总长为1754 bp的CjCHH全长cDNA序列(图1),该序列已在GenBank登陆,登录号为FJ768717。CjCHH全长cDNA序列包含5′UTR(111 bp)、ORF(423 bp,编码140个氨基酸)和3′UTR(1236 bp),3′UTR cDNA片段含加尾信号AATAAA和Poly (A)。采用ProtParam软件预测CjCHH分子式为C678H1085N195O203S13,理论等电点为8.16。利用SignalP软件对编码区进行分析,发现CjCHH存在信号肽,长度为26个氨基酸残基,成熟肽长度为75个氨基酸残基,具有6个保守的半胱氨酸残基(Cys7,Cys23,Cys26,Cys39,Cys43和Cys52)。信号肽和成熟肽之间存在由37个氨基酸残基组成的CPRP和一个保守的位点KR。
2.2 序列比对和系统进化树分析
将推测的CjCHH氨基酸成熟肽序列与已公布的其它甲壳动物CHH进行BLAST检索分析,发现一致性为41%~88%。与凡纳滨对虾(Litopenaeusvannamei)一致性最低,为47%;与远海梭子蟹(Portunuspelagicus)一致性最高,为88%。与蓝蟹(Callinectessapidus)一致性为87%,拟穴青蟹一致性为84%,榄绿青蟹一致性为81%,克氏原螯虾(Procambarusclarkii)一致性为62%。进一步使用ClustalX软件,将CjCHH的氨基酸序列与拟穴青蟹(SpCHH,AFD28273.1)、榄绿青蟹(SoCHH,AQ75760.1)和远海梭子蟹(PpCHH,AFM29133.1)的CHH进行多序列比较。结果显示它们的氨基酸结构都包括信号肽、CPRP和成熟肽,其中成熟肽含有6个保守的Cys残基,可形成3个二硫键(图2)。

图1 CjCHH全长cDNA序列及编码氨基酸序列
单下划线表示CPRP和加尾信号;双下划线表示半胱氨酸残基所在位点(Cys);阴影部分表示信号肽;方框表示切割位点KR;*表示终止子。

图2 多种CHH的氨基酸序列比对
阴影部分表明相同的氨基酸序列,阴影颜色的深浅分别表示相似程度的高低;*表示6个保守的半胱氨酸。
利用MEGA 4.1软件,将CjCHH与其它甲壳动物CHH的成熟肽序列通过邻接法(Neighbor-Joining)构建系统进化树。结果显示,蟹类CHH聚为一类,虾类CHH聚为一类,蟹类MIH聚为一类,CjCHH与其它梭子蟹科CHH聚在一起(图3)。
2.3 组织差异性表达分析
qRT-PCR结果显示,CjCHH在所检测的10个组织中均有表达(图4)。其中,在眼柄中表达量最高,肠和Y-器次之,其余组织表达量较低。
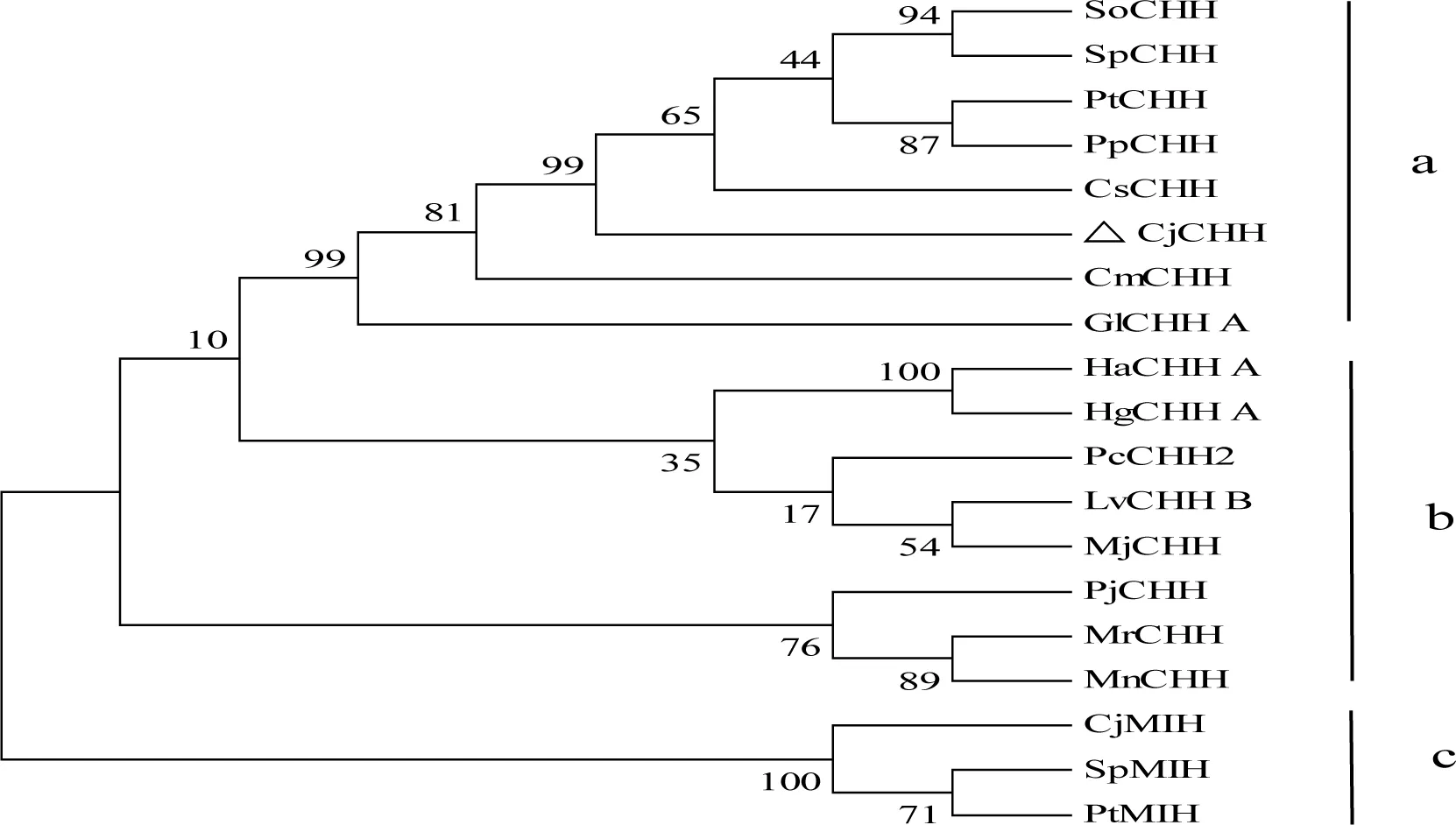
图3 系统进化树
ScyllaolivaceaCHH (SoCHH, AQ75760.1),ScyllaparamamosainCHH (SpCHH, AFD28273.1),PortunustrituberculatusCHH (PtCHH, ACB46189.1),PortunuspelagicusCHH (PpCHH, AFM29133.1),CallinectessapidusCHH (CsCHH, AAS45136.1),CharybdisjaponicaCHH (CjCHH, ACN87216.1),Carcinusmaenas(CmCHH, P14944.2),GecarcinuslateralisCHH A(GlCHH, ABF48652.1),HomarusamericanusCHH A (HaCHA , AAB32871.1),HomarusgammarusCHH A(HgCHH A, ABA42179.1 ),ProcambarusclarkiiCHH2 (PcCHH2, AFV95077.1),LitopenaeusvannameiCHH B(LvCHH B, AAN86055.1),MarsupenaeusjaponicusCHH (MjCHH, BAE78493.1 ),PandalopsisjaponicaCHH (PjCHH, AFG16933.1),MacrobrachiumrosenbergiiCHH (MrCHH, AAL40916.1),Macrobrachiumnipponense CHH (MnCHH, AEJ54624.1),CharybdisjaponicaMIH (CjMIH, ACD11361.1),ScyllaparamamosainMIH (SpMIH, AFM35653.1),PortunustrituberculatusMIH (PtMIH, ABZ04547.1).
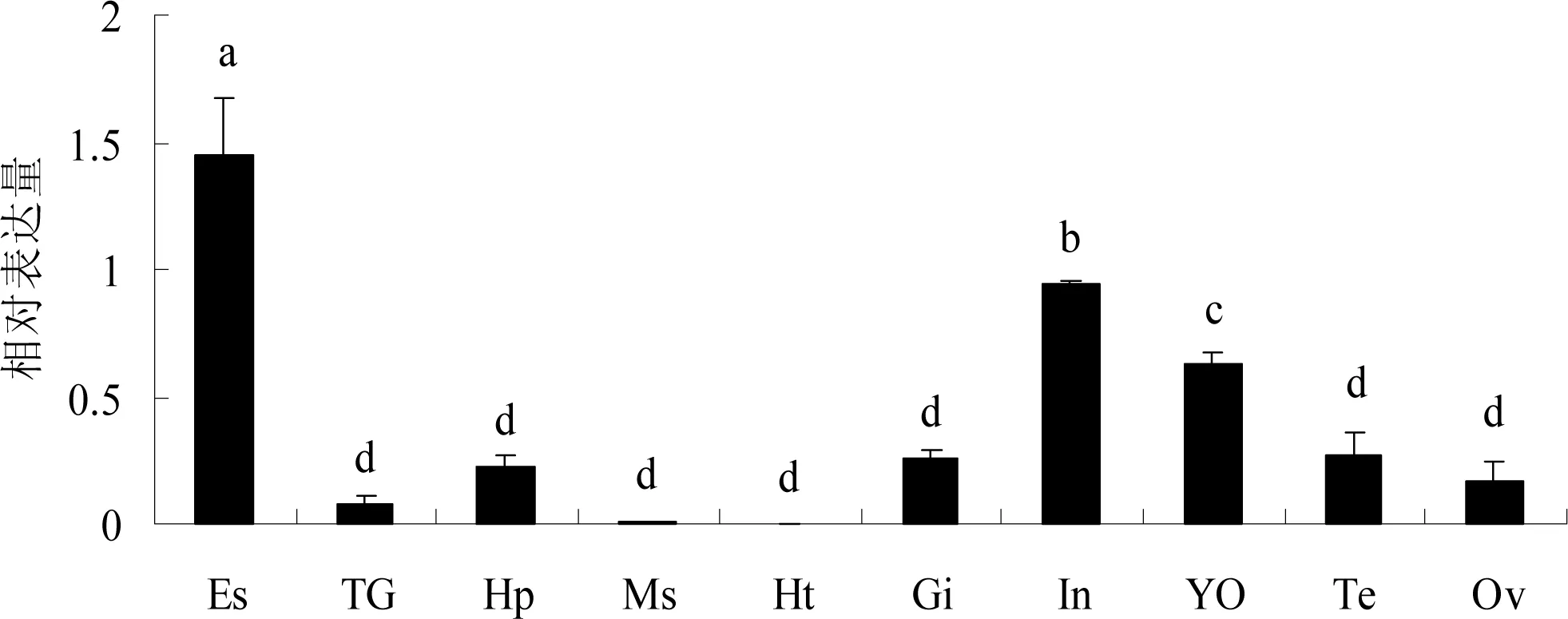
图4 CjCHH的组织差异性表达
Es—眼柄; TG—胸神经节; Hp—肝胰腺; Ms—肌肉; Ht—心脏; Gi—鳃; In—肠; YO—Y-器; Te—精巢; Ov—卵巢; 不同字母表示差异显著(P< 0.05)。
2.4 原核表达分析
含有pET-CHH重组质粒的菌液经IPTG诱导后用SDS-PAGE电泳检测分析。结果显示,未经IPTG诱导的对照组菌液没有表达CHH重组蛋白,经IPTG诱导的菌液表达了CHH重组蛋白,且在相对分子质量约为11 kDa处出现了以包涵体形式表达的融合蛋白条带(图5),与预测的相对分子质量大小相一致。在实验组中,诱导1 h(图5-2)的CHH重组蛋白表达量最少,诱导5 h (图5-6)的表达量最大,表达量随诱导时间的增加而增大。

图5 重组蛋白SDS-PAGE图谱
1—IPTG诱导前; 2—IPTG诱导1 h; 3—IPTG诱导2 h; 4—IPTG诱导3 h; 5—IPTG诱导4 h; 6—IPTG诱导5 h; M—蛋白标记。
3 讨论
CHH是一种多效型的神经肽,参与十足目甲壳动物多种生理过程的调控[10,16]。在甲壳动物中,已从美洲螯龙虾(Homarusamericanus)[17]、斑节对虾(Penaeusmonodon)[18]、中华绒螯蟹(Eriocheirsinensis)[19]、日本沼虾[14]和红眼雪蟹(Chionoecetesbairdi)[20]、可口美青蟹(Callinectessapidus)[21]、凡纳滨对虾[22]等物种中获得全长cDNA编码的CHH。研究表明,CHH成熟肽中的6个保守的Cys残基可形成3个链内二硫键[23],且在第一个Cys残基后面第5位上没有CHH 家族II型肽中所特有的Gly残基[14]。本研究采用 RACE技术,获得了CjCHH全长cDNA序列(图1)。经序列比对分析,CjCHH与已知的其它甲壳类CHH同源,具有相似结构特征,均由信号肽、CPRP和成熟肽组成,在CPRP与成熟肽之间存在保守位点KR(图2)。系统进化树结果显示,虾蟹类CHH分别聚为一支,这与甲壳动物分类相符[24];蟹类CHH与MIH分别聚为一支,距离较远,这符合CHH家族基因的分类[2];本文所研究的CjCHH与它梭子蟹科物种CHH聚到一起,这与日本蟳所处的分类地位一致(图3)。
组织差异性表达结果显示,CjCHH在检测的10个组织中均有表达(图4)。在眼柄中CjCHH的表达量最高,这与日本沼虾[14]、可口美青蟹[21]的CHH组织表达结果一致,但在凡纳滨对虾中,CHH在心脏中表达量最高[22],这可能由物种间差异导致也可能受其它因素的影响,具体原因尚待进一步探明。CjCHH在Y-器与肠中表达量较高,可能与CHH的多种生理功能相关。Zarubin等[24]研究发现,Y-器细胞膜中存在受体鸟甘酸环化酶,CHH通过与其结合,从而影响Y-器分泌蜕皮激素;在可口美青蟹的蜕皮前期,XO-SG复合体中CHH含量显著升高[21]。在日本沼虾中,CHH在精巢中的表达量是其在卵巢中表达量的250倍[14],本研究中的CjCHH在精巢中的表达量略高于卵巢。这表明,甲壳动物的蜕皮调控除了受MIH与蜕皮激素的[21]相互拮抗调控外,CHH的协同调控作用同样不能忽视;CHH可能与甲壳动物雄性发育密切相关。
由于CHH天然蛋白存在量少,为了获得活体蛋白用于进一步的实验研究,通过原核表达等技术获得CHH活性蛋白是CHH功能研究的必须环节。近年来,通过原核表达技术已获得多种甲壳动物的CHH重组蛋白。如日本囊对虾(Marsupenaeusjaponicus)[25]、凡纳滨对虾[26]、橄绿青蟹[27]、罗氏沼虾(Macrobrachiumrosenbergii)[28]等。本研究成功构建了pET-CHH重组质粒,可以在IPTG的诱导下大量表达CHH重组蛋白(图5),为CjCHH的功能研究打下了深厚基础。
参考文献:
[1]Santos E A, Keller R. Crustacean hyperglycemic hormone (CHH) and the regulation of carbohydrate metabolism: current perspectives[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1993, 106(3): 405-411.
[2]Keller R. Crustacean neuropeptides: structures, functions and comparative aspects[J]. Experientia, 1992, 48(5): 439-448.
[3]De KIeijn D, Van Herp F. Molecular biology of neurohomone precursors in the eyestalk of Crustacea[J]. Comp Biochem Physiol, 1995, 112(2): 573-579.
[4]蔡生力. 甲壳动物内分泌学研究与展望[J]. 水产学报, 1998, 22(2): 154-161.
[5]杨济芬, 朱冬发, 沈建明, 等. 甲壳动物高血糖激素家族生理功能研究进展[J]. 动物学杂志, 2009, 44(1): 151-158.
[6]Garcia U, Aréchiga H. Regulation of crustacean neurosecretory cell activity[J]. Cellular and Molecular Neurobiology, 1998, 18(1): 81-99.
[7]Mettulio R, Giulianini P G, Ferrero E A, et al. Functional analysis of crustacean hyperglycemic hormone by in vivo assay with wild-type and mutant recombinant proteins[J]. Regulatory Peptides, 2004, 119(3): 189-197.
[8]Lacombe C, Greve P, Martin G. Overview on the sub-grouping of the crustacean hyperglycemic hormone family[J]. Neuropeptides, 1999, 33(1): 71-80.
[9]Okumura T, Ohira T, Katayama H, et al. In vivo effects of a recombinant molt-inhibiting hormone on molt interval and hemolymph ecdysteroid level in the kuruma prawn,Marsupenaeusjaponicus[J]. Zoological Science, 2005, 22(3): 317-320.
[10]Fanjul-Moles M L. Biochemical and functional aspects of crustacean hyperglycemic hormone in decapod crustaceans: review and update[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2006, 142(3): 390-400.
[11]Montagn N, Desdevises Y, Soyez D, et al. Molecular evolution of the crustacean hyperglycemic hormone family in ecdysozoans[J]. BMC Evolutionary Biology, 2010, 10(1): 62.
[12]Tsai K W, Chang S J, Wu H J, et al. Molecular cloning and differential expression pattern of two structural variants of the crustacean hyperglycemic hormone family from the mud crabScyllaolivacea[J]. General and Comparative Endocrinology, 2008, 159(1): 16-25.
[13]舒妙安, 张龙韬, 周宇芳, 等. 拟穴青蟹 (Scyllaparamamosain) 两种Ⅰ型高血糖激素基因全长 cDNA 的克隆及组织表达分析[J]. 海洋与湖沼, 2012, 4(43):965-701.
[14]金舒博, 王 宁, 乔 慧, 等. 青虾高血糖激素基因全长 cDNA 序列的克隆及表达分析[J]. 中国水产科学, 2013 (1): 82-92.
[15]Mao H, Tan F Q, Wang D H, et al. Expression and function analysis of metallothionein in the testis of stone crabCharybdisjaponicaexposed to cadmium[J]. Aquatic Toxicology, 2012, 15(124/125): 11-21.
[16]Chang E S, Keller R, Chang S A. Quantification of crustacean hyperglycemic hormone by ELISA in hemolymph of the lobster,homarusamericanus, following various stresses[J]. General and Comparative Endocrinology, 1998, 111(3): 359-366.
[17]de Kleijn D P V, de Leeuw E P H, van den Berg Marco C, et al. Cloning and expression of two mRNAs encoding structurally different crustacean hyperglycemic hormone precursors in the lobsterHomarusamericanus[J]. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 1995, 1260(1): 62-66.
[18]Wiwegweaw A, Udomkit A, Panyim S. Molecular structure and organization of crustacean hyperglycemic hormone genes ofPenaeusmonodon[J]. Journal of Biochemistry and Molecular Biology, 2004, 37(2): 177-184.
[19]王艳华, 张亦陈, 孙 妍, 等. 中华绒螯蟹高血糖激素基因的克隆和分子结构解析[J]. 水产学报, 2013, 7(37):987-993.
[20]Chung J S, Bembe S, Tamone S, et al. Molecular cloning of the crustacean hyperglycemic hormone (CHH) precursor from the X-organ and the identification of the neuropeptide from sinus gland of the Alaskan Tanner crab,Chionoecetesbairdi[J]. General and Comparative Endocrinology, 2009, 162(2): 129-133.
[21]Zheng J, Chen H Y, Choi C Y, et al. Molecular cloning of a putative crustacean hyperglycemic hormone (CHH) isoform from extra-eyestalk tissue of the blue crab (Callinectessapidus), and determination of temporal and spatial patterns of CHH gene expression[J]. General and Comparative Endocrinology, 2010, 169(2): 174-181.
[22]Liu M, Pan L, Li L, et al. Molecular cloning, characterization and recombinant expression of crustacean hyperglycemic hormone in white shrimpLitopenaeusvannamei[J]. Peptides, 2013, doi: 10.1016/j.peptides.2013.07.030.
[23]王在照,相建海. 甲壳动物CHH家族神经激素结构和功能研究进展[J].水产学报, 2001, 25(2): 175-180.
[24]Montagné N, Desdevises Y, Soyez D, et al. Molecular evolution of the crustacean hyperglycemic hormone family in ecdysozoans[J]. BMC Evolutionary Biology, 2010, doi: 10.1186/1471-2148-10-62.
[25]Nagai C, Asazuma H, Nagata S, et al. A convenient method for preparation of biologically active recombinant CHH of the kuruma prawn,Marsupenaeusjaponicus, using the bacterial expression system[J]. Peptides, 2009, 30(3): 507-517.
[26]Wanlem S, Supamattaya K, Tantikitti C, et al. Expression and applications of recombinant crustacean hyperglycemic hormone from eyestalks of white shrimp (Litopenaeusvannamei) against bacterial infection[J]. Fish & Shellfish Immunology, 2011, 30(3): 877-885.
[27]Chang C C, Tsai K W, Hsiao N W, et al. Structural and functional comparisons and production of recombinant crustacean hyperglycemic hormone (CHH) and CHH-like peptides from the mud crabScyllaolivacea[J]. General and Comparative Endocrinology, 2010, 167(1): 68-76.
[28]Ohira T, Tsutsui N, Nagasawa H, et al. Preparation of two recombinant crustacean hyperglycemic hormones from the giant freshwater prawn,Macrobrachiumrosenbergii, and their hyperglycemic activities[J]. Zoological Science, 2006, 23(4): 383-391.

