禽类MHCⅡ类分子β链信号肽保守性分析
宗文明,叶 红
(1.安徽农业大学,安徽 合肥 230036;2.安徽省医学科学研究院,安徽 合肥 230061)
禽类MHCⅡ类分子β链信号肽保守性分析
宗文明1,叶 红2
(1.安徽农业大学,安徽 合肥 230036;2.安徽省医学科学研究院,安徽 合肥 230061)
Ⅱ类主要组织相容性复合物(major histocompatibility complex,MHC)的β链显示极为丰富的多态性.为了分析禽类MHCⅡ类分子β链信号肽是否呈现出多态性的分子生物学特征,利用NCBI网站查找到原鸡等五种禽类编码MHCⅡ类分子β链的mRNA,再用DNAStar软件转译成氨基酸序列,然后用信号肽在线预测软件SignalP 3.0 Server进行分析,得出信号肽的概率、信号肽的长度以及信号肽酶的酶切位点,发现这五种禽类MHCⅡ类分子β链信号肽的分子生物学特征有许多相似性,利用Mega4.1软件进行信号肽氨基酸序列比对分析,揭示出禽类MHCⅡ类分子β链信号肽具有高度的保守性.
禽类;MHC;信号肽;保守性
为什么有些蛋白质(如线粒体、叶绿体等的蛋白质)在细胞质基质中合成,而有些(如分泌性蛋白质、膜蛋白等)在粗面内质网上合成,是什么指令确定蛋白质在细胞内的合成部位以致最终影响蛋白质的定向转位呢?1975年,G.Blobel和D.Sabatini在实验的基础上提出了信号肽假说,即蛋白质N端存在一段信号肽,指导蛋白质迁移到内质网上合成,蛋白质合成结束前信号肽被信号肽酶切除[1].
随着生物信息学技术的迅速发展,对蛋白的结构和功能进行预测分析已成为生物信息学的重要组成部分,同时也为进一步实验研究提供相应的理论依据,使实验数据更具目的性及有效性.信号肽对于控制蛋白质的分泌路径和指导蛋白质定位特定位置有着重要作用,全面系统地研究信号肽不仅有助于认识、分析和解释各种生理和病理现象,而且在寻求基因诊疗的新药领域信号肽已经成为一个关键工具[2].MHCⅡ类分子是由α链和β链组成的异二聚体,属膜蛋白,其中β链显示极为丰富的多态性.本文利用NCBI网站查找到原鸡等五种禽类的编码MHCⅡ类分子β链蛋白的mRNA序列,运用信号肽在线预测软件SignalP 3.0和DNAStar进行分析,探讨禽类MHCⅡ类分子β链信号肽序列的分子生物学特征,以发现它们是否呈现出多态性.
1 材料
1.1 mRNA序列
来源于NCBI(National Center for Biotechnology Information)数据库,网址为http://www.ncbi.nlm.nih.gov/.
1.2 序列编辑软件
DNAStar,网址为 http://www.torrents.net/.
1.3 信号肽预测网站
SignalP3.0,网址为http://www.cbs.dtu.dk/services/.
1.4 序列比对软件
Mega4.1.
2 方法
2.1 查找序列
利用NCBI网站的数据库,查找得到具有完整CDS(Coding sequence,编码序列)的编码五种禽类即原鸡,绿头鸭,鸿雁,鹌鹑,雉鸡五种禽类编码MHCⅡ类分子β链的mRNA序列.
2.2 查找开放阅读框
利用DNAStar的EditSep对五条序列进行分析,查找相应的开放阅读框(Open Reading Frame,ORF)(表1),并将核苷酸序列翻译为氨基酸序列.
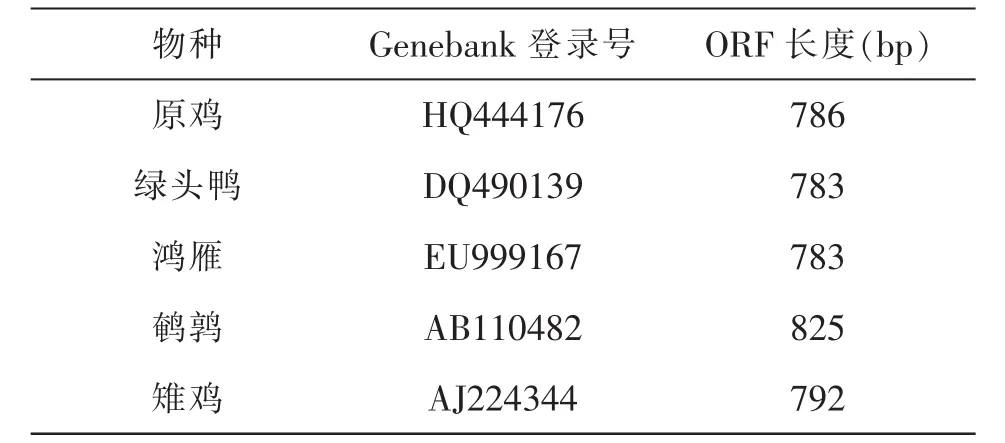
表1 五种禽类β链Genebank登录号及ORF长度
2.3 分析氨基酸序列
使用SignalP 3.0 Server分析ORF的N端氨基酸序列,根据从SignalP中分析获取的Cmax值 (the cleavage site score)、Smean 值(the signal peptide score)和 HMM 值(hidden Markov model)判定是否存在信号肽,并测出信号肽酶切位点,从而确定信号肽序列存在区段;
2.4 分析信号肽序列的保守性
五条禽类MHCⅡ类分子β链信号肽氨基酸序列用Mega软件进行比对,分析氨基酸的保守位点.
3 结果与分析
3.1 五种禽类MHCⅡ类分子β链信号肽分析
SignalP 3.0 Server是基于神经网络 (Neural Networks,NN)和隐马可夫模型(Hidden Markov,HMM)两种算法预测原核生物和真核生物蛋白质信号肽的软件.前者预测值表示为Smean,后者预测值表示为Sprob[3].运用信号肽分析软件SignalP 3.0分析原鸡(Gallus gallus)MHCⅡ类分子β链的信号肽存在情况(图1),SignalP-HMM的结果表明,该编码序列含有信号肽的概率为99.9%;SignalP-NN的结果表明,该编码序列含有能被信号肽酶切除的信号肽,酶切位点在第26,27位氨基酸之间,N端前26个氨基酸为信号肽区,进一步用DNAStar的EditSep分析信号肽的氨基酸序列,结果表明26个氨基酸中,有17个非极性氨基酸,占65.38%;6个极性氨基酸,占23.08%;3个带正电荷的碱性氨基酸,占13.04%.
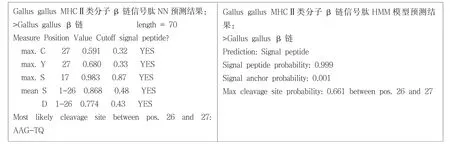
图1 原鸡MHCⅡβ链的信号肽分析
运用信号肽分析软件SignalP 3.0分析绿头鸭(Anas platyrhynchos)MHCⅡ类分子β链信号肽存在情况 (图2).SignalP-HMM结果表明,该编码序列含有信号肽的概率为99.2%,SignalP-NN的结果表明,该编码序列含有能被信号肽酶切除的信号肽,酶切位点在第26,27位氨基酸之间,N端前26个氨基酸为信号肽区,进一步用DNAStar的EditSep分析信号肽的氨基酸序列,结果表明26个氨基酸中,有16个非极性氨基酸,占61.54%;8个极性氨基酸,占30.77%;2个带正电荷的碱性氨基酸,占7.69%.

图2 绿头鸭MHCⅡβ链的信号肽分析
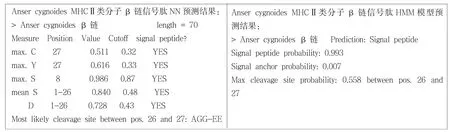
图3 鸿雁MHCⅡβ链的信号肽分析
运用信号肽分析软件SignalP 3.0分析鸿雁(Anser cygnoides)MHCⅡ类分子β链信号肽存在情况 (图3).SignalP-HMM结果表明,该编码序列含有信号肽的概率为99.3%,SignalP-NN的结果表明,该编码序列含有能被信号肽酶切除的信号肽,酶切位点在第26,27位氨基酸之间,N端前26个氨基酸为信号肽区,进一步用DNAStar的EditSep分析信号肽的氨基酸序列,结果表明26个氨基酸中,有16个非极性氨基酸,占61.54%;8个极性氨基酸,占30.77%;2个带正电的碱性氨基酸,占7.69%.
运用信号肽分析软件SignalP 3.0分析鹌鹑(Coturnix japonica)MHCⅡ类分子β链的信号肽存在情况(图4).SignalP-HMM结果表明,该编码序列含有信号肽的概率为99.9%,SignalP-NN的结果表明,该编码序列含有能被信号肽酶切除的信号肽,酶切位点在第26,27位氨基酸之间,N端前26个氨基酸为信号肽区,进一步用DNAStar的EditSep分析信号肽的氨基酸序列,结果表明26个氨基酸中,有17个非极性氨基酸,占65.38%;7个极性氨基酸,占26.92%;2个带正电的碱性氨基酸,占7.69%.

图4 鹌鹑MHCⅡβ链的信号肽分析
运用信号肽分析软件SignalP 3.0分析雉鸡(Phasianus colchicus)MHCⅡ类分子β链的信号肽存在情况(图5).SignalP-HMM结果表明,该编码序列含有信号肽的概率为99.9%,SignalP-NN的结果表明,该编码序列含有能被信号肽酶切除的信号肽,酶切位点在第26,27位氨基酸之间,N端前26个氨基酸为信号肽区,进一步用DNAStar的EditSep分析信号肽的氨基酸序列,结果表明26个氨基酸中,有18个非极性氨基酸,占69.23%;6个极性氨基酸,占23.07%;2个带正电的碱性氨基酸,占7.69%.

图5 雉鸡MHCⅡβ链的信号肽分析
总结以上五条禽类MHCⅡ类分子β链信号肽生物信息学的分析结果(表2),表明五条禽类MHCⅡ类分子β链含有信号肽概率均在0.99以上,说明禽类MHCⅡ类分子β链N端均含有信号肽,且信号肽长度均为26个氨基酸,酶切位点在第26,27位氨基酸之间.因此,可以确定五条禽类MHCⅡ类分子β链的N端前26个氨基酸是信号肽区.五条链中从第8位到第21位的氨基酸全部都是疏水性氨基酸,说明从第8位到第21位的氨基酸是信号肽的疏水核心区,而且信号肽酶切位点处的氨基酸残基是亲水性氨基酸残基,具有ARG-X的模式(R为A或Y或G,X表示亲水性氨基酸残基).

表2 禽类MHCⅡ类分子β链信号肽生物信息学分析
3.2 禽类MHCⅡ类分子β链信号肽的保守性分析
五条禽类MHCⅡ类分子β链信号肽氨基酸序列用Mega软件进行比对,如图6.

图6 五条禽类MHCⅡ类分子β链信号肽的氨基酸序列比较保守性氨基酸残基用红色矩形框标出
结果表明,禽类MHCⅡ类分子β链信号肽的26个氨基酸中共有17个位点的氨基酸相同,占信号肽氨基酸总数的65.4%,保守的氨基酸分别是第一位的甲硫氨酸,第2、4位的甘氨酸,第5位的精氨酸,第9、11位的丙氨酸,第12位的缬氨酸,第13位的亮氨酸,第14位的缬氨酸,第15位的丙氨酸,第16、19位的亮氨酸,第20位的甘氨酸,第21位的甘氨酸,第22位的丙氨酸,第23位的精氨酸,第25位的丙氨酸,第27位的甘氨酸.禽类MHCⅡ类分子β链信号肽的26个氨基酸中有16~18个非极性氨基酸,6~8个极性氨基酸,2~3个带正电的碱性氨基酸,26个氨基酸中有17个位点的氨基酸相同,这说明五种禽类MHCⅡ类分子β链的信号肽具有高度的保守性.
4 讨论
信号肽位于蛋白质的N端,一般由16~26个氨基酸残基,其中包括疏水核心区、信号肽的C端和N端3部分.当信号肽序列合成后,被信号识别颗粒(SRP)所识别,蛋白质合成暂停或减缓,信号识别颗粒将核糖体携带至内质网上,蛋白质合成重新开始.在信号肽的引导下,新合成的蛋白质进入内质网腔,而信号肽序列则在信号肽酶的作用下被切除[4-6].
MHCⅡ类分子作为重要的免疫分子,主要作用是识别和提呈外源性抗原肽,进而激活T淋巴细胞,启动特异性免疫应答.MHCⅡ类分子的生物合成起源于内质网,初步加工后便离开内质网到达高尔基体,在高尔基体中继续进行蛋白质的修饰与加工,然后再进一步运输至早期/晚期溶酶体,在溶酶体内与外源性抗原肽结合,再通过膜泡运送到细胞表面[7,8],供T淋巴细胞识别.在MHCⅡ类分子的生物合成中信号肽对于控制蛋白质的分泌路径和指导蛋白质定位特定位置有重要意义.
运用信号肽分析软件SignalP3.0对五条禽类MHCⅡ类分子β链信号肽氨基酸序列进行分析可知,五条禽类MHCⅡ类分子β链均含有明确的信号肽,即前26个氨基酸是信号肽区,第8至21位是由中性氨基酸构成的疏水区,符合信号肽的特征.MHCⅡ分子具有丰富的多态性和多基因性,通过分析五条禽类MHCⅡ类分子β链的信号肽氨基酸序列可知MHCⅡ类分子β链的信号肽的26个氨基酸中有17个氨基酸位点是高度保守的,说明禽类MHCⅡ类分子β链的信号肽具有高度保守性,并且它们执行相似的功能,即指导MHCⅡ类分子β肽链从细胞质中迁移到内质网中继续合成.
信号肽的分析对利用标签蛋白研究目的蛋白在细胞中的表达和定位有重要意义,根据信号肽的存在与否才能确定报告基因与目的基因的上游还是下游融合,进而避免标签蛋白与目的蛋白N端的信号肽区同时被信号肽酶切除,使得融合基因的表达不仅很好地保留荧光蛋白的特性,而且同时也保证了目的蛋白在细胞中的定位功能[9].
〔1〕翟中和,王喜忠,丁明孝.细胞生物学(第 3 版)[M].北京:高等教育出版社,2007.200~215.
〔2〕刘惠,杨杰,陈军,等.基于全序列比对相似度预测信号肽[J].上海交通大学学报,2008(42):11~15.
〔3〕孙平楠,周小玲,王正祥.信号肽生物信息学分析在Neurospora crassa phyA基因鉴定中的应用[J].南方医科大学学报,2009(6):1098~1101.
〔4〕彭佳师,龚继明.信号肽与蛋白质的分选转运[J].植物生理学报,2011(47):9~17.
〔5〕谭晓林,刘朝奇,郑兰英.信号肽对酵母外源蛋白质分泌效率的影响[J].生物技术,2010(3):10~16.
〔6〕孙翰昌,庞敏,靳涛.斑马鱼成纤维细胞生长因子(FGFs)信号肽的预测分析[J].中国兽医杂志,2010(6):33~35.
〔7〕Neumann J,Koch N.Assembly of major histocompatibility complex classⅡsubunits with invariant chain[J].FEBS Letters,2005,579:6055~6059.
〔8〕Busch R,Cloutier I,Sekaly RP,et al.Invariant chain protects classⅡhistocompatibility antigens from binding intactpolypeptidesin the endoplasmic reticulum [J].EMBO J,1996,15:418~428.
〔9〕叶红.新城疫病毒F蛋白-Ii嵌合体与MHC分子结合特性的研究[D].安徽农业大学,2009.63.
S858
A
1673-260X(2012)08-0020-04
安徽省高校省级科研重点项目(KJ2012A104)

