大绒鼠解偶联蛋白1基因部分序列扩增与分析
朱万龙, 余婷婷, 章 迪, 孙淙南, 戈 帆, 王政昆
(云南师范大学 生命科学学院, 昆明 650500)
褐色脂肪组织(Brown adipose tissue, BAT)是进行非颤抖性产热的主要部位,主要存在于小型哺乳动物中,人和其他哺乳动物在婴儿期也会有少量存在[1]。然而最近的研究表明,成年人体内的确存在有功能活性的BAT,此研究结果颠覆了以往传统的观念,被美国《时代周刊》评为2009年度十大医学突破之一[2-4]。动物在冷环境下BAT主要通过增加组织重量、线粒体蛋白含量[5]和UCP1的含量来增加产热[6,7]。UCP1是位于褐色脂肪组织线粒体内膜上的一种解偶联蛋白,其功能诱导质子漏产热[8,9]。目前已从许多动物中成功分离出UCP1蛋白,其基因结构在鼠和人之间高度保守[10],约有90%以上的氨基酸残基相同[11]。
目前,关于UCP1基因的序列研究有很多[12-17],然而关于UCP1基因在野生小型哺乳动物中的研究还较少。本研究以横断山区固有类群大绒鼠(Eothenomysmiletus)为材料,运用RT-PCR技术从其BAT中提取UCP1 cDNA序列,并把该序列与其他物种进行了同源性比较,为进一步研究大绒鼠的UCP1基因和能量代谢提供基础资料。
1 材料和方法
1.1 实验材料
实验所用大绒鼠于2012年10月捕自云南省剑川县石龙村海拔2590 m的农田中(北纬26°15′~26°45′,东经99°40′~99°55′)。年平均气温9.1 ℃,年平均最低温度和最高温度分别为-4.0 ℃和24.1 ℃,季节干湿分明[18]。
1.2 RNA的提取和cDNA的合成
动物断颈处死后,迅速分离BAT。BAT总RNA的提取与纯化按照RNA-pure高纯总RNA快速抽提试剂盒(BioTeke Co.)提供方法进行。cDNA第一链的合成以BAT 总RNA为模板,oligo(dT)18为反转录引物,按照M-MLV Frist Strand Kit试剂盒(Invitrogen Co.)提供方法进行。
1.3 大绒鼠UCP1基因cDNA核心序列的扩增
根据人(登录号: NM0033-55.2)、小家鼠(NM 0116-71.4)等已知脊椎动物UCP1基因氨基酸序列保守区域设计1对简并引物:(UCP1F:CGGAATTCGAGCCAAGATGGTGAGT;UCP1R:CGGAATTCGTAGGTCCCAGTGTAGCG),用以上引物为模板进行RT-PCR扩增。UCP1基因cDNA核心序列扩增条件为:94 ℃预变性5 min,1 个循环;94 ℃变性1 min,53~58℃退火1 min,72 ℃延伸1.5 min,共32 个循环;72 ℃ 延伸10 min。UCP1基因cDNA核心序列的扩增体系(50 μL)为:1 μL DNA模板(10 ng/μL),5 μL 10×PCR Buffer,2 μL MgCl2(25 mmol/L),1 μL dNTP Mixture(10 mmol/L,pH值8.0),1 μL Primer 1 (10 pmol/μL),1 μL Primer 2(10 pmol/μL),0.5 μL Taq enzyme(4 U/μL,购自北京博迈德生物公司),38.5 μL dd H2O。RT-PCR产物以0.8%琼脂糖凝胶电泳检测,并送至昆明硕阳科技有限公司进行正反两个方向的序列测定。
1.4 统计处理
对于获取的UCP1 cDNA序列利用美国国家生物技术信息中心(http: //www.ncbi.nlm.nih.gov)网站的BLAST软件进行同源性比对。用ClustaX1.81软件进行UCP1氨基酸序列比对排列,采用MEGA5软件[12]中的ML法与GenBank数据库中已有的不同物种的UCP1 cDNA序列采用NJ方法构建系统进化树,系统树各分支的数值由1000次重复检验所得;用ORF软件(http: //www.ncbi.nlm.nih.gov/ gorf/)推导编码蛋白的氨基酸序列。
2 结果
2.1 大绒鼠BAT总RNA提取
用0.8%琼脂糖凝胶电泳检测大绒鼠BAT总RNA,电泳检测显示在250~2000 bp位置处有连续弥散状,可作为模板用于后面的试验。
2.2 UCP1 RT-PCR产物的测序及分析
经RT-PCR所得产物约为458 bp的大绒鼠UCP1 cDNA核心序列,包含的开放阅读框为456 bp,编码151个氨基酸(图1)。

图1 大绒鼠UCP1基因cDNA部分序列及其推导的氨基酸序列

哺乳动物登录号氨基酸同源性(%)黑线仓鼠 Cricetulus griseusXP_003511983.199橙腹草原田鼠 Microtus ochrogasterXP_005369607.199金黄仓鼠 Mesocricetus auratusNP_001268261.198褐家鼠 Rattus norvegicusNP_036814.194小家鼠Mus musculusNP_033489.194突尼斯非洲跳鼠 Jaculus jaculus XP_004655890.186豚鼠 Cavia porcellusXP_003476876.187树鼩 Tupaia chinensis ELW69185.183小马岛猬 Echinops telfairiNP_001268234.189蒙眼貂 Mustela putorius furo XP_004768520.186家猫 Felis catusXP_003985034.186大熊猫 Ailuropoda melanoleucaXP_002927036.185苏门答腊猩猩 Pongo abeliiXP_002815208.285食蟹猴 Macaca fascicularisEHH53985.184牛 Bos TaurusXP_005217590.185水牛Bubalus bubalisAFS30900.180野骆驼 Camelus ferus EPY74185.181
2.3 UCP1氨基酸序列的同源性分析
通过BLAST搜索,所得大绒鼠UCP1氨基酸序列与啮齿类、灵长类、食肉类和奇蹄类等的氨基酸序列同源性均在80%以上(表1),它们氨基酸序列比对的一致性为85.15%(图2)。而与鱼和两栖类UCP1氨基酸序列同源性低于61%(表2)。

*表示相同氨基酸
图2大绒鼠UCP1氨基酸序列与黑线仓鼠、橙腹草原田鼠、金黄仓鼠、小家鼠、褐家鼠、小马岛猬、突尼斯非洲跳鼠、豚鼠、家猫、大熊猫、蒙眼貂、苏门答腊猩猩、食蟹猴、牛、树鼩、水牛和野骆驼的比对
Fig 2 Comparison amino acid residues ofEothenomysmiletusUCP1 with that ofCricetulusgriseus,Microtusochrogaster,Mesocricetusauratus,Musmusculus,Rattusnorvegicus,Echinopstelfairi,Jaculusjaculus,Caviaporcellus,Feliscatus,Ailuropodamelanoleuca,Mustelaputoriusfuro,Pongoabelii,Macacafascicularis,BosTaurus,Tupaiachinensis,BubalusbubalisandCamelusferus
2.4 UCP 1基因系统进化树的构建
将扩增得到的UCP1序列与橙腹草原田鼠(XM_005369550.1)、小家鼠 (NM_009463.3)、大鼠Rat (M11814.1)、智人Homosapiens(NM_021833.4)、东非狒狒Papioanubis(XM_003899212.1)、白犀牛Ceratotheriumsimum(XM_004426473.1)、鲤鱼Cyprinuscarpio(AY461434.2)和热带爪蟾Xenopus(Silurana)tropicalis(NM_001113882.1)的UCP1序列构建系统进化树,从图3可以看出,UCP1虽然在进化过程中高度保守,但也存在种属特异性。大绒鼠与橙腹草原田鼠聚成一支,构成田鼠类分支。
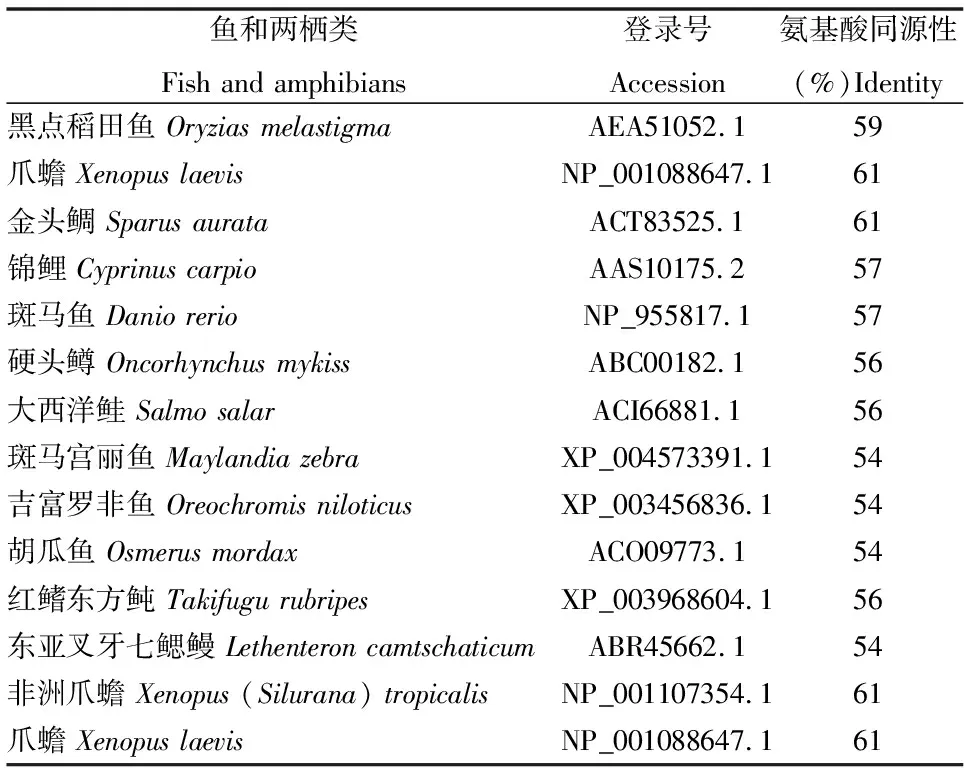
表2 大绒鼠与鱼和两栖类UCP1氨基酸序列同源性比较结果

图3UCP1 cDNA序列系统进化树
Fig 3 Evolutionary tree ofUCP1 cDNA sequence
3 讨论
UCP1基因在哺乳动物中高度保守[10],之前的研究认为UCP1的进化是真兽类出现以后才出现的一种特殊的进化过程[9]。直到在鱼类中发现UCP1蛋白后,学者认为UCP1蛋白并非像过去认为的那样,有可能是一种较为古老的蛋白[17]。有研究表明:从整个真兽类的进化关系来看,UCP1通过正向选择获得产热功能[13,19]。本研究对大绒鼠UCP1基因cDNA序列与哺乳类的UCP1基因cDNA序列的氨基酸同源性的研究表明,大绒鼠与哺乳动物的氨基酸同源性在85%左右,说明UCP1基因在哺乳动物中高度保守。其中与小型哺乳动物氨基酸的同源性在90%左右,高于与大型哺乳动物的氨基酸同源性80%。UCP1基因在小型哺乳动物中表现出更高的保守性可能与UCP1的功能有关,小型哺乳动物体型小,容易受到环境变化的影响,而UCP1介导的非颤抖性产热是小型哺乳动物适应严寒环境的有效而经济的产热方式,在其维持体温稳定和能量稳态中发挥重要的调节作用。而大绒鼠UCP1氨基酸的同源性与鱼和两栖类的同源性比较低,在61%以下。然而关于UCP1基因在哺乳动物中进化机制仍然不清楚,需要进一步研究。本研究利用大绒鼠UCP1序列所构建的系统进化树准确定位了啮齿类与灵长类、两栖类和鱼类的亲缘关系,说明以UCP1序列构建的系统进化树具有较高的可信度。从进化树中可以看出UCP1在进化过程中高度保守,但也存在种属特异性,大绒鼠与橙腹草原田鼠聚成一支,构成田鼠类分支。
总之,本研究中以UCP1基因序列构建的系统进化树和与哺乳类、鱼类和两栖类氨基酸的同源性的比较发现,UCP1蛋白在哺乳类中高度保守,其介导的质子漏产热在一些小型哺乳动物(尤其是啮齿类)抵御寒冷环境中扮演重要的作用。
参考文献:
[1]Gesta S, Tseng Y H, Kahn C R. Developmental origin of fat: tracking obesity to its source[J]. Cell, 2007, 131(2): 242-256.
[2]van Marken Lichtenbelt W D, Vanhommerig J W, Smulders N M, et al. Cold-activated brown adipose tissue in healthy men[J]. New England Journal of Medicine, 2009, 360(15): 1500-1508.
[3]Virtanen K A, Lidell M E, Orava J, et al. Functional brown adipose tissue in healthy adults[J]. New England Journal of Medicine, 2009, 360(15): 1518-1525.
[4]Cypess A M, Lehman S, Williams G, et al. Identification and importance of brown adipose tissue in adult humans[J]. New England Journal of Medicine, 2009, 360(15): 1509-1517.
[5]Golozoubova V, Hohtola E, Matthias A, et al. Only UCP1 can mediate adaptive nonshivering thermogenesis in the cold[J]. The FASEB Journal, 2001, 15(11): 2048-2050.
[6]Zhang L, Liu P F, Zhu W L, et al. Variations in thermal physiology and energetics of the tree shrew (Tupaiabelangeri) in response to cold acclimation[J]. Journal of Comparative Physiology B, 2012, 182(1): 167-176.
[7]Zhu W L, Huang C M, Zhang L, et al. Changes of energy metabolism, thermogenesis and body mass in the tree shrew (TupaiabelangerichinensisTupaiidae, Scandebtia) during cold exposure[J]. Italian Journal of Zoology, 2012, 79(2): 175-181.
[8]Nicholls D G, Locke R M. Thermogenic mechanisms in brown fat[J]. Physiological Reviews, 1984, 64(1): 1-64.
[9]Cannon B, Nedergaard J. Brown adipose tissue: function and physiological significance[J]. Physiological Reviews, 2004, 84(1): 277-359.
[10]Lin C S, Klingenberg M. Characteristics of the isolated purine nucleotide binding protein from brown fat mitochondria[J]. Biochemistry, 1982, 21(12): 2950-2956.
[11]Aquila H, Link T A, Klingenberg M. The uncoupling protein from brown fat mitochondria is related to the mitochondrial ADP/ATP carrier. Analysis of sequence homologies and of folding of the protein in the membrane[J]. The EMBO Journal, 1985, 4(9): 2369.
[12]Bouillaud F, Ricquier D, Thibault J, et al. Molecular approach to thermogenesis in brown adipose tissue: cDNA cloning of the mitochondrial uncoupling protein[J]. Proceedings of the National Academy of Sciences USA, 1985, 82(2): 445-448.
[13]Saito S, Saito C T, Shingai R. Adaptive evolution of the uncoupling protein 1 gene contributed to the acquisition of novel nonshivering thermogenesis in ancestral eutherian mammals[J]. Gene, 2008, 408(1): 37-44.
[14]Zingaretti M C, Crosta F, Vitali A, et al. The presence of UCP1 demonstrates that metabolically active adipose tissue in the neck of adult humans truly represents brown adipose tissue[J]. The FASEB Journal, 2009, 23(9): 3113-3120.
[15]Hughes D A, Jastroch M, Stoneking M, et al. Molecular evolution of UCP1 and the evolutionary history of mammalian non-shivering thermogenesis[J]. BMC Evolutionary Biology, 2009, 9(1): 4.
[16]Trzcionka M, Withers K W, Klingenspor M, et al. The effects of fasting and cold exposure on metabolic rate and mitochondrial proton leak in liver and skeletal muscle of an amphibian, the cane toadBufomarinus[J]. Journal of Experimental Biology, 2008, 211(12): 1911-1918.
[17]Jastroch M, Wuertz S, Kloas W, et al. Uncoupling protein 1 in fish uncovers an ancient evolutionary history of mammalian nonshivering thermogenesis[J]. Physiological Genomics, 2005, 22(2): 150-156.
[18]王政昆, 孙儒泳, 李庆芬, 等. 中缅树鼩静止代谢率的研究[J]. 北京师范大学学报, 1994, 30(3): 408-414.
[19]Klingenspor M, Fromme T, Hughes D A Jr, et al. An ancient look at UCP1[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2008, 1777(7): 637-641.

