体外血脑屏障模型的建立及功能测定
陈 雪 王 军 王 伟 骆 翔 喻志源
血脑屏障由沿着中枢神经系统微血管排列的内皮细胞行成,在维持神经细胞信号通讯所需的精密调节的微环境中起着重要的作用[1]。血脑屏障的主要作用有4条:(1)维持中枢神经系统稳态;(2)将脑组织与血流分开,保护脑组织免受血流中细胞成分的影响;(3)通过特定的转运系统持续提供养分;(4)代谢或者调整脑和血液中的成分[2~4]。中枢神经系统的许多疾病都涉及到BBB的破坏,例如脑缺血、癫痫间、多发性硬化、阿尔茨海默病等[5~9]。因此,建立体外血脑屏障模型便于我们对于血脑屏障生理功能以及病理变化进行深入研究,对于脑血管病的研究有着重要的实用价值。
1 材料与方法
1.1 材料与试剂
实验动物为SD大鼠乳鼠由华中科技大学同济医学院动物房提供;胎牛血清、胶原酶、明胶购自Gibco公司;DMEM/F12培养基、EBSS/M199培养基、PBS购自美国Hyclone公 司;0.4 um Transwell12孔板、T25细胞培养瓶购自美国Corning公司;兔抗大鼠VWF、兔抗大鼠紧密连接蛋白ZO-1购自美国abcam公司;Cy3标记的羊抗兔IgG、FITC标记的羊抗小鼠IgG购自美国Jackson实验室;DAPI、BSA、多聚赖氨酸、胰蛋白酶购自美国Sigma公司;70 um过滤筛网购自美国BD公司;EVOM2电阻仪购自WPI上海分公司。
1.2 大鼠微血管内皮细胞的原代培养
步骤1:取出生后1~3 d内的SD大鼠乳鼠经75%乙醇消毒,用眼科剪和眼科镊取出大脑,放置于装有D-hank’s液的称量瓶中充分漂洗;于冰上将脑组织除去小脑,仔细剔除脑膜;钳取皮层放置于一新的D-hank’s液的称量瓶中,剪碎组织块成1 cm×cm的小块;步骤2:巴氏管吸出组织块悬液加入匀浆器中匀浆,匀浆后的液体经100目滤网过滤;取细胞过滤液,经70μm滤膜过滤;重悬滤膜上的沉淀,收集悬液至离心管中,4℃,1000 r/min;10 min离心;弃上清,加入2型胶原酶37℃震荡消化30 min;4℃,1000 r/min,10 min离心;步骤3:弃上清,用含20%胎牛血清EBSS/M199培养基重悬沉淀,以密度106/ml接种于明胶包被的T25细胞培养瓶中,放置于37℃、5%CO2、20%O2培养箱中进行培养;第2 d更换培养基,此后每隔1~2 d换液1次,细胞融合90%传代。
1.3 大鼠星形胶质细胞的原代培养
同上步骤1;步骤2:加入等量的0.25%不含EDTA的胰酶,放置细胞培养箱中消化2~3 min;加入含血清培养基终止消化,经200目滤网机械过滤;取细胞过滤液,4℃,800 r/min,8 min离心;步骤3:弃上清,用含20%胎牛血清的DMEM/F12培养基重悬沉淀,以密度106/ml接种于多聚赖氨酸包被的T25细胞培养瓶中,放置于细胞培养箱中进行培养;第2 d更换培养基,此后每隔1~2 d换液1次,细胞融合90%传代。
1.4 体外血脑屏障模型的建立
1.4.1 内皮细胞单培养模型 步骤1:用0.25%胰蛋白酶消化,含20%胎牛血清DMEM/F12培养基终止消化,4℃,800 r/min,8 min离心,含20%胎牛血清DMEM/F12培养基重悬沉淀;步骤2:调整细胞密度为5×104/ml,接种于明胶包被的12孔板Transwell小室的正面;第2 d更换培养基,此后每2天换液1次。
1.4.2 星形胶质细胞单培养模型 同步骤1;步骤2:翻转transwell小室,调整细胞密度为105/ml,接种于明胶和多聚赖氨酸包被的12孔板Transwell小室的背面,细胞贴壁2 h,翻转小室;第2 d更换培养基,此后每2 d换液1次。
1.4.3 共培养模型 星形胶质细胞消化同上步骤,待星形胶质细胞达到70%融合后,在小室正面接种内皮细胞,内皮细胞消化同上步骤,第2 d用含20%胎牛血清DMEM/F12培养基换液,此后每2 d换液1次。
1.5 微血管内皮细胞和星形胶质细胞的免疫组织化学染色
取出已固定好的微血管内皮细胞和星形胶质细胞爬片;PBS漂洗5 min×3次;0.25%Triton X-100液破膜15 min;PBS漂洗5 min×3次;加入封闭液,封闭1 h;PBS漂洗5 min×3次;加入一抗兔抗大鼠VWF(1∶500),兔抗大鼠ZO-1(1∶200);小鼠抗大鼠GFAP(1∶200);4℃冰箱中孵育过夜;PBS漂洗8 min×4次;加入二抗羊抗兔Cy3以及二抗羊抗小鼠FITC,避光,室温孵育1 h;PBS漂洗8 min×4次;加入用DAPI工作液,避光,室温孵育15 min;PBS漂洗5 min×3次;50%甘油封片;置于荧光显微镜下观察并拍照。
1.6 跨内皮细胞电阻(TEER值)的测定
待Transwell小室中内皮接种1周左右,采用WPI公司的EVOM2电阻仪检测TEER值,方法严格参照仪器说明书。TEER值反映的是小离子通透物理屏障的电阻抗,被公认为是测定血脑屏障完整性最精确和敏感的工具。TEER值的下降表明血脑屏障通透性的增加,屏障功能的破坏。通过减去没有接种细胞小室膜的TEER值得到血脑屏障的TEER值,表达的单位是Ωcm2。自TEER值即将稳定作为起始开始记录。
1.7 统计学处理
计量数据以¯x±s表示,采用t检验,P<0.05,为差异有统计学意义。
2 结 果
2.1 大鼠脑微血管内皮细胞的原代培养
原代混悬液中有一些未分离完全的神经组织以及红细胞,1 d后换液可清除,2~3 d可见细胞形成的散在细胞群落,8~9 d细胞逐渐融合,紧密排列,没有相互重叠,构成典型的铺路石样结构。用内皮细胞特异性标志物VWF进行免疫组化鉴定显示,95%的细胞表达VWF抗原(图1)。

图1 脑微血管内皮细胞免疫组化鉴定(×400倍) (A)红色为VWF阳性的细胞;(B)蓝色为DAPI染上的细胞核;(C)VWF、DAPI双标(bar=100μm)
2.2 大鼠脑微血管内皮细胞紧密连接蛋白ZO-1的免疫组化鉴定
紧密连接蛋白ZO-1表达于内皮细胞膜上,呈现连续线状分布(图2)。
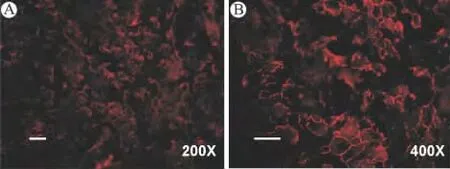
图2 脑微血管内皮细胞ZO-1的免疫组化鉴定 (A)放大200倍的内皮细胞ZO-1染色(bar=40μm);(B)放大400倍的内皮细胞ZO-1染色(bar=100μm)
2.3 大鼠脑星形胶质细胞的原代培养
星形胶质细胞呈不规则形,胞体肥大扁平,折光性较强,细胞边界清晰,连接成网(图3)。
2.4 TEER值的测定
自TEER值即将开始稳定为第1 d,开始记录内皮细胞单培养模型、星形胶质细胞单培养模型、共培养模型中1、2、4、6、8、10 d的TEER值的变化。发现在第10 d时内皮细胞单培养模型TEER值为(42±1.41)Ωcm2,内皮细胞和星形胶质细胞共培养模型TEER值为(65±1.42)Ωcm2,并且2组TEER值比较有统计学差异(P<0.05)(图4)。
3 讨 论

图3 脑星形胶质细胞免疫组化鉴定(×400倍) (A)绿色为GFAP阳性的细胞;(B)蓝色为DAPI标记的细胞核;(C)GFAP、DAPI双标(bar=100μm)

图4 三种不同的血脑屏障模型TEER值的变化:EC为内皮细胞单培养模型,AS为星形胶质细胞单培养模型,EC+AS为共培养模型,在第4、6、8、10 d时与内皮细胞单培养模型组TEER值比较(*P<0.05)
血脑屏障(BBB)是一个动态的、复杂的血液与中枢神经系统间的屏障,严格控制血液和大脑之间的物质交换,因此对于大脑的稳态发挥关键作用,对许多有毒物质和病原体提供保护作用[10]。尽管血脑屏障通透性是由脑微血管内皮细胞的生物学特征控制[11],但是这些特性与内皮细胞同周细胞、星形胶质细胞、神经元等的物理和化学的相互作用有关,他们统称为神经血管单元(the neurovascular unit,NVU),形成了一个调节分子进出大脑的功能性屏障[12~14],对中枢神经系统的功能维持十分重要。
本研究结果显示,在第10 d时内皮细胞和星形胶质细胞共培养模型TEER值为(65±1.42)Ωcm2,内皮细胞单培养模型TEER值为(42±1.41)Ωcm2,并且2组TEER值相比有统计学差异(P<0.05),说明相比单细胞培养模型,共培养模型TEER值增加,更加接近在体血脑屏障的特性,更能够很好模拟在体血脑屏障,证明了星形胶质细胞与内皮细胞的相互作用对于BBB的性能产生和维持非常重要。星形胶质细胞可以上调许多BBB的特性,上调紧密连接蛋白(物理屏障)[15,16]和内皮细胞特殊的转运系统,包括葡萄糖转运体1(GLUT1),Pgp[16](转运屏障)的表达,促使其极性分布,同时上调特定酶系统的表达(代谢屏障)[17~19]。
现在已知的体外的血脑屏障模型有多种,除了本研究的3种外还有内皮细胞和星形胶质细胞非接触共培养模型、内皮细胞和周细胞共培养模型、内皮细胞、星形胶质细胞和周细胞共培养模型等。在内皮细胞和星形胶质细胞非接触模型中虽然星形胶质细胞可以上调内皮细胞紧密连接蛋白的表达[20],但是对内皮细胞特异性酶系统γ-GT、ALT的表达没有诱导作用[21]。加入周细胞的共培养的模型也能很好体现在体血脑屏障的特性,但是使用周细胞的血脑屏障模型不够经济实用,方法复杂,并且增加了细胞种类,难以保证模型建立时细胞都处于最佳的培养状态。
综上所述,本研究建立了最经典实用的微血管内皮细胞和星形胶质细胞接触共培养模型。通过TEER值的测定对模型进行了比较分析,证明内皮细胞和星形胶质细胞接触共培养使血脑屏障模型更加完整,更加接近在体血脑屏障的特性。该模型的建立为研究血脑屏障生理功能以及病理变化提供了有力的工具。
1 Abbott NJ,Rännböck L,Hansson E.Astrocyte-endothelial interactions at the blood-brain barrier.Nat Rev Neurosci,2006,7(1):41-53.
2 Petty MA,Lo EH.Junctional complexes of the blood brain barrier:permeability changes in neuroinflammation.Prog Neurobiol,2002,68(5):311-323.
3 Lee SW,Kim WJ,Park JA,et al.Blood brain barrier interfaces and brain tumors.Arch Pharm Res,2006,29(4):265-275.
4 Persidsky Y,Ramirez SH,Haorah J,et al.Blood-brain barrier:structural components and function under physiologic and pathologic conditions.J Neuroimmune Pharmacol,2006,1(3):223-236.
5 Nishitsuji K,Hosono T,Nakamura T,et al.Apolipoprotein E regulates the integrity of tight junctions in an isoform-dependent manner in an in vitro blood brain barrier model.J Biol Chem,2011,286(20):17536-17542.
6 Ujiie M,Dickstein DL,Carlow DA,et al.Blood brain barrier permeability precedes senile plaque formation an Alzheimer disease model.Microcirculation,2003,10(6):463-470.
7 McQuaid S,Cunnea P,McMahon J,et al.The effects of blood brain barrier disruption on glial cell function multiple sclerosis.Biochem Soc Trans,2009,37(Pt 1):329-331.
8 Kim DW,Moon Y,Gee NH,et al.Blood brain barrier disruption is involved in seizure and hemianopsia in nonketotic hyperglycemia.Neurologist,2011,17(3):164-166.
9 Tomkins O,Shelef I,Kaizerman I,et al.Blood brain barrier disruption in post-traumatic epilepsy.J Neurol Neurosurg Psychiatry,2008,79(7):774-777.
10 Cardoso FL,Brites D,Brito MA.Looking at the blood brain barrier:Molecular anatomy and possible investigation approaches.Brain Res Rev,2010,64(2):328-363.
11 Pardridge WM.Blood-brain barrier biology and methodology.J Neurovirol,1999,5(6):556-569.
12 Lo EH,Dalkara T,Moskowitz MA.Mechanisms,challenges and opportunities in stroke.Nat Rev Neurosci,2003,4(5):399-415.
13 Hermann DM,Chopp M.Promoting brain remodelling and plasticity for stroke recovery:therapeutic promise and potential pitfalls of clinical translation.Lancet Neurol,2012,11(4):369-380.
14 Zlokovic BV.Neurovascular pathways to neurodegeneration in Alzheimer's disease and other disorders.Nat Rev Neurosci,2011,12(12):723-738.
15 Dehouck MP,M resse S,Delorme P,et al.An easier,reproducible,and mass-production method to study the blood brain barrier in vitro.J Neurochem,1990,54(5):798-1801.
16 Rubin LL,Hall DE,Porter S,et al.A cell culture model of the blood brain barrier.J Cell Biol,1991,115(6):1725-1735.
17 Abbott NJ.Astrocyte endothelial interactions and blood brain barrier permeability.J Anat,2002,200(6):629-638.
18 Hayashi Y,Nomura M,Yamagishi S,et al.Induction of various blood brain barrier properties in non-neuronal endothelial cells by close apposition to co-cultured astrocytes.Glia,1997,19(1):13-26.
19 Haseloff RF,Blasig IE,Bauer HC,et al.In search of the astrocytic factor(s)modulating blood brain barrier functions in brain capillary endothelial cells in vitro.Cell Mol Neurobiol,2005,25(1):25-39.
20 Arthur FE,Shivers RR,Bowman PD.Astrocyte-mediated induction of tight junctions in brain capillary endothelium:an efficient in vitro model.Brain Res,1987,433(1):155-159.
21 Meyer J,Rauh J,Galla HJ.The susceptibility of cerebral endothelial cells to astroglial induction of blood-brain barrier enzymes depends on their pro1iferative state.J Neurochem,1991,57(6):1971-1977.

