雷公藤多甙对EAE大鼠脊髓β-APP和IL-17表达的影响
周发明 李小丽 陈光辉
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统白质脱髓鞘为主要病理特征的自身免疫性疾病。研究表明IL-23/IL-17轴在MS发生、发展中起重要作用[1]。IL-17是IL17家族的代表性因子,能诱导多种致炎性细胞因子的产生,促进炎症反应和自身免疫性疾病的发生。随着研究的深入,人们发现MS早期即出现轴索损伤[2],这可能是MS患者反复发作后部分神经功能无法完全恢复的原因。β-APP是轴索损害的一个敏感指标[3],通过对β-APP的检测可以判断轴索损伤的程度和范围,保护MS的轴索损伤已成为主要的研究方向。雷公藤多甙已在临床广泛运用于治疗免疫性疾病,但雷公藤多甙对EAE大鼠的保护作用机制如何,相关报道并不多见。本研究通过雷公藤多甙对实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)大鼠进行干预,并对大鼠的发病率、发病后神经功能评分、中枢神经组织病理变化以及β-APP、IL-17等指标进行研究分析,以探讨雷公藤多甙对EAE作用的可能机制。
1 材料与方法
1.1 动物及试剂 6~8周龄雌性Wistar大鼠30只,体重约180~200 g(学校实验动物中心提供)。卡介苗冻干粉购自上海生物制品研究所;IL-17试剂盒购自上海西唐生物科技有限公司;兔抗大鼠β-APP多克隆抗体购自北京中杉金桥;SABC免疫组化试剂盒、DAB显色试剂盒购自武汉博士德生物工程有限公司;雷公藤多甙片(TWP)为黄石飞云制药有限公司生产(Z42021312)。
1.2 EAE模型的建立及评分 等量的豚鼠脊髓匀浆和含8 mg/ml卡介苗的完全福氏佐剂(CFA)混合为免疫抗原,Wistar大鼠按0.5 ml/只分别于大鼠后足垫及背部皮下注射免疫抗原,诱导EAE模型[4]。于豚鼠免疫后每天对豚鼠进行神经功能评分。采用Hooper的7分评分标准,即0分:正常;1分:被毛不光整,尾部无力;2分:尾部瘫痪;3分:尾部瘫痪+后肢无力;4分:尾部瘫痪+后肢部分瘫痪;5分:后肢完全瘫痪;6分:四肢瘫痪;7分:濒死状态或死亡[5]。
1.3 分组及给药 将大鼠随机分成3组即(1)空白对照组(CON组,n=10):相同条件和环境中饲养,不作任何处理,用于反映正常生理状态;(2)模型组(EAE组,n=10):使用豚鼠脊髓匀浆与CFA混合抗原乳剂诱导大鼠建立EAE模型,并予生理盐水1.5 ml/只灌胃,1次/d,连续14 d;(3)治疗组(TWP组,n=10):使用豚鼠脊髓匀浆与CFA混合抗原乳剂诱导大鼠建立EAE模型,将雷公藤多甙片溶于生理盐水中,以剂量20 mg/kg灌胃,1次/d,连续14 d。
1.4 HE染色 于建模后14 d(此时接近EAE模型发病的高峰期)处死大鼠,取脊髓中腰膨大部分,放入4%多聚甲醛固定,制成石蜡切片,苏木素-伊红(HE)染色,将切片在光学显微镜下进行观察,观察组织中血管周围炎性细胞浸润情况,并记数血管周围袖套数目,3张切片上血管袖套数目取平均值(病理评分)进行统计分析。
1.5 免疫组化染色 石蜡切片脱蜡至水,抗原修复液修复等行β-APP、IL-17免疫组织化学染色。结合HE染色,将免疫组织化学染色完毕的切片在光学显微镜下观察,按顺序计数每张切片脊髓内5个400倍视野下阳性细胞个数,细胞的表达以该片阳性细胞数/5表示,然后取3张切片的平均值表示该组表达水平。
1.6 统计学处理 实验数据采用均数±标准差(¯x±s)表示,2组间计量资料比较用两独立样本t检验,P<0.05为差异有统计学意义。使用SPSS13.0统计软件。
2 结 果
2.1 大鼠发病情况及神经功能评分 空白对照组大鼠活动正常,无1例出现EAE症状;大鼠造模后EAE组第9 d开始发病;TWP组第11 d开始发病。发病大鼠均以尾部远端张力下降、爬行时尾尖下垂为首发症状,继而出现步态摇摆,进而出现全尾瘫痪、拖地,后肢无力、瘫痪等症状,部分合并前肢瘫痪,甚至濒死。CON组大鼠平均神经功能评分为0,无临床症状。EAE组与TWP组2组间发病率和潜伏期无明显差异。TWP组较EAE组平均神经功能评分降低(P<0.05)(表1)。
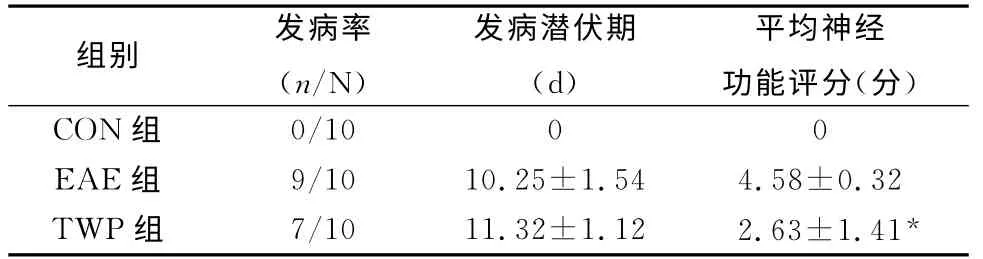
表1 各组大鼠EAE发病情况
2.2 大鼠脊髓HE染色
CON组大鼠脊髓HE染色均匀,无炎性细胞浸润(图1);EAE组大鼠脊髓白质内炎性灶多见,以小血管为中心并可见中心小血管扩张,管周由大量炎性细胞浸润,以淋巴细胞和巨噬细胞为主,也可见胶质细胞及一定数量的巨嗜细胞浸润环绕,形成“袖套”样改变(图2),病理评分为(2.09±0.91)分。TWP组炎性细胞浸润及血管“袖套”明显减少,病理评分为(1.05±0.36)分。TWP组病理评分较EAE组降低(P<0.05)。
2.3 大鼠脊髓β-APP、IL-17表达水平
各组内均可见明显阳性细胞表达,表现为细胞浆着色,呈黄褐或黄色,不均匀散在分布。与EAE组比较(表2,图3~6),TWP组大鼠组织中β-APP、IL-17表达水平均降低(P<0.05)。
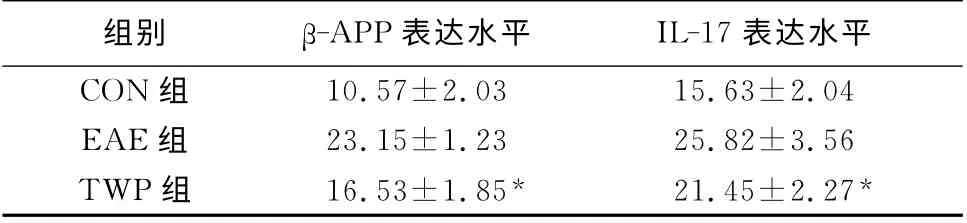
表2 各组大鼠β-APP、IL-17的表达水平(¯x±s,个/每400倍视野)
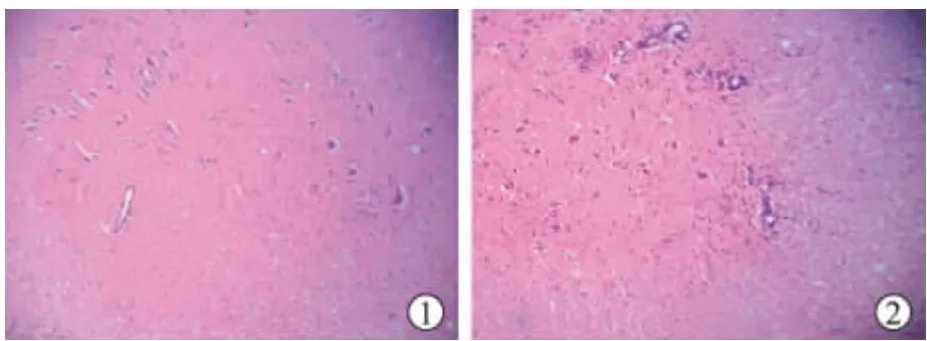
图1 CON组大鼠腰髓,未见炎症细胞浸润(HE染色×100倍) 图2 EAE组第14 d大鼠腰髓,炎症细胞浸润,血管袖套形成(HE染色×100倍)

图3 EAE组β-APP表达水平(×400倍) 图4 TWP组β-APP表达水平(×400倍)

图5 EAE组IL-17表达水平(×400倍) 图6 TWP组IL-17表达水平(×400倍)
3 讨 论
实验性自身免疫性脑脊髓炎(EAE)与人类多发性硬化(M S)的病理变化极其相似,是研究多发性硬化的经典动物模型,其病因、发病机制目前仍不十分明确。近来研究表明IL-23/IL-17轴在MS发生、发展中起重要作用。IL-17是由IL-23诱导生成的Thl7细胞分泌,IL-17家族的代表性因子,能诱导多种致炎性细胞因子的产生,如IL-6、肿瘤坏死因子1和一氧化氮合酶等,促进炎症反应和自身免疫性疾病的发生。有研究在EAE发病前检测外周淋巴细胞内即有显著升高,发病高峰期外周淋巴细胞内IL-17表达不明显,但在CNS中可以检测到高水平的IL-17生成,可能是由于发病高峰期Thl7细胞主要转移至CNS所致[6]。梁军利等的研究检测到复发缓解型MS(RR-MS)患者血清和脑脊液IL-17水平较神经系统非炎症疾病患者明显增高,提示IL-17与MS的发病密切相关[7]。Kebir等发现MS患者血脑屏障(BBB)内皮细胞表达IL-17和IL-22受体,并且体内外IL-17和IL-22均可以诱导BBB内皮细胞表达CCL2,CCL2与Thl7细胞表面相应的趋化因子受体结合后破坏紧密连接,有效地通过BBB进入中枢神经系统,也参与诱导EAE的发生[8]。在IL-17基因敲除小鼠对EAE不敏感,表现为发病延迟且恢复更早,EAE严重程度评分和病理改变都明显减轻[9],提示IL-17在MS(和EAE)的发生、发展过程中具有重要作用。
近来对MS研究发现,单纯的炎症和脱髓鞘已经不能完全解释患者的神经功能障碍,在MS早期以炎症反应为主的阶段非脱髓鞘损害就已存在,而后者是MS功能障碍进展的重要原因[10]。轴索损伤是影响患者治疗和康复的重要因素,轴索损害越重MS患者的预后越差[11]。越来越多的证据支持轴索损伤在多发性硬化中的重要性,目前轴索损伤的依据主要来自于病理学和神经影像学两个方面。在病理学方面Trapp的研究结果表明,在MS发病过程中不仅发生了脱髓鞘改变,轴索也受到了损伤[12]。Amold通过MRI研究发现,一些MS患者的神经元轴突方向上有一种非炎症性的病理损害,表明与炎性细胞浸润、脱髓鞘无关的神经损害机制可能参与了MS的发病[13]。只有轴突甚至神经元受到损害才能解释这些不可逆的神经障碍,所以可能存在某种有害因素绕过了髓鞘而直接损害神经元。β-淀粉样前体蛋白(β-Amyloid Precursor Proteinβ-APP)是一种广泛存在于全身组织,具有膜受体蛋白样结构的单跨膜蛋白。β-APP作为轴索损害的一个敏感指标,通过对β-APP的检测可以判断轴索损伤的程度和范围。据报道用免疫组织化学的方法对多发性硬化病变组织的β-APP进行了检测,表明急性多发性硬化、慢性活动期等病变组织有较多的β-APP沉积,因为早期轴突的轴浆运输功能障碍导致β-APP的沉积[14],以上结果表明从定性定量的角度证实在EAE中确实存在轴索损伤,且随病情活动β-APP的表达量呈动态变化。国内也有研究表明,EAE模型组大鼠中枢β-APP蛋白的表达高于对照组,差异有统计学意义[15]。Ghosh等通过免疫染色检测β-App已经在MS急性脱髓鞘病灶中证实存在实质性轴索损伤,同时发现在部分其他急性脱髓鞘疾病中也会出现相同情况[16]。轴突的损伤与浸润的CD8+的细胞毒性T淋巴细胞有关。Owens等人发现MS早期广泛轴突损伤的范围和中枢神经系统内CD8+T淋巴细胞的数量存在相关关系[17]。提示在强调由炎症引发的髓鞘脱失导致继发的神经元损害的同时,各种有害因素对神经元的直接破坏作用也不可忽视。有关MS的研究中在围绕如何减轻炎性反应、保护髓鞘的同时,也应该重视对轴索的保护。
雷公藤多甙具有抗炎、抗免疫、抗肿瘤等多种活性,已在临床广泛运用[18]。郑和忠等的实验表明雷公藤多甙能明显减轻EAE大鼠发病病情和延缓发病时间[19]。近年来又有研究发现雷公藤多甙还具有神经保护功能[20]。本研究给予TWP干预治疗后在EAE模型大鼠发病高峰期可观察到TWP能减轻EAE大鼠临床症状,减少EAE发病。TWP组炎性细胞浸润及血管“袖套”明显减少,病理评分为(1.05±0.36)分。TWP组病理评分较EAE组降低,差异有显著统计学意义(P<0.05)。免疫组化法检测与EAE比较,TWP组大鼠组织中β-APP阳性表达水平降低,差异有显著统计学意义(P<0.05);IL-17水平也较EAE组减少,差异有统计学意义(P<0.05)。本实验表明TWP干预使大鼠EAE的发生明显受到抑制,EAE严重程度评分和病理改变都明显减轻。因此,认为TWP对EAE大鼠有保护作用,且这种作用可能与TWP降低β-APP、IL-17表达,减轻轴索损伤和炎性细胞活性有关。
本实验提示TWP可干预EAE中β-APP、IL-17的表达,从而可能对EAE起到一定的治疗作用,这为我们探讨MS发病及治疗提供了新的前景。
1 Gold R,Luhder F.Interleukin-17 extended features of a key player in multiple sclerosis.Am J Pathol,2008,172(1):8-10.
2 Medana IM,Esiri MM.Axonal damage:a key predictor of outcome inhuman CNS diseases.Brian,2003,126(Pt3):515-513.
3 Mancardi G,Hart B,Roccatagliata L,et al.Demyelination and axonal damage in a non-human primate model of multiple sclerosis.J Neurol Sci,2001,184(1):41-49.
4 董 梅,刘瑞春,郭 力,等.多病程Wistar大鼠实验性变态反应性脑脊髓炎的病理研究.脑与神经疾病杂志,2004,12(6):416-419.
5 Hooper DC,Spitsin S,Kean RB,et al.Uric acid,a natural scavenger of peroxynitrite,in experimental allergic encephalomyelitis and multiple sclerosis.Proc Natl Acad Sci USA,1998,95(2):675-680.
6 Matusevicius D,Kivisakk P,He B,et al.Interleukin-17 mRNA expression in blood and CSF mononuclear cells is augmented in multiple sclerosis.Mult Scler,1999,5(2):101-104.
7 梁军利,赵丽君,吕海东,等.甲基强的松龙对复发缓解型多发性硬化血清及脑脊液白介素-23、白介素-17水平的影响.中华神经医学杂志,2014,13(3):301-303.
8 Kebir H,Kreymborg K,Ifergan I,et a1.Human TH17 lymphocytes promote blood-brain barrier disruption and central nervous system inflammation.Nat Med,2007,13(10):1173-1175.
9 Komiyama Y,Nakae S,Matsuki T,et al.IL-17 plays an important role in the development of experimental autoimmune encephalomyelitis.J Immunol,2006,177(1):566-573.
10 Greter M,Heppner FL,Lemos MP,et al.Dendritic cells permit immune invasion of the CNS in an animal model of multiple sclerosis.Nat Med,2005,11(3):328-334.
11 Bitsch A,Schuchardt J,Bunkowski S,et al.Acute axonal injury in multiple sclerosis.Brain,2000,123(pt6):1174-1183.
12 Bjartmar C,Kidd G,Mork S,et al.Neurological disability correlates with spinal cord axonal loss and reduced N-acetyl aspartate in chronic multiple sclerosis patients.Ann Neurol,2000,48(6):893-901.
13 Amold DL.Changes observed in multiple sclerosis using magnetic resonance imaging reflect a focal pathology distributed along axonal pathways.J Neurol,2005,252(Suppl 5):v25-29.
14 Coleman M.Axon degeneration mechanisms:commonality amid diversity.Nat Rev Neurosci,2005,6(11):889-898.
15周建波,曾 丽,曾广凌,等.米诺环素对实验性自身免疫性脑脊髓炎大鼠轴索损伤的影响.实用医学杂志,2011,27(6):957-959.
16 Ghosh N,Deluca G C,Esiri M M.Evidence of axonal damage in human acute demyelinating diseases.J Neurol Sci,2004,222(1-2):29-34.
17 Neumann H,Medana IM,Bauer J,et al.Cytotoxic T lymphocytes in autoimmune and degenerative CNS diseases.Trends Neurosci 2002,25(6):313-319
18 Ma WG,Zhang T,Zhang C,et al.Study and prospect on venomous Tripterygium wilfordii Hook.f.China J Tradit ChinMed Pharm,2006,21(2):117-120.
19郑和忠,余昌胤.雷公藤内脂醇对实验性自身免疫性脑脊髓炎大鼠脑和脊髓ICAM-1表达的影响.中国神经免疫学和神经病学杂志,2007,14(3):154-156.
20张 艳,贾丹辉,刘宗文,等.雷公藤多甙对大鼠局灶性脑缺血再灌注损伤的保护作用.中国新药与临床杂志,2005,24(11):862-864.

