糖尿病周围神经病电生理特点及与血糖水平的关系
周 智 彭 彬 卢祖能
当今世界随着生活水平的提高和生活习惯的改变,非传染性疾病对人类健康的威胁正日益加剧,糖尿病患者数量急剧上升。我国糖尿病患者数占全球糖尿病患者总数的1/3,国家正承受着沉重的糖尿病负担[1]。糖尿病周围神经病(diabetic peripheral neuropathy,DPN)是糖尿病的常见并发症,临床表现包括远端对称性多发性周围神经病(distal symmetric polyneuropathy,DSPN)、糖尿病自主神经病、糖尿病单神经病或多发单神经病、糖尿病神经根神经丛病、其他糖尿病相关周围神经病多种类型,其中以DSPN和自主神经病最为常见。早期识别和治疗DPN,对于改善患者预后具有重要意义。本研究就2型糖尿病周围神经病电生理特点以及临床相关因素进行分析,以探讨糖尿病周围神经病的影响因素及肌电图对早期诊断的价值。
1 资料与方法
1.1 一般资料 2013年3月~2014年3月于湖北省谷城县人民医院及本院神经内科住院的108例糖尿病周围神经病患者,详细记录自发疼痛、麻木、感觉异常情况及神经系统体检。108例患者中男52例,女56例;年龄37~85岁,平均年龄(64.3±10.5)岁;病程10月~25年。
糖尿病周围神经病诊断的基本条件:(1)明确患有糖尿病;(2)存在周围神经病变的临床和(或)电生理的证据;(3)排除导致周围神经病变的其他原因,包括慢性炎性脱髓鞘性多发性神经根周围神经病、营养缺乏、中毒、异常球蛋白血症、肝功能不全、肾功能不全、甲状腺功能减退、恶性肿瘤、结缔组织病、感染性疾病以及遗传病等。糖尿病诊断采用采用WHO(1999年)糖尿病诊断标准。
1.2 肌电图检查和血糖水平检测 所有患者均采用丹迪keypoint肌电图仪,检测时受检者均在安静、屏蔽环境中进行,室温保持在18~26℃,确保皮肤温度在28.0℃~31.4℃,患者保持清醒、安静、放松、仰卧位。进行左右侧正中、尺、胫、腓总神经的运动传导速度(MCV)和复合肌肉动作电位波幅(CMAP),以及正中、尺、腓肠神经的感觉传导速度(SCV)和感觉神经动作电位波幅(SNAP)测定,刺激强度按引出CMAP或SNAP最大波幅后,重复多次,直至波形、波幅不再变化为止。所有对象均于入院第2 d空腹采静脉血,查糖化血红蛋白、餐后2 h血糖值。
1.3 统计学处理 采用SPSS17.0软件包,计数资料组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 电生理异常情况 108例患者中有12例患者无症状,但神经传导检测异常。96例有症状患者中神经电图异常88例(91.7%),正常11例。正中神经和尺神经记为上肢神经,腓神经和胫神经记为下肢神经(表1)。
2.2 运动神经异常情况 检测864条运动神经,MCV减慢219条,CMAP波幅下降235条,总异常神经308条,异常率35.6%;其中上肢受损神经为92条,下肢受损神经216条,下肢异常率(70.1%)显著高于上肢异常率(29.8%)(χ2=84.320,P<0.05)。
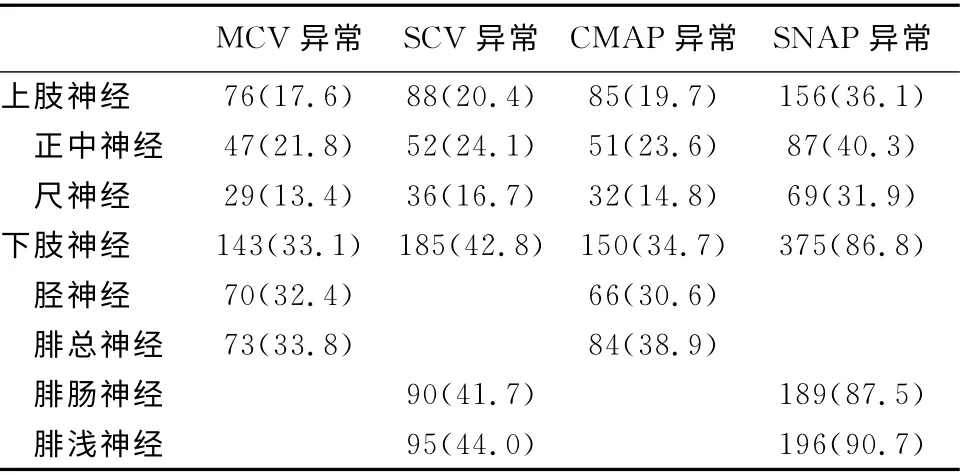
表1 受检运动神经传导速度和波幅异常情况(n,%)
2.3 感觉神经异常情况 检测864条感觉神经,SCV减慢273条,波幅下降531条,总异常神经597条(69.1%),其中上肢受损神经162条,下肢受损神经435条,差异明显(χ2=45.337,P<0.05)。波幅下降率(61.5%)高于传导速度异常率(31.6%),差异明显(χ2=28.826,P<0.05)。
2.4 MVC与SCV比较 感觉神经异常率(69.1%)多于运动神经异常率(35.6%),差异明显(χ2=91.032,P<0.05)。
2.5 糖化血红蛋白、餐后2 h血糖与MCV、SCV异常的关系 分为糖化血红蛋白<7%和≥7%组、餐后2 h血糖<11.1 mmol/L和≥11.1 mmol/L组。上下肢神经传导速度(NCV)异常总数为492条。餐后2 h血糖<11.1 mmol/LNCV异常135条,其中MCV异常48条、SCV异常87条。餐后2 h血糖≥11.1 mmol/L组NCV异常357条,其中MCV异常106条、SCV异常251条。SCV、MCV异常与餐后2 h血糖有关(χ2=6.036,P<0.05)。糖化血红蛋白<7%组NCV异常114条,其中MCV异常37条、SCV异常77条。糖化血红蛋白≥7%组NCV异常378条,其中MCV异常118条、SCV异常260条。SCV、MCV异常与糖化血红蛋白有关(χ2=7.343,P<0.05)(表2)。

表2 不同血糖水平神经传导速度异常情况(n)
3 讨 论
糖尿病对神经系统有很大的影响,是神经病变或周围神经损伤的最常见原因。此外,随着2型糖尿病患病率逐年上涨,糖尿病神经病变的患病率也在上升。2001年国内住院患者调查发现,61.8%的2型糖尿病患者并发神经病变。在吸烟、年龄超过40岁以及血糖控制差的糖尿病患者中神经病变的患病率更高。糖尿病诊断后10年内常有明显的临床糖尿病神经病变,其发生率与病程相关[2]。实际上,糖尿病神经病变的患病率大约为30%,且随着病程的发展,高达50%的患者最终将合并神经病变[3]。DPN的发病机制目前仍不明了,主要有以下学说:血管学说、代谢性学说、免疫学说、神经营养因子学说、层粘连蛋白缺陷学说、蛋白合成及轴突转运学说、基因学说等[4]。其发病机制是多因素的,包括多羟基途径的过度激活、氧化应激、遗传因素、神经缺氧和缺血以及免疫异常等均可能与DPN的发病有关。肢体麻木、疼痛等感觉异常为DPN的常见主诉,糖尿病患者出现肢体肌肉无力和萎缩通常相对较晚。
DPN可以表现为多种形式,包括多神经病和单神经病。即DPN可单独影响一支神经或不同区域内的两支或多支神经或同时影响多支神经。其中DSPN占糖尿病周围神经病的80%以上,它有明显的长度依赖性,从影响长度最长的神经开始,逐渐累及近端神经,并且大、小纤维同时受累。大纤维受累以远端感觉神经轴索损害为主,肌电图上可以见到感觉动作电位降低或消失伴有传导速度的减慢。小纤维受累表现为麻木、腿部烧灼感、针刺样和触电样疼痛等,并可以伴有腿部皮肤改变、足底溃疡、水肿等。不管是哪种形式都可以表现为运动和感觉障碍,都可以使患者致残[5]。
DPN患者感觉和运动神经波幅下降较传导速度减慢明显;感觉神经受损重于运动神经,且下肢重于上肢;通常远端神经受损更早、更严重。这与国外描述的DPN临床特点相符[6],与动物实验及国内文献一致[7],其原因可能与下肢的神经走行相对长,神经血供较差、神经元胞体提供营养并转运至神经末梢较上肢慢;感觉神经粗大纤维的兴奋阈值低而且传导比运动纤维快有关。同时本研究也证实通过电生理检测可以发现亚临床DPN。DPN起病隐匿,早期症状及体征常不明显,通过临床表现判断有时较为困难。在临床症状出现前,电生理检查可能已发现感觉和运动神经传导速度减慢,腓、胫、尺、正中神经是最常用的检查部位。重症DPN治疗困难,故对其进行早期诊断、早期治疗尤为重要。尽管这方面国内外的相关报道均较一致,但电生理检测结果有时与临床症状和体征并非完全对应。并且一部分有周围神经病症状和(或)体征的患者电生理正常,出现这种不一致的原因之一可能是常规电生理主要检测大直径的有髓Aα、Aβ纤维的功能,和痛觉以及自主神经病变有关的小纤维病变未能检测出来,而在糖尿病早期往往以小纤维受累为主[8]。基于电生理检查的局限性和患者临床表现的复杂性,在电生理检查时可加作其它神经检查以排除多神经周围病变。H反射与F波检测均是对近端神经功能进行评价,与NCV检测结合,能提高DPN早期病变诊断阳性率[9]。针对小纤维功能的特异性检查有感觉定量测定、皮肤交感反应测定以及皮肤钻孔活检表皮内神经纤维密度计数等。
在感觉检测中正中神经异常率高于尺神经异常率,腕管综合征(CTS)是神经受压综合征中最常见的一种,也称为指端感觉异常,是由于正中神经在腕部受到压迫而造成大鱼际肌无力和手部正中神经支配区的疼痛、麻木及进行性的鱼际肌萎缩。单纯CTS在2型糖尿病患者中发生率高(7.27%),高于文献报道一般人群中CTS的发病率(2.45%)[10]。据统计,糖尿病性CTS的危险性大约2.2倍高于一般女性,2.5倍高于一般男性群体[11]。美国梅奥诊所研究也发现糖尿病患者约有8.7%合并有CTS[2]。糖尿病引起的CTS机制尚不明确,并非只来源于外在解剖因素,更多是代谢、血管等内部因素异常。而且,糖尿病性CTS往往临床症状不明显,不经电生理检查,难以及时诊断及治疗。另外,下肢SNAP异常率极高,DPN的最早改变为腓肠SNAP异常[2],因此下肢的SNAP检测对于DPN诊断至关重要。
高血糖的长期作用是造成DPN的基础因素,目前认为高血糖导致的缺血、缺氧极可能是糖尿病神经病变的始动因子[12],其通过各种途径作用于雪旺细胞和神经元及其轴突,引起组织学改变及信号传导异常,导致神经病变发生。在按常规治疗的1型糖尿病患者中,每年DPN的患病率约为2%,而在严格控制血糖的1型糖尿病患者中,其患病率降低至0.56%[13]。严格控制血糖可以降低DPN的发生[3,14]。由于空腹血糖只反映瞬时血糖状况,而糖化血红蛋白值反映的是取血前8~12周血糖状况,近几年对糖化血红蛋白(HbA1c)用于糖尿病诊断的研究很多,其价值得到了公认。流行病学和循证医学研究证明HbA1c能稳定、可靠地反映患者的预后[15]。HbA1c作为反映平均血糖和评价血糖控制的金标准已被广泛应用。DPN与糖化血红蛋白有明显相关性,也表明了DPN的发生与血糖密切相关。本研究得出的结论也与上述一致。
现在也意识到,糖耐量异常也是DPN的一个危险因素,即糖尿病前周围神经病,其多累及无健鞘细纤维,神经传导速度测定主要是检测有髓鞘的大纤维,对其不敏感。另外,很多研究表明代谢综合征与DPN的发生发展也有关[3,16],近几年我们对于代谢因素如何造成神经损伤的认识逐步提高。除了血脂异常和胰岛素抵抗,内脏肥胖的危害性极大,因为其可以导致血浆中游离脂肪酸浓度升高,诱导促炎症状态,同时促进胰岛素抵抗的发展。高血压也有可能参与神经病的发生发展,它们之关的具体联系还有待进一步研究。血管紧张素转换酶(ACE)抑制剂在动物实验中已被证实可以改善糖尿病神经病变,但具体机制尚不清楚[3]。
目前研究表明,早期治疗可以控制甚至逆转周围神经的损害,目前对DPN唯一有效的治疗就是控制血糖和疼痛管理[3,17]。因此控制血糖是治疗DPN的重中之重。相对于1型糖尿病,血糖控制对2型糖尿病引起的神经系统并发症的作用更小。存在这种差异的可能原因包括临床试验中使用了不同的观察指标、治疗方案不同、2型糖尿病神经病变的发生率更高,以及在这些临床试验中基线血糖控制的差异[3]。
综上所述,电生理检测极大地提高了DPN确诊率,其特点有利于与其它疾病鉴别,使亚临床DPN得到早期诊断和治疗,并为临床疗效评估提供客观依据。控制血糖对于DPN的治疗极其重要,应积极控制血糖和糖化血红蛋白水平,保持血糖稳定,建议将糖化血红蛋白控制在7以内,但具体控制程度应个体化[14,18]。
(周智现工作于湖北省谷城县人民医院神经内科)
1 Yang W,Lu J,Weng J,et al.Prevalence of diabetes among men and women in China.N Engl J Med,2010,362(12):1090-1101.
2 Zochodne DW.Diabetes mellitus and the peripheral nervous system:manifestations and mechanisms.Muscle Nerve,2007,36(2):144-166.
3 Callaghan BC,Cheng HT,Stables CL,et al.Diabetic neuropathy:clinical manifestations and current treatments.Lancet Neurol,2012,11(6):521-534.
4 Said G,Lacroix C,Lozeron P,et al.Inflammatory vasculopathy in multifocal diabetic neuropathy.Brain,2003,126(Pt 2):376-385.
5 Pourhamidi K,Dahlin LB,Englund E,et al.No difference in small or large nerve fiber function between individuals with normal glucose tolerance and impaired glucose tolerance.Diabetes Care,2013,36(4):962-964.
6 Kincaid JC,Price KL,Jimenez MC,et al.Correlation of vibratory quantitative sensory testing and nerve conduction studies in patients with diabetes.Muscle Nerve,2007,36(6):821-827.
7 蒋雨平.糖尿病性神经病变.朱禧星主编.现代糖尿病学.上海:上海医科大学出版社,2000.333-338.
8 Sumner CJ,Sheth S,Griffin JW,et al.The spectrum of neuropathy in diabetes and impaired glucose tolerance.Neurology,2003,60(1):108-111.
9 卢祖能,王真真,董红娟,等.F波对糖尿病周围神经病的早期诊断意义.中华物理医学与康复杂志,2003,25(7):413-416.
10 Kim LN,Kwon HK,Moon HI,et al.Sonography of the median nerve in carpal tunnel syndrome with diabetic neuropathy.Am J Phys Med Rehabil,2014,93(10):897-907.
11 Thomsen NO,Cederlund R,Speidel T,et al.Vibrotactile sense in patients with diabetes and carpal tunnel syndrome.Diabet Med,2011,28(11):1401-1406.
12 Hidmark A,Fleming T,Vittas S,et al.A new paradigm to understand and treat diabetic neuropathy.Exp Clin Endocrinol Diabetes,2014,122(4):201-207.
13 Larkin ME,Barnie A,Braffett BH,et al.Musculoskeletal Complications in Type 1 Diabetes.Diabetes Care,2014.
14 Singh R,Kishore L,Kaur N.Diabetic peripheral neuropathy:current perspective and future directions.Pharmacol Res,2014,80(3):21-35.
15 Ali MK,Bullard KM,Saaddine JB,et al.Achievement of goals in U.S.diabetes care,1999-2010.N Engl J Med,2013,368(17):1613-1624.
16 De Visser A,Hemming A,Yang C,et al.The adjuvant effect of hypertension upon diabetic peripheral neuropathy in experimental type 2 diabetes.Neurobiol Dis,2014,62(5):18-30.
17 Peltier A,Goutman SA,Callaghan BC.Painful diabetic neuropathy.BMJ,2014,348(3):1799.
18中华医学会神经病学分会.糖尿病周围神经病诊断和治疗共识.中华神经科杂志,2013,46(11):787-789.

