安脑丸对脑出血大鼠学习记忆功能及血肿周围BDNF、NGB表达的影响
梁 慧 文国强
脑出血发生率在近些年来呈现着逐年上升的趋势,目前认为成熟脑组织结构和功能具有一定的可塑性,脑出血后促进神经再生现已成为治疗神经元损伤的途径之一,故脑损伤后神经保护因子的分泌已成为脑血管疾病的研究热点。BDNF是一种广泛存在于中枢神经系统内的蛋白质,对神经元的生长发育、分化及生存起着重要作用,且能防止神经细胞受损死亡,存活受损神经细胞再生及分化[1]。NGB是一种主要在脑组织中表达的携氧蛋白,有研究发现其在缺血、缺氧条件下表达升高且对于神经系统缺血、缺氧具有十分重要的神经保护功能[2]。安脑丸是在传统中药安宫牛黄丸基础上重新组方而成的一种新药,已有研究表明其对急性脑卒中所引起的窍闭、抽搐痉厥有明显疗效[3],但其具体的作用机制尚不明确。因此,本实验采用胶原酶诱导脑出血模型,用安脑丸治疗模型大鼠,通过观察其治疗后的学习记忆能力、血肿周围BDNF mRNA及NGB的表达来探讨安脑丸改善脑出血模型大鼠学习记忆能力的作用机制,为临床治疗脑出血奠定实验基础。
1 材料与方法
1.1 实验动物及分组
选取健康成年雄性Sprague-Dawley大鼠40只,体重(220±20)g,由华中科技大学同济医学院实验动物学部所提供,并随机分为正常组、假手术组、模型组及安脑丸组,每组各10只。
1.2 主要实验仪器和器材
Ⅶ型胶原酶(collagenaseⅦ):美国sigma公司;Stoelting TL-2型鼠脑立体定位仪:Biolegend公司;安脑丸:哈尔滨蒲公英药业有限公司;Morris水迷宫,Ethovision系统:荷兰Noldus公司;Trizol:Invitrogen公司;PCR反应体系内其他试剂:碧云天生物技术研究所;荧光定量PCR仪(7700型):美国ABI公司;兔抗大鼠NGB多克隆抗体:北京欣博盛生物科技公司。
1.3 方法
1.3.1 模型建立及给药 采用Rosenberg方法制作大鼠脑出血模型[4]。模型组及安脑丸组制作脑出血模型;正常组不做任何处理;假手术组中除用无菌生理盐水替代Ⅶ型胶原酶注射入苍白球外,其余操作均同模型组与安脑丸组。安脑丸在大鼠手术2 h清醒后开始给予安脑丸灌胃(1 g/kg),2次/d,连续给予7 d,模型组及假手术组灌于同等量的生理盐水。
1.3.2 模型成功评价 手术大鼠清醒后按Zea Longa法评定大鼠神经功能缺损情况[5]。0分:无神经功能缺损症状;1分:不能完全伸展出血对侧前肢;2分:向出血对侧追尾转圈;3分:向出血对侧倾倒;4分:意识障碍,不能自发行走。将评分在1-3分之间者纳为实验对象,其余给予剔除,并同时给予相应的补充。
1.3.3 测定血肿周围BDNF mRNA表达水平 各组大鼠于连续治疗7 d后各取5只采用过量10%水合氯醛麻醉后,快速断头取脑,剥离出少许血肿周围组织,总RNA提取按Trizol试剂盒说明书进行。选择紫外分光光度计测定RNA浓度与纯度。运用反转录试剂盒将RNA逆转录为cDNA分子,反应体积为10μl,在37℃下孵育15 min,85℃下5 s以终止反应及灭活反转录酶,将管家基因GAPDH作为内参照进行质控及标准化,对获得的条带行灰度值分析。BDNF上游引物序列:5’-GTCCCTTCTACACTTTACCTCTTG-3’;下 游 引 物 序 列:5’-CTTTGTTTCACCCTTTCCACTCCT-3’;内 参GAPDH上 游 引 物 序 列:5’-CACGGCAAGTTCAACGGCACAG-3’;下游引物序列:5’-ACGCCAGTAGACTCCACGACAT-3’。
1.3.4 免疫组化法检测血肿周围NGB阳性细胞的表达水平 各组大鼠在治疗7 d后各取5只用10%水合氯醛麻醉,采用4%多聚甲醛溶液灌注固定,待大鼠躯体变硬后断头取脑,固定于同样4%多聚甲醛后,分别先后置入20%、30%蔗糖溶液中,待组织沉底后放入恒冷切片机进行切片,保存备用;滴加正常山羊血清封闭,室温下放置30 min;滴加兔抗NGB一抗50μl,4℃下孵育24 h;加相应的生物素二抗,室温下孵育30 min;滴加SABC试剂,30℃下孵育30 min,加新鲜配制的二甲苯联苯胺(DAB)显色剂,显微镜下控制显色时间;常规脱水、透明、中性树胶封片;光镜下观察、拍照并记录。
1.3.5 学习记忆能力测定 采用Morris水迷宫法检测空间学习记忆能力[6]。水迷宫装置参数:直径为120 cm,圆形逃逸平面直径为10 cm,高为40 cm,用黑色塑料袋将其缠绕后放于第三象限中间,平台低于水面2 cm,水池温度控制在(25±2)℃,用碳素墨水将水池中水染黑;水池周围参照物保持不变,分别从四个象限将大鼠放入水池中,等待其找到目标平台;假如大鼠在60 s内寻找到目标平台且在平台上停留15 s后将其捞起,记录其从象限出发点到找着目标平台的时间,则为逃避潜伏期(escapse latency,EL);假如大鼠在60 s内无法找到目标平台,则用竹棍将其引导至平台,待其停留在平台上15 s后捞起,引导其学习记忆,则此时的EL为60 s;用上述方法连续训练5 d后记录第6d的时间均值,并将其作为观察指标来测定学习能力,整个实验过程是由计算机来记录各种参数。
1.3.6 统计学处理
所有计量资料用均数±标准差(¯x±s)表示,采用SPSS13.0统计软件,组间差异采用单因素方差分析,2组间方差齐者用LSD法进行两两比较,P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠血肿周围BDNF mRNA的表达水平
正常组与假手术组BDNF mRNA表达水平的差异不明显(P>0.05);模型组及安脑丸组BDNF mRNA表达较正常组及假手术组均明显增多(P均<0.01);安脑丸组BDNF mRNA表达明显多于模型组(P<0.01)(表1)。
2.2 大鼠血肿周围NGB阳性细胞的表达水平
正常组及假手术组脑组织存在少量的NGB阳性细胞;模型组及安脑丸组较正常组及假手术组NGB阳性细胞明显增多(P均<0.01);安脑丸组的NGB阳性细胞数又较模型组显著增加(P<0.01)(表1,图1)。
2.3 各组大鼠学习记忆能力的检测
正常组与假手术组间逃避潜伏期无明显差异(P>0.05);模型组及安脑丸组较正常组及假手术组逃避潜伏期明显延长(P均<0.01);安脑丸组较模型组逃避潜伏期明显缩短(P<0.01)(表1)。

表1 各组大鼠血肿周围BDNF mRNA、NGB阳性细胞的表达及逃避潜伏期(¯x±s,n=10)
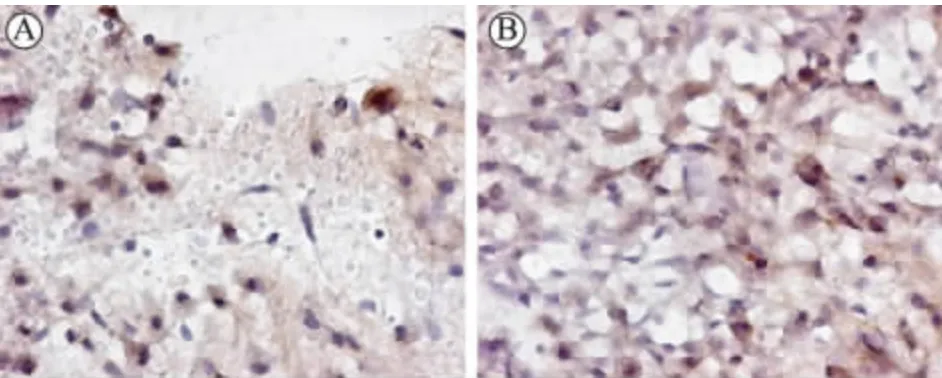
图1 免疫组化检测血肿周围NGB阳性细胞的表达水平(DAB×200倍) A为模型组;B为安脑丸组
3 讨 论
脑出血是一种神经系统常见疾病,其病死率、致残率都较高,约占脑血管疾病的17.2%~56%。脑出血后造成神经系统的损伤导致轴突无法有效再生,因此往往造成了神经系统不可逆性的功能丧失而遗留很多后遗症,其中学习记忆功能的减退是其常见的后遗症之一,严重影响了患者的生活质量,给患者及家庭甚至社会均带来了沉重的经济负担[7,8]。故探讨有效的治疗方法与促进神经功能的恢复成为了当前神经学界研究的重点。
目前Morris水迷宫已被广泛用于检测动物记忆行为学,其中定位航行实验是通过记录被测试动物每次的逃避潜伏期来反映动物对目标平台空间位置的记忆能力,从而评估动物的空间学习记忆能力。逃避潜伏期的长短是与动物空间学习记忆能力成反比。本实验结果表明安脑丸治疗可促进脑出血大鼠的逃避潜伏期明显缩短,而其具体的作用机制目前还不十分清楚。
脑红蛋白是新近发现的和血红蛋白与肌红蛋白为同一蛋白家族的第三类重要的携氧蛋白。大量研究表明在缺血、缺氧状态下NGB mRNA的表达明显增加,说明在脑缺血缺氧损伤中NGB能对神经元起到重要的保护作用[9,10]。与肌红蛋白相似,NGB在缺氧状态下可促进氧气向线粒体内弥散,从而提高氧的利用[11]。目前认为NGB可能是通过以下途径对缺血缺氧神经元起到保护作用:一是通过清除活性的氧自由基与氮自由基,从而减轻其对细胞的毒性作用;二是通过协助神经细胞的需氧代谢,从而协助氧气从细胞内扩散至线粒体内;三是通过调节某G蛋白偶联的信号转导通路而减少线粒体机能障碍与细胞凋亡,从而提高细胞存活率。本实验观察到接受安脑丸治疗后的脑出血大鼠血肿周围NGB阳性细胞数明显多于模型组(P<0.01),因此本研究推测安脑丸可通过促进脑出血血肿周围组织NGB表达来发挥其改善学习记忆能力的作用。同时,本研究还发现脑出血血肿周围BDNF mRNA的表达水平亦较模型组明显升高(P<0.01)。
在脑组织中BDNF主要是由神经细胞与胶质细胞合成释放的,在中枢神经系统的生长发育过程中发挥着重要作用,可促进神经细胞的生长与分化,对神经系统的发育和功能产生及维持起着重要作用[12]。在脑组织损伤后BDNF可通过稳定钙离子浓度、增强抗氧化酶活性及减轻自由基损伤、减少细胞凋亡、促进神经元再生等方面而促进损伤神经功能的恢复。在病理状态下如缺血、缺氧等损伤后可诱导脑组织中BDNF mRNA和蛋白表达明显增多[13],这与本实验所观察到的结果一致。
由此,本研究推测安脑丸治疗可通过促进脑出血血肿周围NGB、BDNF表达的增加,进而修复受损神经细胞来改善大鼠的学习记忆能力。关于安脑丸改善脑出血大鼠学习记忆能力的机制极其复杂,目前仍然存在着许多问题,因此仍有待进一步的深入研究。
1 Schabitz WR,Berger C,Kollmar R,et al.Effect of brain derived neurotrophic factor arm use on functional motor recovery after small cortical ischemia.Stroke,2004,35(4):992-997.
2 Li RC,Guo SZ,Lee SK,et al.Neuroglobin protects neurons against oxidative stress in global ischemia.J Cereb Blood Flow Metab,2010,30(11):1874-1882.
3 王素秋,李 恬,宋世伟,等.安脑丸的临床应用及观察分析.中国中医急症,1993,2(4):153-154.
4 Rosenberg GB.Collgenose-induced intracerebral hemorrhage in rat.Stroke,1990,21(5):801.
5 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats.Stroke,1989,20(1):84-91.
6 胡镜清,温泽淮,赖世隆,等.Morris水迷宫检测的记忆属性与方法学初探.广州中医药大学学报,2000,17(2):117-120.
7 Zhao C,Fancy SP,Kotter MR,et al.Mechanisms of CNS remyelination:The key to therapeutic advances.Neurol Sci,2005,233(1-2):87-91.
8 Lee JC,Cho GS,Choi BO,et al.Intracerebral hemorrhage-induced brain injury is aggravated in senescence-accelerated prone mice.Stroke,2006,37(1):216-222.
9 XI G H,HUA Y,RICHARD F K,et al.Systemic complement depletion diminishes perihematomal brain edema in rats.Stroke,2001,32(1):162-167.
10 Wang X,Liu J,Zhu H,et al.Effects of neuroglobin overexpression on acute brain injury and long-term outcomes after focal cerebral ischemia.Stroke,2008,39(6):1869-1874.
11 Sun Y,Jin K,Mao XO,et al.Neuroglobin is up-regulated by and protects neurons from hypoxic-ischemic injury.Proc Natl Acad Sci U S A,2001,98(26):15306-15311.
12 Conture M.Bumester T,Hankeln T,et al.The heme environment of mouse neuroglobin.Evidence for presence of two conformations of the heme pocket.J Biol Chem,2001,276(39):36377-36382.
13 Mattson MP,Lovell MA,Furukawa K,et al.Neurotrophic factors attenuate glutamate-induced accumulation of peroxides,elevation of intracellular Ca2+concentration,and neurotoxicity and increase antioxidant enzyme activities in hippocampal neurons.J Neurochem,1995,65(4):1740-1751.14 Kiprianova I,Freiman TM,Desiderato S,et al.Brain-derived neurotrophic factor prevents neuronal death and glial activation after globalischemia in the rat.J Neurosci Res,1999,56(1):21-27.

