LDL⁃R基因多态性与丙型肝炎易感性的相关性分析
张青杨,金丹宁,金国江,康辉,尚红
(中国医科大学附属第一医院检验科,沈阳110001)
LDL⁃R基因多态性与丙型肝炎易感性的相关性分析
张青杨,金丹宁,金国江,康辉,尚红
(中国医科大学附属第一医院检验科,沈阳110001)
目的探讨低密度脂蛋白受体(LDL-R)基因rs688 C/T、rs5925 C/T单核苷酸多态性(SNP)与丙型肝炎易感性之间的相关性。方法采用聚合酶链式反应(PCR)结合高分辨率熔解曲线(HRM-PCR)的方法,对179例丙型肝炎病毒(HCV)感染者和178名体检健康者或无病毒性肝炎史的其他疾病患者基因rs688和rs5929两个位点的单核苷酸多态性进行检测。结果在HCV感染组和未感染HCV对照组之间,LDL-RSNP中rs688和rs5925分布差异无统计学意义(P>0.05)。结论rs688和rs5925这两个多态性位点可能与丙型肝炎感染无相关性。
低密度脂蛋白受体;基因多态性;高分辨率熔解曲线;聚合酶链式反应;丙型肝炎
丙型肝炎是由丙型肝炎病毒(hepatitis C virus,HCV)感染引起的主要经血液传播的一种肝脏疾病,目前全球有1.3~1.5亿感染者,且丙型肝炎起病隐匿,慢性化率高达55%~85%,与肝硬化、肝细胞癌等密切相关[1]。研究表明,HCV感染后,无论是肝脏的损伤程度,发展成肝硬化或肝细胞癌的进程还是对药物的治疗反应,个体差异均很大[2,3],说明宿主的遗传因素,如单核苷酸多态性(single nucleotide polymorphism,SNP)等对于丙型肝炎的临床表现及疾病进展起到重要的作用[4]。低密度脂蛋白受体(low density lipoprotein receptor,LDL-R)是HCV主要膜蛋白受体,其编码基因位于人类第19号染色体短臂末端(p13.1~13.3)[5~7],与CD81以及EGFR等细胞因子共同作用,使HCV进入人体细胞内并发生作用[8,9]。LDL-R基因多态性可引起LDL-R的功能变化[10],而这种功能变化与丙型肝炎发病的相关性目前研究较少。
本研究采用高分辨率熔解曲线结合聚合酶链式反应(high resolution melt-polymerase chain reaction,HRM-PCR)的方法对LDL-RSNP进行分析,获得LDL-R基因rs688 C/T、rs5925 C/T SNP在中国东北地区人群中的分布情况,旨在探索LDL-R基因rs688 C/T、rs5925 C/T SNP与丙型肝炎易感性之间的相关性,为及早发现易感人群为实施更为积极有效的防护措施、防治HCV感染的发生提供帮助。
1 材料与方法
1.1 研究对象
丙型肝炎组:选取2011年11月至2012年11月在本院就诊的丙型肝炎患者179例,纳入标准为抗-HCV阳性、HCV-RNA结果阳性且通过血清学检查排除其他肝炎病毒感染、未接受治疗的丙型肝炎患者,其中男性106例(59.4%),女性73例(40.6%),年龄范围20~84岁,平均年龄(53.77±12.93)岁。正常对照组:选取本院同期的体检健康者或无病毒性肝炎史的其他疾病患者178例,其中男性97例(54.5%),女性81例(45.5%),年龄范围24~76岁,平均年龄(50.58±14.99)岁。丙型肝炎组和正常对照组在性别和年龄构成上差异均无统计学意义(分别为P=0.99和P=0.21)。
所有研究对象均知情同意,且均无I型糖尿病、多发性硬化症、类风湿性关节炎等疾病史。
1.2 方法
1.2.1 基因组DNA的提取:采用QIAGEN公司QIAamp®DNA Micro Kit进行外周血基因组DNA提取,具体操作步骤按照其说明书进行。用核酸定量仪测定DNA浓度及纯度,并冻存于-80℃备用。
1.2.2LDL-R基因SNP的检测:采用HRM-PCR结合混样法对研究对象LDL-R基因rs688和rs5925进行检测。
应用PREMIER5.O软件进行引物设计,并由上海生工生物工程有限公司合成。引物设计原则为确保引物的退火温度在55~60℃左右,并且扩增产物尽可能短(100~150)bp。引物及扩增产物信息见表1。
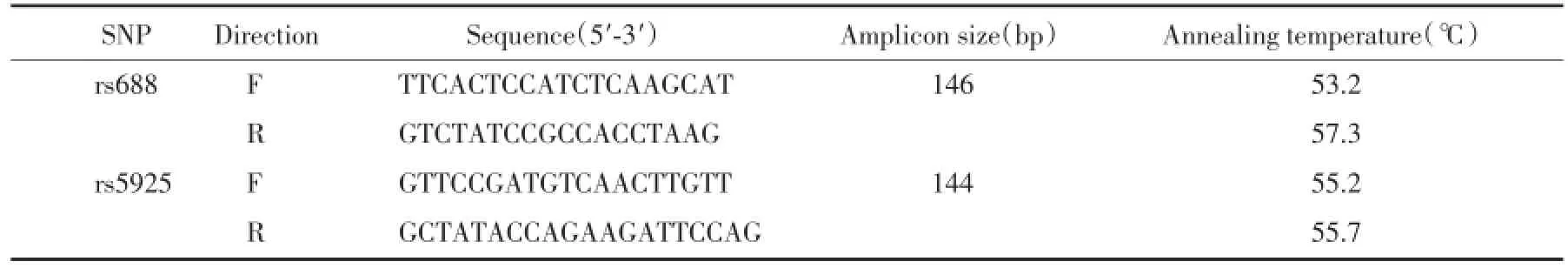
表1 PCR引物序列及扩增产物大小Tab.1 Polymerase chain reaction primers and amplicons
PCR反应体系:LightCycler®480 High Resolution Melting Master Mix(内含PCR反应缓冲液、dNTP、FastStart Taq DNA酶和HRM染料),10 mmol/L dNTP液0.2 μL、TaqDNA聚合酶0.2 μL、10×PCR缓冲液1μL、引物各0.1 μL、LCGreen PLUS饱和荧光染料1μL,模板1μL,加灭菌去离子水至10 μL。
标准品的制备及HRM-PCR反应条件:标准品由前期直接测序获得。PCR反应条件:95℃预变性5 min、95℃变性10 s、55℃退火延伸30 s共50个循环。在进行HRM分析之前,进行变性和复性处理:95℃30 s,60℃10 s。HRM过程从65℃开始,以0.02℃/s的斜率采集溶解曲线,到95℃结束,并在LightCycler480基因扫描软件模块上进行分析。每次反应均需将已知基因型的标准品与待测样本同时进行检测。根据HRM曲线的形状判断基因型,与标准品曲线形状相同者被认定为与标准品基因型相同,从而获得未知待测样品的基因型。
1.2.3 测序验证
为证实HRM-PCR结果的准确性,随机抽取40份PCR产物进行测序,由上海生工生物工程有限公司完成。
1.3 统计学分析
SNP的基因型频率和等位基因频率通过计数得到。运用Haploview4.0软件进行Hardy-Weinberg平衡检验。采用SPSS 17.0软件进行统计学分析:组间等位基因频率和基因型分布差异采用卡方检验;多态性位点与丙型肝炎患病风险之间的相关性用比值比(odds ratio,OR)及其95%可信区间(CI)表示。所有统计检验均为双侧概率检验,P<0.05为差异有统计学意义。
2 结果
2.1LDL-R基因SNP的筛查
应用HRM-PCR结合混样法成功获得所有待测标本LDL-R基因rs688和rs5925 SNP的基因分型。HRM-PCR结果用差异视图显示,见图1。
2.2 遗传平衡检验
为检验本研究人群LDL-R基因rs688和rs5925基因型频率是否具有群体代表性,将丙型肝炎组及正常对照组人群的基因型频率分别进行遗传平衡检验,χ2检验结果显示观察值和期望值均温和良好(rs688:丙型肝炎组χ2=0.486,P=0.486;正常对照组χ2=0.052,P=0.819;rs5925:丙型肝炎组χ2=0.502,P= 0.479;正常对照组χ2=0.040,P=0.842),符合Hardy-Weinberg遗传平衡定律,证明本研究人群已达到遗传平衡,具有群体代表性(表2)。
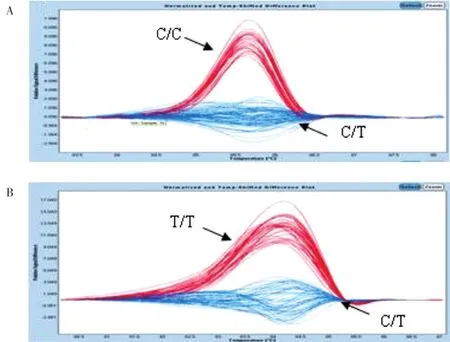
图1 LDL⁃R基因SNP的HRM⁃PCR分型结果Fig.1 Genotyping results using HRM⁃PCR of LDL⁃R SNPs

表2 研究群体的遗传平衡检验Tab.2 Genetic research groups balancing test
2.3 对照人群及丙型肝炎人群LDL-R基因SNP分布
本研究中,对照人群LDL-R基因rs688位点CC、CT、TT 3种基因型分布频率分别为70.8%、27.0%和2.2%,而等位基因C的频率为84.3%,等位基因T的频率为15.7%;rs5925位点TT、CT、CC 3种基因型分布频率分别为61.2%、33.7%和5.1%,等位基因T的频率为78.1%,等位基因C的频率为21.9%(表3)。
丙型肝炎人群LDL-R基因rs688位点CC、CT、TT 3种基因型分布频率分别为76.5%、21.2%和2.2%,而等位基因C的频率为87.2%,等位基因T的频率为12.8%;rs5925位点TT、CT、CC 3种基因型分布频率分别为64.8%、32.4%和2.8%,等位基因T的频率为81.0%,等位基因C的频率为19.0%(表3)。
2.4LDL-R基因SNP位点基因型与丙型肝炎发病风险的关系
丙型肝炎组rs688和rs5925两个位点各基因型分布频率均与正常对照组无明显差异(rs688:χ2= 1.52,P>0.05;rs5925:χ2=0.488,P>0.05)。rs688位点CC基因型与丙型肝炎发病之间的联系强度为1.35(95%CI:0.839~2.161);rs5925位点TT基因型与丙型肝炎发病之间的联系强度为1.17(95%CI:0.758~1.792),见表3。
2.5LDL-R基因SNP位点等位基因与丙型肝炎发病风险的关系
丙型肝炎组rs688和rs5925两个位点等位基因频率均与正常对照组无明显差异(均为P>0.05)。进一步分析LDL-R基因多态性对丙型肝炎发病风险的影响发现,rs688位点上的C等位基因与丙型肝炎发病之间的联系强度为1.29(95%CI:0.832~1.990);而rs5925位点上T等位基因与丙型肝炎发病之间的联系强度为1.13(95%CI:0.771~1.643),见表3。

表3 正常对照组与丙型肝炎组LDL⁃R基因SNP基因型和等位基因频率的比较Tab.3 Genotype and allele frequencies of the LDL⁃R SNPs in the HCV⁃infected and control groups
3 讨论
感染HCV后,有约15%~45%的患者可以自限清除病毒,其他则发展为持续感染[1]。即使感染同一亚型的病毒,不同个体的病情轻重与转归亦存在差异。因此宿主遗传因素在HCV感染的发生和发展过程中起着重要作用[2,3]。近年来对HCV感染细胞和机体的研究发现,HCV感染与脂蛋白转运系统有着密切联系[4~9]。LDL-R基因位于人类第19号染色体短臂末端(p13.1~13.3),全长45 kb,编码860个氨基酸的受体前体蛋白,由18个外显子和17个内含子组成[5~7]。LDL-R是一种细胞表面糖蛋白,以肝细胞含量最多。大量研究证实,LDL-R是HCV及其他黄病毒属的主要细胞膜受体[8]。HCV病毒进入细胞的量与LDL-R的表达相关,HCV的入胞作用依赖于HCV与LDL-R的相互作用,同时血清中含HCV RNA的物质的密度异质性与HCV和低密度脂蛋白(LDL)的结合有关。体内LDL-R是介导HCV-VLDL/ LDL复合体胞饮作用的受体,HCV与某种脂蛋白配基结合形成复合物后通过LDL-R介导进入肝细胞,其产物与肝细胞中合成的载脂蛋白相互作用影响脂肪代谢,形成脂肪肝等病理表现[9]。利用LDL-R可能是HCV的受体这一概念,在制作HCV感染体外模型时用美降脂诱导LDL-R的产生,使得所用细胞长期释放HCV达130 d,所得结论支持体外LDLR介导HCV进入细胞的假说[8]。
LDL-R的SNP种类比较多,多数与脂蛋白代谢异常有关[11]。其中,LDL-R基因上rs688和rs5925为比较值得研究的多态性位点,近些年,国内外已经对于这两个位点进行了一定的研究。2007年,Haiyan等[12]发现rs688为位于LDL-R外显子12(Exon12)上的位点。Gabriella在2009年对中国上海人群中血清血脂水平的基因决定性研究中表明,在该人群中的rs688等位基因携带者具有典型的高血清甘油三酯水平[13]。2010年Martinelli[14]在研究中指出,在包括血浆脂类等传统心血管危险因素的调整后,rs688保持对冠状动脉硬化的相关性。2012年,Lee等[15]在进行台湾地区的缺血性脑血管病相关研究时发现,LDL-R中rs5925的基因多态性与脑梗死具有相关性。2013年研究发现,rs688、rs5925等位基因与冠状动脉疾病有联系,当rs688从野生型的TCAACG到多态型的TCAATG改变,会使缺血性脑血管病风险增加[16]。目前,LDL-R的SNP是否与HCV有关,国内外的研究尚未完善,因此是一个值得深入探讨的问题。
正常人群中,LDL-R的SNP基因型和等位基因频率分布如表1所示。rs688位点的主要基因型为CC型,少数等位基因为T;rs5925位点主要基因型为TT型,少数等位基因为C,虽然同人群该位点的SNP分布尚未见报道,但本实验数据与dbSNP数据库中(http://www.ncbi.nlm.nih.gov/projects/SNP)中国北京汉族人群分布一致。
本次实验研究结果显示,正常对照组与丙型肝炎组相比,LDL-R上两个基因位点rs688和rs5925基因型分布情况以及等位基因分布情况的差异均无统计学意义(P>0.05)。因此,研究结果提示虽然LDL-R是HCV感染细胞的重要受体,rs688和rs5925对于血脂水平的升高以及缺血性脑血管病存在一定的影响,并且是相对活跃的位点,但是rs688和rs5925两个位点的SNP与丙型肝炎易感性之间并不具有相关性。鉴于本研究人群局限于中国东北地区汉族人群,有可能导致该结果并不适用于其他人群;其次,对于所研究的两个位点的SNP是否进一步参与了丙型肝炎的发生发展等问题,仍需进一步研究;同时,对于在LDL-R基因中的其他位点是否存在影响LDL-R一级结构并与HCV感染有关的多态性等都需进一步研究
综上所述,中国东北地区汉族人群中LDL-R基因rs688和rs5925 SNP与丙型肝炎易感性无相关性。丙型肝炎是受病毒感染和宿主基因调控、免疫应答等共同作用的复杂过程,LDL-R基因多态性影响丙型肝炎发病的作用机制及其地域分布特点等仍需进一步研究。
[1]World Health Organization.Hepatitis C 2014,http://www.who.int/ mediacentre/factsheets/fs164/zh.2014.
[2]中华医学会肝病学分会,中华医学会传染病与寄生虫病学分会.丙型肝炎防治指南[J].中华内科杂志,2004,43(7):551-555.
[3]European Association for the Study of the Liver.EASL Clinical Practice Guidelines:management of hepatitis C virus infection[J].J Hepatol,2011,55(2):245-264.
[4]李晗,刘正稳,韩群英,等.低密度值蛋白受体基因多态性及其与慢性丙型肝炎的相关性[J].中国药物与临床,2006,6(2):88-91.
[5]Huang H,Sun.F,Owen D,et al.Hepatitis C virus production by human hepatocytes dependent on assembly and secretion of very lowdensity lipoproteins[J].Proc Natl Acad Sci USA,2007,104(14):5848-5853.
[6]Molina S,Castet V,Foumier-Wirth C,et al.The low-density lipoprotein receptor plays a role in the infection of primary human hepatocytes by hepatitis C virus[J].J Hepatol,2007,46(3):411-419.
[7]Cargill M,Altshuler D,Ireland J,et al.Characterization of singlenucleotide polymorphisms in coding regions of human genes[J].Nat Genet,1999,22(3):231-238.
[8]钟劲.丙型肝炎病毒实验模型和分子病毒学的研究进展[J].中华肝脏病杂志,2009,17(7):494-496.
[9]朱震宇,张绍庚,王继涛,等.HCV入胞相关受体的研究进展[J].中华临床医师杂志,2013,7(11):4989-4991.
[10]Gao F,Thn HE,Medina MW,et al.A common polymorphism in the LDL receptor gene has multiple effects on LDL receptor function[J].Hum Molec Gene,2013,22(7):1424-1431.
[11]罗显云,姚震,王天松,等.LDLR基因多态性与心脑血管疾病的相关性研究进展[J].热带医学杂志,2012,12(6):779-781.
[12]Zhu H,Tucker HM,Grear KE,et al.A common polymorphism decreases low-density lipoprotein receptor exon 12 splicing efficiency and associates with increased cholesterol[J].Hum Mol Genet,2007,16(14):1765-1772.
[13]Andreotti G,Menashe I,Chen J,et al.Genetic determinants of serum lipid levels in Chinese subjects:A population-based study in Shanghai,China[J].Eur J Epidemiol,2009,24(12):763-774.
[14]Martinelli N,Girelli D,Lunghi B,et al.Polymorphisms at LDLR locus may be associated with coronary artery disease through modulation of coagulation factorⅧactivity and independently from lipid profile[J].Blood,2010,116(25):5688-5697.
[15]Lee JD,Lee TH,Kuo YW,et al.Polymorphisms at the LDLR locus may be associated with ischemic cerebrovascular disease independent of lipid profile[J].Curr Neurovasc Res,2012,9(3):200-206.
[16]苏晓,郑伟.低密度脂蛋白受体、脂蛋白脂酶基因多态性在缺血性脑血管病发病机制中作用的研究进展[J].国际检验医学杂志,2013,34(20):2716-2718.
(编辑 裘孝琦)
Correlation Analysis Between LDL-R SNPand Susceptibility to Hepatitis CVirus
ZHANGQing-yang,JIN Dan-ning,JINGuo-jiang,KANG Hui,SHANGHong
(DepartmentofLaboratory Medicine,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo study the relationship of rs688 C/T and rs5925 C/TofLDL-RSNP to hepatitis C.MethodsHigh resolution melt-polymerase chain reaction(HRM-PCR)method was employed to detect rs688 and rs5925 of theLDL-Rgene in 179 patients infected with HCV and 178 healthy individualsorthese infected with otherdisease exceptHCVas the healthy controlgroup.ResultsThere was no statisticalsignificantdifferences in rs688 and rs5925 ofLDL-Rgene between 179 patients infected with HCV and healthy controls(P>0.05).ConclusionThere are rs688 and rs5925 ofLDL-RSNP in Chines population,butitmay notbe involved in the infection ofHCV.
LDL-R;single nucleotide polymorphism;high resolution melt;polymerase chain reaction;hepatitis C
R512.6
A
0258-4646(2014)12-1109-05
教育部高等学校博士学科点专项科研基金(20112104110001)
张青杨(1986-)男,技师,本科.
康辉,E-mail:kanghui65@sina.com
2014-09-19
网络出版时间:

