虫草菌丝对IL-1β诱导MIN6细胞凋亡的保护作用与机制的实验研究
郑 倩,刘 华,曹弟勇,杨尚君,赵小蓉,米贵飞,赵雅茜,肖昊卓
(川北医学院 1.机能实验中心;2.药理学教研室;3.寄生虫学教研室;4.2012级临床医学系,四川 南充 637100)
研究证实IL-1β是重要的内源性细胞因子,其可通过影响NO[1]、Ca2+[2]、线粒体膜电位、ROS[3]以及内质网应激[4]多种途径导致细胞凋亡,最终导致糖尿病。虫草菌丝(cordyceps sinensis,CS)是人工发酵培养得到的菌丝,近年来其对糖尿病的防治作用受到了广泛关注,我们前期工作采用IL-1β损伤离体乳鼠胰岛细胞并用CS进行干预,发现CS可以增加乳鼠胰岛细胞活性和分泌功能,其保护机制与降低细胞内Ca2+浓度,降低NO、ROS的生成以及提高SOD、GSH-PX的活性有关[5-6]。目前国内外的研究证实解偶联蛋白2(uncoupling protein 2,UCP-2)可以通过影响ATP的生成、调节胰岛素的分泌,抑制细胞活性氧(reactive oxygen species,ROS)的生成,诱发胰岛细胞的凋亡参与糖尿病的发生发展过程,成为了研究的热点。本研究探讨CS对IL-1β诱导的MIN6细胞凋亡的作用以及机制是否与ROS水平和UCP-2表达有关。
1 材料和方法
1.1 主要试剂与仪器
MIN6细胞购自上海拜力公司,CS(上海雅吉,A-0159),IL-1β(invitrogen,792008D),高糖DEEM,胎牛血清(hyclone,nzk0677),Hochest33342,Annexin V-FITC凋亡检测试剂盒(Beyotime,C1056),活性氧检测试剂盒(南京建成,A087)。荧光显微镜(Leica,德国),荧光分光光度计(BIO-RAD,美国),酶标仪(BIO-RAD,美国),流式细胞仪(Acuuri,美国)。
1.2 方法
1.2.1 细胞培养与处理 选用第28~35代MIN6细胞为研究对象,MIN6细胞在含150 mL/L FBS、青、链霉素各10 U/mL的DMEM培养基中,于37 ℃、5% CO2饱和湿度条件下培养。每2~3 d换液1次,5~6 d传代1次,80%汇合时进行实验。以每孔5×105mL/L细胞接种于细胞培养板,培养24 h后,进行实验分组。随机分组:(1)正常对照组;(2)IL-1β(20 nmol/L)组;(3)IL-1β+低剂量CS1组;(4)IL-1β+高剂量CS2组,每组平行孔为6孔。正常对照组以含15%胎牛血清的RPMI-1640培养液培养,(2)~(4)组每孔细胞中各加入20 nmol/L的IL-1β作用24 h后,再分别加入不同浓度的CS(CS1:1 mmol·L-1,CS2:5 mmol·L-1)继续培养24 h,进行各项检测。
1.2.2 CCK8检测细胞活性 将处理完毕的各组细胞用CCK8法进行检测。方法如下:将96孔细胞培养板离心(500 r/min×5 min),然后吸取细胞培养上清液,于细胞中加200 μL的培养液(不含小牛血清)和20 μL的CCK8,放入CO2孵育箱培养1 h后,在全自动酶标仪上比色,测出每孔光密度值(OD值)进行比较,检测波长为450 nm,OD值越高表明细胞活性就越强。
1.2.3 胰岛素分泌量测定 各组待测标本细胞培养上清液,用Elisa试剂盒检测胰岛素的基础分泌量;各组细胞中加入含16.7 mmol·L-1的葡萄糖培养液培养2 h,离心提取上清液,按Elisa进行高糖刺激胰岛素分泌量检测。
1.2.4 Hochest33258染色检测细胞凋亡 将10 μL Hochest33258加入培养的细胞中,终浓度为10 μg/mL,37 ℃孵育15 min,收集细胞,制成细胞爬片,荧光显微镜下观察细胞核,了解细胞凋亡情况。
1.2.5 流式细胞仪检测细胞凋亡 每个样品收集约5×105mL/L细胞于1.5 mL离心管内,离心弃上清。细胞沉淀用1 mL细胞染色缓冲液重悬,加入5 μL Annexin V-FIT和5 μL PI染色液,混匀,室温避光孵育20 min,在1 h内流式细胞仪检测红色荧光和蓝色荧光。Annexin V-FITC+PI-象限为凋亡早期细胞;Annexin V-FITC-PI+为坏死细胞;Annexin V-FITC+PI+为凋亡晚期坏死细胞;Annexin V-FITC-PI-为活细胞。
1.2.6 Western blot检测UCP-2蛋白含量 收集培养细胞,离心去除培养液,用PBS、生理盐水或无血清培养液洗2~3遍,用手指把细胞用力弹散,按每管细胞加入200 μL的比例加入裂解液,同时加入PMSF。用手指轻弹管底以促使裂解液和细胞充分接触,用考马斯亮蓝法测定各细胞样本蛋白含量。SDS-PAGE电泳半干转法将蛋白质转移到硝酸纤维素膜上,恒压电泳,将电压调至80 V使样品通过浓缩胶与分离胶(电压约8 V/cm)。电泳使染料至分离胶适当位置,结束电泳。室温封闭1 h,将一抗用封闭液稀释(UCP-2抗体稀释度均为1∶300,内参抗体稀释度为1∶1 000);将封闭后的膜直接放入一抗工作液中,4 ℃反应过夜;将洗涤后的一抗反应膜放入二抗工作液(1∶3 000)中,室温、避光缓慢摇动作用60 min;用1×TBST洗膜,曝光及洗片。用image J软件分析灰度值。
1.3 统计学分析
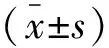
2 结果
2.1 胰岛细胞活性的变化
与正常组对照组相比,IL-1β组光密度值OD值明显降低,表明胰岛细胞活性显著下降(P<0.01);加入低浓度和高浓度CS共同孵育可使OD值较损伤组均有不同程度的提高,具有显著意义(P<0.05,P<0.01),且有剂量依赖性(表1)。
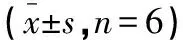
表1 各组细胞光密度,基础胰岛素和高糖刺激胰岛素分泌水平
*P<0.01,与对照组比较;#P<0.05,△P<0.01,与IL-1β组比较。
2.2 基础和高糖刺激胰岛素分泌量的测定
实验结果见表1,IL-1β作用后胰岛细胞胰岛素基础分泌量和葡萄糖刺激分泌量均显著下降(P<0.01),在IL-1β作用的基础上与不同浓度CS共同培养24 h后,细胞的分泌功能显著增强,表现为基础和高糖刺激的胰岛素分泌增多,有统计学意义(P<0.05,P<0.01)。
2.3 CS对MIN6细胞活性氧的含量的影响
IL-1β与胰岛细胞作用后ROS活性增加,与正常组相比差异显著(P<0.01)。与IL-1β组相比,经CS共同孵育后,ROS的活性明显降低,而且有剂量依赖性,高剂量组ROS的活性低于低剂量组,有统计学意义(P<0.05,P<0.01),实验结果见表2。
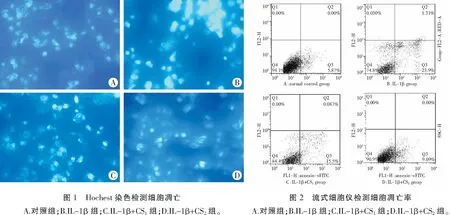
2.4 CS对MIN6细胞凋亡的影响
正常组细胞呈均一蓝色,且颜色偏浅。凋亡细胞细胞核呈致密浓染,亮度高,有的可见裂解的凋亡小体,IL-1β组凋亡细胞明显增多,与CS作用后凋亡细胞减少(图1)。采用流式细胞技术进行定量分析,检测结果显示对照组胰岛细胞凋亡率为5.03±0.78;加入IL-1β作用后胰岛细胞凋亡率显著增加为24.5±0.65(P<0.01);不同浓度CS作用均降低细胞凋亡率,高浓度CS作用后明显降低凋亡率至9.08±0.36(P<0.01),具有统计学意义(表2,图2)。
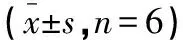
表2 细胞凋亡率、ROS和UCP-2蛋白的表达
*P<0.01,#P<0.001,与对照组比较;△P<0.05,▲P<0.01,□P<0.001,与IL-1β组比较。
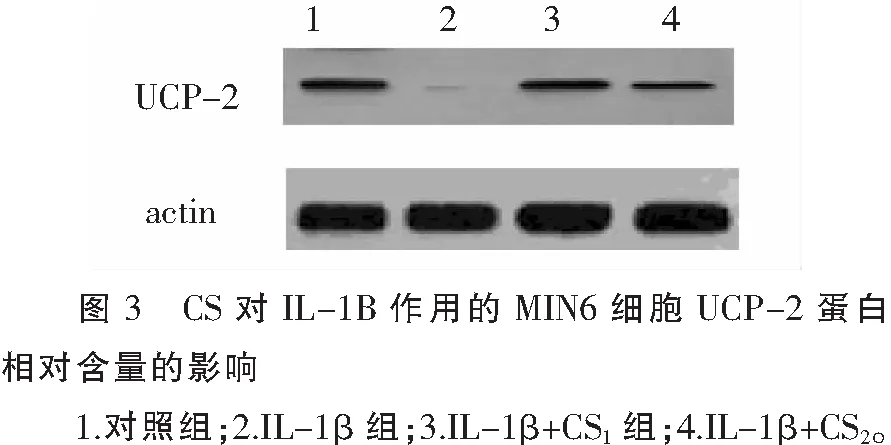
2.5 CS对IL-1β作用的MIN6细胞UCP-2蛋白相对含量的影响
由图3,表2可知,加入IL-1β作用后胰岛细胞UCP-2蛋白相对含量表达明显下调,与正常组相比有统计学意义(P<0.001);与不同浓度CS共同孵育后,UCP-2蛋白含量上调,高于IL-1β组,有统计学意义(P<0.01)。
3 讨论
MIN6细胞系是胰岛素启动子控制下表达SV40大T抗原的小鼠胰岛肿瘤的细胞系,葡萄糖刺激的胰岛素分泌强度与正常的胰岛β相似,因此常被用来研究胰岛β细胞的功能。本研究结果表明,IL-1β在体外环境能诱导MIN6细胞凋亡,通过荧光染色和流式细胞技术可以证实凋亡的存在。多项研究[7-9]表明,氧化应激是导致胰岛β细胞功能衰退的重要因素,ROS可直接损伤β细胞,特别是破坏细胞线粒体结构,促进β细胞凋亡。UCP-2是线粒体内膜上解偶联蛋白家族成员之一,其广泛存在脾脏、下丘脑、胰腺、心脏和肺等多种组织中,能通过质子漏作用,使线粒体内膜外的质子直接进入线粒体基质,降低了内膜两侧的质子电化学梯度,使氧化过程与二磷酸腺苷(adenosine diphosphate,ADP)磷酸化过程解偶联,从而使ATP合成减少,能量以热能的形式释放,同时由于内膜两侧质子电化学梯度降低,呼吸链上的电子回漏减少,使ROS生成减少。UCP-2可以通过降低ROS的生成降低凋亡的生成从而保护细胞功能。
有研究发现小鼠胰岛和INS-1E细胞系中有UCP-2的表达[10-11],本实验结果提示MIN6细胞亦有UCP-2的表达。IL-1β作用MIN6细胞后ROS明显增加,同时UCP-2的表达降低,证实IL-1β引起MIN6细胞凋亡途径与UCP-2蛋白表达降低,ROS水平增加有关。多篇文献报道IL-1β可以下调UCP-2的表达[12-13],与本研究类似,也有研究得到不同的结果,Luo[14]观察到IL-1β可以上调INS-1细胞中UCP-2的表达,可能与采用的细胞以及使用的剂量有关,值得进一步深入研究。
细胞凋亡在糖尿病的发生和发展中起着非常重要的作用,阻断胰岛细胞凋亡可降低糖尿病的发生,因此抑制凋亡的药物筛选成为研究的热点。
虫草菌丝是本课题组筛选的对胰岛细胞具有保护作用的药物,前期的研究证实虫草菌丝对IL-1β损伤的胰岛细胞有保护作用,其保护机制与降低NO和Ca2+浓度以及提高CO/HO系统活性有关,但是其对MIN6细胞凋亡的保护机制研究并未涉及。本实验证实,CS可以降低IL-1β诱导的MIN6胰岛细胞凋亡,凋亡率显著降低,同时细胞活性增强,胰岛素的分泌功能增加,说明其对IL-1β诱导的MIN6细胞凋亡有保护作用。并且通过Western Blot检测发现细胞UCP-2蛋白的表达增加,ROS水平降低,说明其降低凋亡保护细胞功能的机制可能与增加UCP-2的表达,降低ROS的生成有关,有效地清除自由基,改善氧化应激反应,减少胰岛细胞的氧化损伤。本研究为寻找2型糖尿病的中药治疗打下了理论基础,同时为2型糖尿病的治疗提供新的思路与临床用药筛选,不过CS对2型糖尿病的保护作用机制仍然需要进一步研究。
【参考文献】
[1]Tannous M,Amin R,Popoff MR,et al.Positive modulation by Ras of interleukin-1b-mediated nitric oxide generation in insulin-secreting clonal beta(HIT-T15)cells[J].Biochem Pharmacol,2001,62(11):1459-1468.
[2]Dula SB,Jecmenica M,Wu R,et al.Evidence that low-grade systemic inflammation can induce islet dysfunction as measured by impaired calcium handling[J].Cell Calcium,2010,48(2-3):133-142.
[3]Mbaya E,Oulès B,Caspersen C,et al.Calcium signaling-dependent mitochondrial dysfunction and bioenergetics regulation in respiratory chain complex II deficiency[J].Cell Death Differ,2010,17(12):1855-1866.
[4]Verma G,Bhatia H,Datta M.JNK1/2 regulates ER-mitochondrial Ca2+cross-talk during IL-1β-mediated cell death in RINm5F and human primary β-cells[J].Molecular Biology of the Cell,2013,24(12):2058-2071.
[5]郑 倩,刘 红,曹弟勇,等.虫草菌丝提取物对白介素1β损伤的胰岛细胞损伤保护作用的实验研究[J].中国中医基础医学杂志,2008,14(10):765-767.
[6]兰海涛,郑 倩,王亚平,等.血红素加氧酶/一氧化碳系统在百令胶囊水提物对抗STZ损伤大鼠胰岛细胞的作用[J].时珍国医国药,2010,21(4):891-893.
[7]Kajimoto Y,Kaneto H.Role of oxidative stress in pancreatic beta-cell dysfunction[J].Ann N Y Acad Sci,2004,1011:168-176.
[8]Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].Int J Biochem Cell Biol,2007,39(1):44-84.
[9]Drews G,Krippeit-Drews P,Dufer M.Oxidative stress and beta-cell dysfunction[J].Pflugers Arch,2010,460(4):703-718.
[10]Chan CB,MacDonald PE,Saleh MC,et al.Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets[J].Diabets,1999,48(7):1482-1486.
[11]Azzu V,Jastroch M,Divakaruni AS,et al.The regulation and turnover of mitochondrial uncoupling protein[J].Biochom Biophy Acta,2010,1797(6-7):785-791.
[12]Affoutti C,Brand MD.On the role of uncoupling protein-2 in pancreatic beta cell[J].Biochim Biophys Acta,2008,1777(7-8):973-979.
[13]Bordone L,Motta MC,Picard F,et al.Sirtl regulates insulin secretion by repressing UCP2 in pancreatic beta cells[J].Plos Biol,2006,4(2):e31.
[14]Luo JZ,Luo L.American Ginseng stimulates insulin production and prevents apoptosis through regulation of uncoupling protein-2 in cultured beta cells[J].Evid Based Complement Alternat Med,2006,3(3):365-372.

