性别差异对1型糖尿病大鼠造模的影响
赵圆宇,王艺蓉,徐彩婷,赵 丰,莫琳龙,胡林均,施 蕾,李生玉,卢营杰,陈科利,张露丹,马亚洪,谭 敏
(川北医学院组织学与胚胎学教研室,四川 南充 637100)
随着生活水平的提高,人们的营养状况和饮食结构有了大幅度的转变[1]:在营养不良的情况得到较大改善的同时,营养过剩及其带来的相关疾病成为新的课题。2013年,全球范围内约有3.82亿人患糖尿病,占世界成人总人口的8.3%[2-3]。糖尿病(diabetes mellitus,DM)已成为继心血管疾病和肿瘤之后的第三大非传染性疾病[4],严重危害人类健康,但糖尿病的发病机制及其并发症尚未完全阐明。因此选取正确的糖尿病动物模型对研究糖尿病发病机制及其并发症具有重要的意义。
链脲佐菌素(streptozotocin,STZ)对胰岛β细胞具有选择性毒性,是公认的糖尿病动物模型造模药物[5-6]。以往的研究显示:大鼠的品种、周龄、STZ剂量等因素直接影响造模的结果[7-9]。王晓琳等人的研究表明:雌性Wistar大鼠可以利用25 mg/kg STZ加膳食诱导方法建立2型糖尿病模型,而雄鼠不能[10]。此外,有报道表明雌激素对糖尿病病程的发展有延缓作用[11],且在糖尿病模型中发现雄性鼠的糖代谢紊乱程度大于雌性鼠[12]。近年来越来越多的专家提出动物性别也是影响造模的重要因素之一。但大多数研究人员仅采用雄性大鼠来研究糖尿病的发病机制及其并发症,不能准确区分雌雄大鼠性别差异对STZ成模鼠发病机制及并发症的影响。为明确性别因素对糖尿病大鼠造模的影响,本实验采用同一批次的雌性和雄性SD大鼠,60 mg/kg一次性腹腔注射诱导建立1型糖尿病大鼠模型[13-14],探究在相同高剂量STZ作用下,雌雄大鼠性别背景差异对造模成模率以及成模后死亡率的影响。
1 材料与方法
1.1 实验动物及分组
SPF级成年健康SD大鼠118只,4月龄,雌、雄各60只,体质量为210~280 g。由川北医学院动物研究所提供(动物合格证号SYXK(川)2013-076)。选择符合模型纳入标准的动物分组进行实验,雌、雄性大鼠分别随机分为雄性对照组(13只),雄性STZ注射组(46只),雌性对照组(13只),雌性STZ注射组(46只)。所有动物均喂养于川北医学院动物研究所提供的SPF级动物实验室,实验前动物适应性饲养3 d。各组大鼠实验期间均用标准颗粒饲料、标准笼喂养,高压灭菌自来水自由饮用。自然昼夜照明,室内通风良好,氨浓度<20 ppm,相对湿度为45%~65%,室温保持在20~25 ℃。
1.2 造模方法
将STZ以0.1 mol/L(pH=4.2)的枸橼酸-枸橼酸钠缓冲液溶解。STZ注射组按60 mg/kg一次性腹腔内注射,对照组一次性腹腔内注射等量缓冲液。部分动物STZ注射一周内出现死亡:雌性大鼠死亡5只,雄性大鼠死亡2只。STZ注射前、STZ注射后7 d和49 d动物禁食、不禁水8 h,称重后剪尾取血,用血糖仪及配套试纸检测其血糖值。空腹血糖≥16.7 mmol/L作为模型纳入标准[15-16]。记录并统计死亡动物数。
1.3 统计学分析
采用SPSS 19.0统计软件,体质量以SD表示。模型对照组与给药组间的比较采用方差分析,方差分析有意义时采用LSD法进行组间两两比较;方差齐性检验(P<0.05)时,采用单因素方差分析。
2 结果
2.1 一般状况
造模早期大鼠基本状态较好,皮毛较清洁,活动正常。随着病程进展,成模组大鼠逐渐出现多饮、多尿、多食、消瘦、皮毛失去光泽、脱毛、活动减少和伤口易感染等表现,部分成模大鼠有血尿出现。
2.2 各组大鼠体质量的变化
实验初期成模组大鼠体质量随病程发展逐渐降低,但随着动物月龄增长,体重有所回升,但成模组大鼠与同月龄对照组大鼠体质量的差距逐渐增大。与对照组相比,雌性成模组大鼠体质量差异无统计学意义(P>0.05);与对照组相比,雄性成模组大鼠体质量差异无统计学意义(P>0.05)。与雌性对照组大鼠和成模组大鼠相比,雄性对照组和成模组大鼠体质量均显著高于雌性(P<0.05)。见表1。
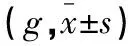
表1 STZ注射前后大鼠体质量的变化
*P<0.05,与雌性组大鼠比较。
2.3 各组大鼠血糖值变化
与对照组相比,雌性、雄性成模组大鼠STZ注射后1周空腹血糖值均显著升高(P<0.05),并在整个观察期间维持于较高水平。与雌性成模组大鼠相比,雄性成模组大鼠空腹血糖值差异无统计学意义(P>0.05)。结果见表2。
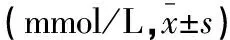
表2 STZ注射前、后大鼠空腹血糖的变化
2.4 大鼠成模率及死亡率
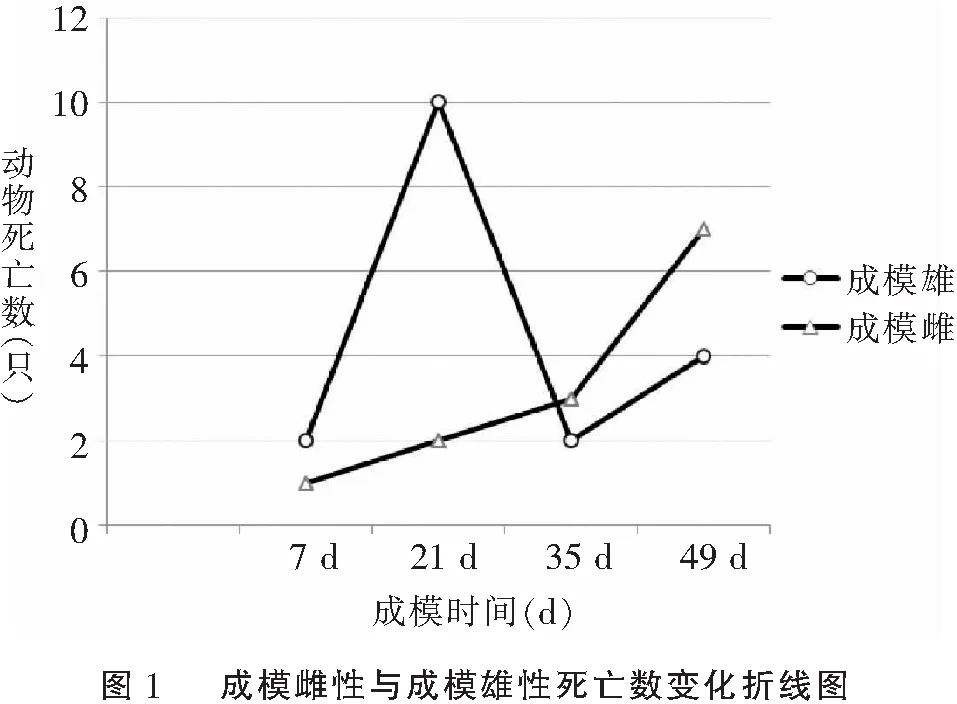
雄性STZ注射组成模31只,成模率为67.4%;雌性STZ注射组成模35只,成模率为76%。与雌性STZ注射组相比,雄性STZ注射组成模率无显著性改变(表2);与雌性成模组大鼠相比,雄性成模组大鼠死亡率显著性增加。雌性成模组死亡率峰值为成模后第7周,而雄性成模组死亡率峰值为成模后第3周(表3,图2)。

表3 雌、雄大鼠STZ注射组成模率统计表
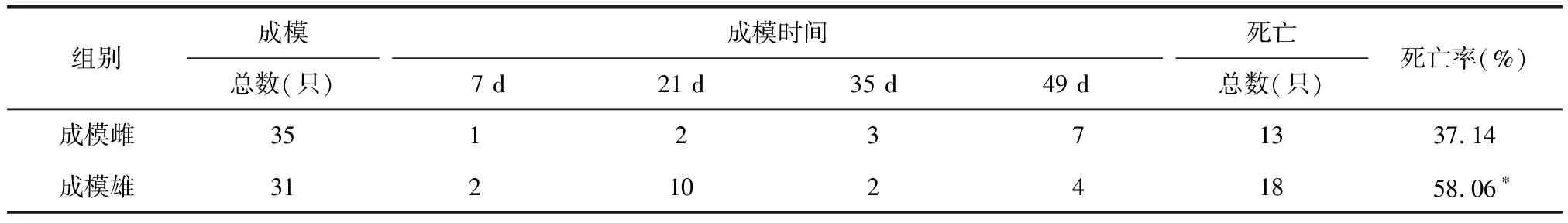
表4 成模组大鼠死亡数及死亡率
*P<0.05,与雌性组大鼠比较。
3 讨论
本实验选取4月龄雌性和雄性SD大鼠,一次性腹腔注射60 mg/kg STZ造模,一周后检测空腹血糖值,空腹血糖值>16.7 mmol/L为达到糖尿病的诊断标准。模型组大鼠空腹血糖显著高于对照组(P<0.05),摄食量及摄水量较对照组大鼠显著增加,符合1型糖尿病发病症状。本研究结果显示,雄性成模组较雌性成模组造模成模率无明显差异,这与临床调查的男性、女性糖尿病发病率一致[17]。
而在造模成功后短时间内雄性大鼠死亡率明显高于雌性大鼠,随实验时间延长,雌性大鼠的死亡率升高,在第7周时其死亡率甚至高于雄鼠。王晓琳等人的研究表明:利用Wistar大鼠25 mg/kg STZ加膳食诱导方法建立2型糖尿病模型,与雌性大鼠相比,雄性大鼠血液内甘油三酯浓度水平显著增高,而胰岛素水平显著降低;以罗格列酮为阳性药物,罗格列酮高剂量组雌性大鼠空腹血糖水平给药4周较给药前显著下降(P<0.05),而雄性各组大鼠给药前后空腹血糖水平差异无统计学意义(P>0.05)[10]。据此我们推测在糖尿病的病程发展中,由于糖尿病大鼠的疾病进程、代谢及发病机制存在性别差异,因此雌、雄大鼠对糖尿病疾病的耐受程度存在差异。由于雌激素可能在一定程度上存在延缓糖尿病病程的作用,因此与雌性大鼠相比较,雄性大鼠较早出现死亡;尽管雌鼠体内的雌激素可延缓糖尿病病程的发展,但由于耐受程度有限,当病程缓慢发展至超出雌性大鼠的耐受限度,则雌性大鼠出现死亡峰值。此外,在整个实验过程中雄性大鼠的死亡率明显高于雌性大鼠,雄性成模组大鼠体重较雌性成模组大鼠明显偏低,毛色及毛密度不如雌性成模组,精神状态较雌性成模组差,也说明了糖尿病病程发展具有性别差异。
综上所述,本研究发现大鼠性别因素对一次性大剂量STZ诱导建立1型糖尿病模型的成模率无显著影响,而成模后的死亡率有显著影响,说明糖尿病的病程进展、发病机制及其并发症可能具有性别差异。因此,在糖尿病疾病进展、发病机制以及糖尿病并发症等相关的研究中,应考虑性别对研究结果的影响,从而选择双性别动物模型进行研究。
【参考文献】
[1]张 峁,王 青,杨 帆.改革开放30年政府支出对城乡居民生活水平影响效应分析—基于TVP模型的实证研究[J].经济与管理研究,2010,7(4):15-23.
[2]Shlomo M,Kenneth SP,Reed L,et al.Henry M.Kronenberg,MDWilliams textbook of endocrinology(12th ed.)[M].Philadelphia:Elsevier/Saunders,2011.1371-1435.
[3]Shi Y,Hu FB.The global implications of diabetes and cancer[J].Lancet,2014,383(9933):1947-1948.
[4]代庆红,王忠东.中国糖尿病的现状调查[J].中国医药指南,2011,9(13):206-208.
[5]Rossini AA,Like AA,Chick WL,et al.Studies of streptozotocin-induced insulitis and diabetes[J].Proc Natl Acad Sci USA,1977,74(6):2485-2489.
[6]Mansford KR,Opie L.Comparison of metabolic abnormalities in diabetes mellitus induced by streptozotocin or by alloxan[J].Lancet,1968,1(7544):670-671.
[7]陈 静,冯 波,王 成,等.大鼠体质量对1型糖尿病造模成功率的影响[J].现代医药卫生,2014,30(5):670-671.
[8]张巨彪,苏秀兰,欧阳晓辉.1型糖尿病大鼠模型的建立及观察[J].医学综述,2013,19(2):335-337.
[9]农 慧,盛庆寿,梁 健,等.STZ诱导糖尿病大鼠模型的研究[J].广西医科大学学报,2010,27(1):69-71.
[10]王晓琳,邱宗荫,夏永鹏.性别差异对实验性链脲佐菌素糖尿病大鼠造模的影响[J].第三军医大学学报,2009,31(17):1668-1671.
[11]Bhattacharya S,Bank S,Maiti S,et al.The Control of Hyperglycemia by Estriol and Progesterone in Alloxan induced Type I Diabetes Mellitus Mice Model through Hepatic Insulin Synthesis[J].Int J Biomed Sci,2014,10(1):8-15.
[12]Rossini AA,Williams RM,Appel MC,et al.Sex differences in the multiple-dose streptozotocin model of diabetes[J].Endocrinology,1978,103(4):1518-1520.
[13]Szkudelski T.The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas[J].Physiol Res,2001,50(6):537-546.
[14]Matteucci E,Giampietro O.Proposal open for discussion:defining agreed diagnostic procedures in experimental diabetes research[J].J Ethnopharmacol,2008,115(2):163-172.
[15]张芳林,李 果,刘优萍.2型糖尿病大鼠模型的建立及其糖代谢特征分析[J].中国实验动物学报,2002,10(1):18-22.
[16]邵伟娟,陶凌云,赵茹茜,等.不同剂量STZ诱导小鼠糖尿病模型及生殖能力的研究[J].上海交通大学学报,2007,25(6):541-546.
[17]Vos T,Flaxman AD,Naghavi M,et al.Years lived with disability(YLDs)for 1160 sequelae of 289 diseases and injuries 1990-2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2163-2196.

